Quais as reações adversas e os efeitos colaterais do Zurampic?
Resumo do perfil de segurança
A segurança de Lesinurad 200 mg foi avaliada nos ensaios clínicos de terapêutica combinada de Fase III (incluindo estudos de extensão).
As reações adversas notificadas com mais frequência durante o tratamento com Lesinurad 200 mg são gripe, doença de refluxo gastroesofágico, cefaleia e creatininemia aumentada. As reações adversas graves de insuficiência renal, compromisso renal e nefrolitíase foram pouco frequentes (menos de 1 caso em cada 100 doentes). Nos ensaios clínicos, a maioria das reações adversas foram de intensidade ligeira ou moderada e resolvidas sem interromper o tratamento com Lesinurad. A reação adversa mais frequente que originou a interrupção de Lesinurad foi a creatininemia aumentada (0,8%).
Lista tabelada de reações adversas
As reações adversas são classificadas de acordo com as Classes de Sistemas de Órgãos e frequência. As categorias de frequência são definidas de acordo com as seguintes convenções: muito frequentes (≥ 1/10), frequentes (≥ 1/100 a < 1/10), pouco frequentes (≥ 1/1.000 a < 1/100), raros (≥ 1/10.000 a < 1/1.000) e muito raros (< 1/10.000).
A Tabela 1 lista as reações adversas identificadas em estudos clínicos com doentes a tomar Lesinurad 200 mg uma vez por dia em associação com um inibidor da xantina oxidase, alopurinol ou febuxostate.
Tabela 1. Reações adversas por Classes de Sistemas de Órgãos e frequência:
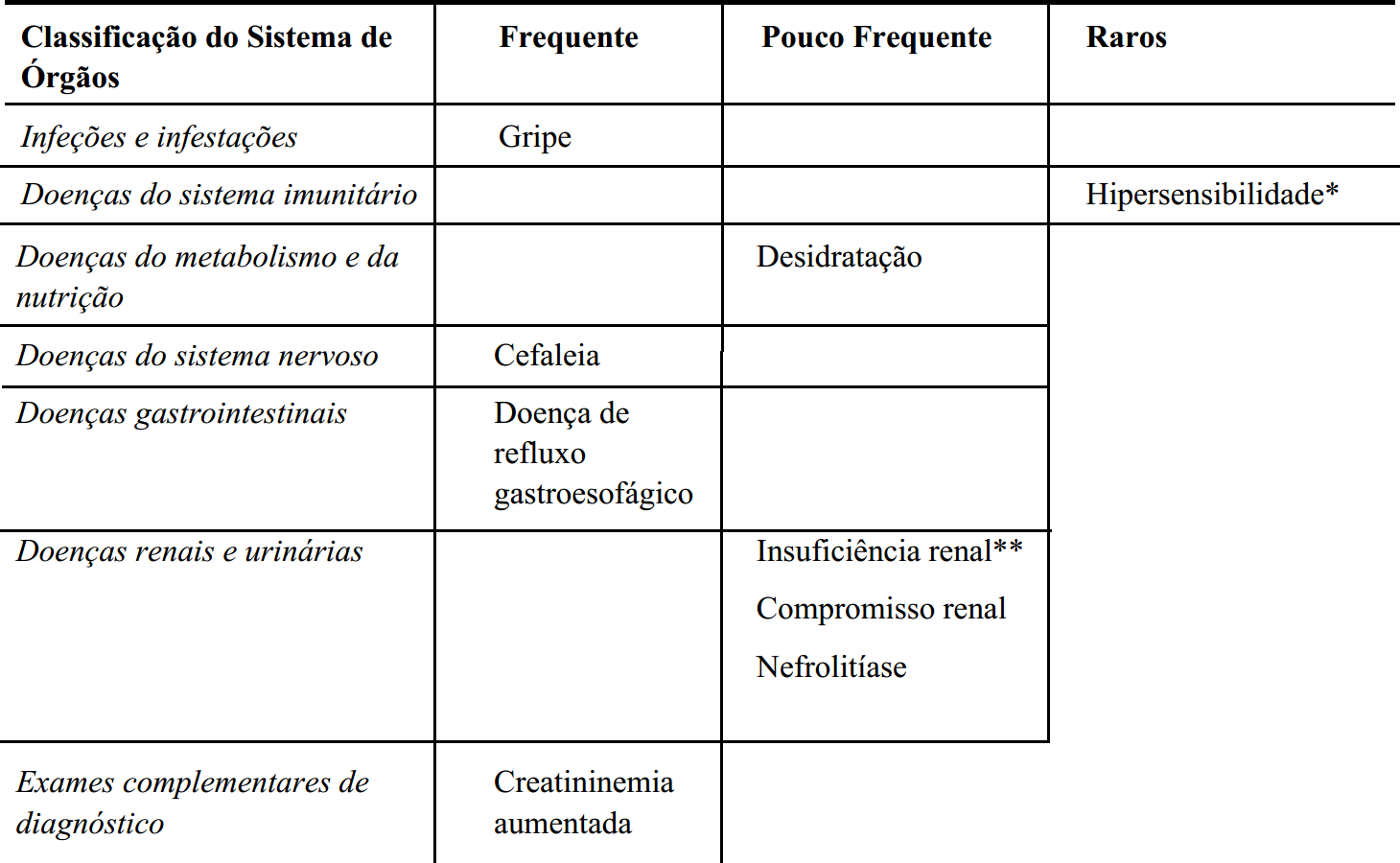
*Fotodermatose, reação de fotossensibilidade, dermatite alérgica, prurido e urticária.
**Inclui os termos preferenciais: insuficiência renal, insuficiência renal crónica e insuficiência renal aguda.
Descrição das reações adversas selecionadas
Acontecimentos renais
Lesinurad origina um aumento na excreção renal de ácido úrico, o que pode levar a aumentos transitórios da creatininemia, reações adversas renais e pedras nos rins. Apesar de terem sido estudadas outras doses, a dose recomendada de Lesinurad é 200 mg por dia em associação com um inibidor da xantina oxidase.
Em três ensaios de 12 meses controlados com placebo de Lesinurad em associação com um inibidor da xantina oxidase versus um inibidor da xantina oxidase isolado (placebo), as elevações dos níveis de creatininemia entre 1,5-2 vezes acima da linha basal ocorreram em 3,9% dos doentes a tomar Lesinurad 200 mg, 10,0% dos doentes a tomar Lesinurad 400 mg e 2,3% com placebo; as elevações dos níveis de creatininemia 2 vezes ou mais acima da linha basal ocorreram em 1,8% dos doentes a tomar Lesinurad 200 mg, 6,7% dos doentes a tomar Lesinurad 400 mg e 0% com placebo. Em geral, estas elevações da creatininemia resolveram-se, na sua maioria sem interrupção do tratamento. As reações adversas renais foram notificadas em doentes tratados com Lesinurad 200 mg (5,7%) e Lesinurad 400 mg (11,8%) comparativamente ao placebo (4,5%), resultando na interrupção do tratamento em 1,2%; 3,3% e 1% respetivamente. A reação adversa renal mais frequente foi creatininemia aumentada (4,3% com Lesinurad 200 mg e 7,8% com Lesinurad 400 mg comparativamente a 2,3% com placebo).
Em doentes com compromisso renal moderado, a incidência de reações adversas renais foi semelhante em todos os grupos de tratamento:
Lesinurad 200 mg (12,7%), Lesinurad 400 mg (16,3%) e placebo (13,3%).
Reações adversas renais graves, p.ex. insuficiência renal aguda e compromisso renal foram notificadas em doentes tratados com Lesinurad 400 mg (1%) e placebo (0,4%) e em nenhum doente tratado com Lesinurad 200 mg. Incluindo a combinação dos estudos de extensão de longo prazo, as incidências de reações adversas renais graves (incluindo insuficiência renal aguda) por 100 doentes-anos de exposição foram 0,4 e 1,4 para Lesinurad 200 mg e Lesinurad 400 mg, em combinação com um inibidor da xantina oxidase, respetivamente. Os dados dos estudos de extensão a longo prazo até 24 meses revelaram um perfil de segurança renal de acordo com o observado em estudos controlados com placebo.
Num estudo de 6 meses, com dupla ocultação e em monoterapia de Lesinurad controlado com placebo, foram notificadas reações adversas renais e reações adversas renais graves (incluindo insuficiência renal aguda) em 17,8% e em 4,7% dos doentes tratados com Lesinurad 400 mg isoladamente e em nenhum dos doentes tratados com placebo, respetivamente. Entre as reações adversas renais graves foram notificadas: insuficiência renal, insuficiência renal aguda e compromisso renal em 1,9%; 1,9% e 0,9%, respetivamente, dos doentes tratados com Lesinurad 400 mg em monoterapia e em nenhum dos doentes tratados com placebo. Dado que a incidência de reações adversas renais graves aumentou em monoterapia comparativamente à terapêutica combinada com um inibidor da xantina oxidase, Lesinurad não deve ser utilizado em monoterapia.
Nos estudos de 12 meses de Lesinurad em associação com um inibidor da xantina oxidase foi permitida a entrada de doentes com história clínica de pedras nos rins. Nestes estudos, as reações adversas de pedras nos rins (sendo nefrolitíase a mais frequente) foram notificadas em doentes tratados com Lesinurad 200 mg (0,6%), Lesinurad 400 mg (2,5%) e placebo (1,7%).
Segurança cardiovascular
Nos estudos clínicos de terapêutica combinada, controlados com placebo, aleatorizados em dupla ocultação, as incidências de doentes com Acontecimentos Adversos Cardiovasculares Major adjudicados (morte CV, enfarte do miocárdio não fatal e AVC não fatal) por 100 doentes-anos de exposição foram 0,71 (IC 95% 0,23; 2,21) para placebo, 0,96 (IC 95% 0,36; 2,57) para Lesinurad 200 mg, e 1,94 (IC 95% 0,97; 3,87) para Lesinurad 400 mg quando utilizado em associação com um inibidor da xantina oxidase.
Uma relação causal com Lesinurad não foi estabelecida.
Todos os doentes com Acontecimentos Adversos Cardiovasculares Major tratados com Lesinurad 200 mg tinham história clínica de insuficiência cardíaca, AVC, ou enfarte do miocárdio. Uma análise post-hoc num subgrupo de doentes com risco cardiovascular basal elevado (definido por acidente isquémico transitório, angina de peito, insuficiência cardíaca, enfarte do miocárdio, doença vascular periférica e/ou AVC) mostrou que a incidência de Acontecimentos Adversos Cardiovasculares Major foi 1/52 para placebo e 4/53 para Lesinurad 200 mg quando utilizado em associação com um inibidor da xantina oxidase.
Hipersensibilidade
Durante o programa clínico de Lesinurad foram notificados casos raros de hipersensibilidade (fotodermatose, reação de fotossensibilidade, dermatite alérgica, prurido e urticária). Nenhum deles foi grave ou exigiu hospitalização.
Outras populações especiais
Doentes com compromisso renal
Não foram observadas diferenças na segurança de Lesinurad em doentes com compromisso renal ligeiro ou moderado (eClCr de 30-89 mL/min) comparativamente a doentes com função renal normal.
Notificação de suspeitas de reações adversas
A notificação de suspeitas de reações adversas após a autorização do medicamento é importante, uma vez que permite uma monitorização contínua da relação benefício-risco do medicamento. Pede-se aos profissionais de saúde que notifiquem quaisquer suspeitas de reações adversas através do sistema nacional de notificação mencionado no Apêndice V.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)