Qual a ação da substância do Zurampic?
Características Farmacológicas
Propriedades farmacodinâmicas
Grupo farmacoterapêutico: Preparações Antigota, Preparações que aumentam a eliminação de ácido úrico.
Código ATC: M04AB05.
Mecanismo de ação
O Lesinurad é um inibidor seletivo da reabsorção de ácido úrico que inibe o transportador de ácido úrico URAT1. O URAT1 é responsável pela maioria da reabsorção de ácido úrico filtrado no lúmen tubular renal. Pela inibição do URAT1, o Lesinurad aumenta a excreção de ácido úrico e consequentemente diminui o ácido úrico sérico (AUs). O Lesinurad também inibe o OAT4, um transportador de ácido úrico envolvido na hiperuricemia induzida por diuréticos.
O Lesinurad, quando combinado com um inibidor da xantina oxidase, aumenta a excreção de ácido úrico e diminui a sua produção, o que dá lugar a uma redução maior do AUs. O Lesinurad só deve ser utilizado em associação com um inibidor da xantina oxidase, já que a utilização da associação reduz a quantidade de ácido úrico disponível para excreção e diminui o risco de acontecimentos renais.
Efeitos farmacodinâmicos
Efeitos no ácido úrico sérico e na excreção urinária de ácido úrico:
Em indivíduos saudáveis, o Lesinurad 200 mg baixou os níveis de AUs e aumentou a depuração renal e excreção fracionada de ácido úrico. As reduções de AUs médias após administração de Lesinurad 200 mg isoladamente foram aproximadamente 46% e 26% às 6 horas e 24 horas pós-dose respetivamente. Quando Lesinurad 200 mg foi adicionado a um inibidor da xantina oxidase (i.e. febuxostate), reduções adicionais nas AUs de 25% e 19% foram observadas às 6 horas e 24 horas pós-dose, respetivamente.
Efeito na repolarização cardíaca:
Em indivíduos saudáveis, Lesinurad em doses até 1.600 mg, não demonstrou qualquer efeito nos parâmetros do ECG (incluindo intervalo QTc).
Eficácia e segurança clínicas:
A eficácia de Lesinurad 200 mg e 400 mg administrado uma vez por dia foi avaliada em 3 estudos clínicos multicêntricos, aleatorizados, em dupla ocultação e controlados com placebo, em 1.537 doentes adultos (13% destes doentes eram idosos, ≥ 65 anos de idade) com hiperuricemia e gota, em associação com um inibidor da xantina oxidase, alopurinol (CLEAR1 e CLEAR2) ou febuxostate (CRYSTAL). Todos os estudos tiveram uma duração de 12 meses e os doentes receberam tratamento profilático para as exacerbações de gota com colchicina ou AINEs durante os primeiros 5 meses de tratamento com Lesinurad.
Com base nestes estudos, Lesinurad é apenas recomendado numa dose de 200 mg uma vez por dia em associação com um inibidor da xantina oxidase.
Lesinurad como adjuvante ao alopurinol em doentes com respostas inadequadas:
Os estudos CLEAR1 e CLEAR2 incluiram doentes com gota que se encontravam numa dose estável de alopurinol de pelo menos 300 mg (ou 200 mg para doentes com compromisso renal moderado), tinham níveis de ácido úrico sérico superiores a 6,5 mg/dl e notificaram pelo menos 2 exacerbações de gota nos últimos 12 meses. Em ambos os estudos, 61% dos doentes tinham compromisso renal ligeiro ou moderado e 19% tinham tofos no início. Os doentes continuaram com a sua dose de alopurinol e foram aleatorizados 1:1:1 para receber uma vez por dia Lesinurad 200 mg, Lesinurad 400 mg, ou placebo.
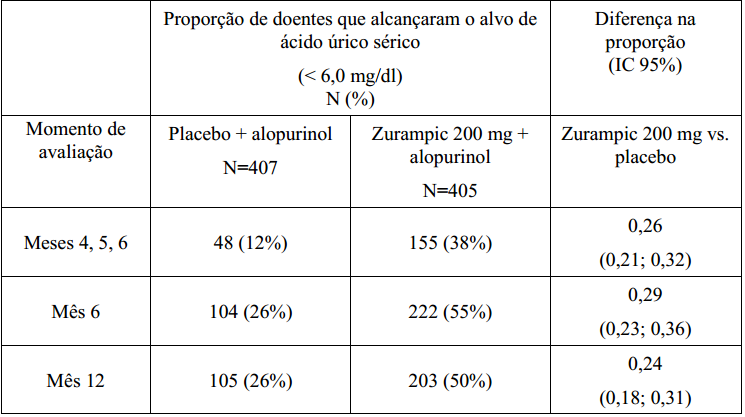
O objetivo primário de eficácia em ambos os estudos CLEAR1 e CLEAR2 foi a proporção de doentes que alcançaram um nível alvo de ácido úrico sérico inferior a 6 mg/dl ao Mês 6. Em ambos os estudos, significativamente mais doentes tratados com Lesinurad 200 mg em associação com alopurinol alcançaram os níveis alvo de ácido úrico sérico inferiores a 6 mg/dl ao Mês 6 e ao Mês 12, comparativamente a doentes que receberam placebo em combinação com alopurinol.
A estabilidade da resposta mantida foi demonstrada, com uma maior proporção de doentes tratados com Lesinurad 200 mg em associação com alopurinol atingindo os níveis alvo de ácido úrico sérico a cada visita durante 3 meses consecutivos (Meses 4, 5, e 6) comparativamente aos doentes tratados com placebo em associação com alopurinol.
Tabela 2. Proporção de doentes que alcançaram os níveis alvo de ácido úrico sérico (< 6 mg/dl) com Lesinurad em combinação com alopurinol – Dados agrupados dos estudos CLEAR1 e CLEAR2:
Quando Lesinurad foi adicionado ao alopurinol originou redução imediata dos níveis médios de ácido úrico sérico, em comparação com placebo, que foi mantida a longo prazo nos doentes que continuaram o tratamento.
Figura 1. Níveis médios de ácido úrico sérico em estudos clínicos agrupados com Lesinurad em associação com alopurinol em doentes com resposta inadequada (AUs ≥ 6 mg/dl) ao alopurinol em monoterapia:
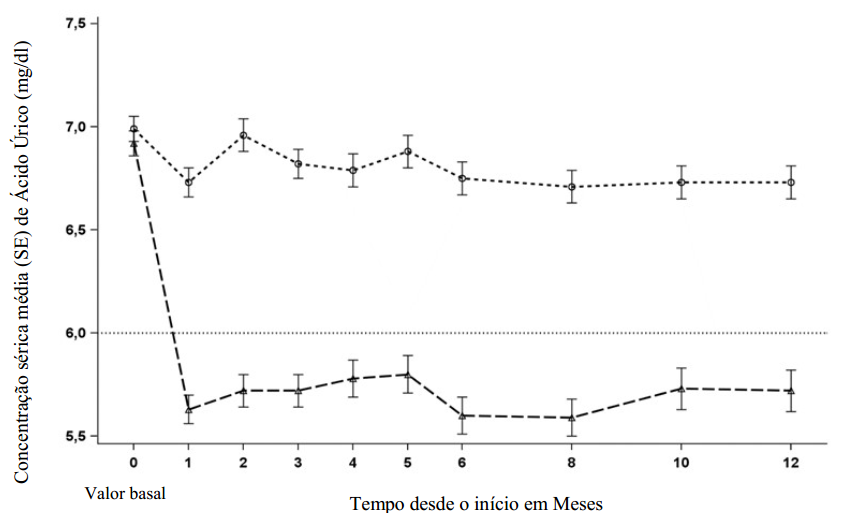
Grupo de tratamento: --o-- Placebo + alopurinol, —Δ— Zurampic 200mg + alopurinol.
Em cada estudo, uma proporção maior de doentes tratados com Lesinurad 200 mg em associação com alopurinol, comparativamente aos doentes tratados com placebo em associação com alopurinol, atingiu um nível de ácido úrico sérico inferior a 5 mg/dl ao Mês 6 (CLEAR1: 29% versus 10%; CLEAR2: 35% versus 5%).
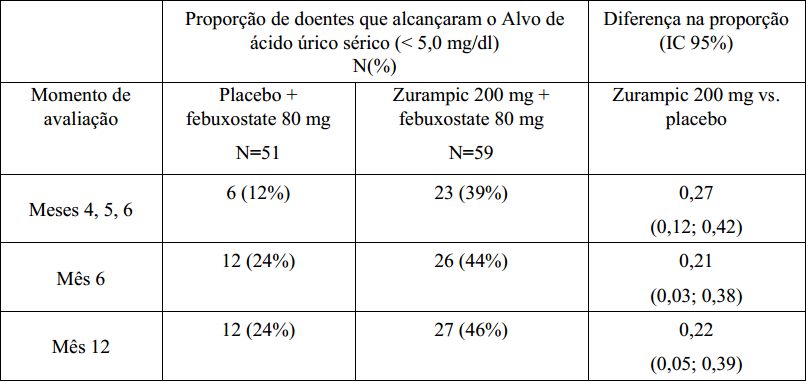
Lesinurad em associação com febuxostate na gota tofácea O estudo CRYSTAL incluiu doentes com gota com tofos mensuráveis. Os doentes receberam febuxostate 80 mg uma ver por dia, durante 3 semanas, sendo depois aleatorizados 1:1:1 para doses diárias de Lesinurad 200 mg, Lesinurad 400 mg, ou placebo em associação com febuxostate. Sessenta e seis porcento dos doentes tinham compromisso renal ligeiro ou moderado. Cinquenta porcento dos doentes tinham um valor basal AUs ≥ 5,0 mg/dl, depois de 3 semanas de tratamento com febuxostate em monoterapia.
Quando Lesinurad foi adicionado ao febuxostate originou uma redução imediata dos níveis médios de ácido úrico sérico em comparação com placebo, que foi mantida a longo prazo nos doentes que continuaram o tratamento.
No subgrupo de doentes com uma concentração basal de AUs ≥ 5,0 mg/dl, após 3 semanas de tratamento com febuxostate, foi alcançada uma diferença estatisticamente significativa em todas as visitas do estudo com Lesinurad 200 mg em associação com febuxostate em comparação com placebo em associação com febuxostate.
Tabela 3. Proporção de doentes com valor basal de AUs ≥ 5,0 mg/dl que alcançaram os níveis alvo de ácido úrico sérico (< 5 mg/dl) com Lesinurad em associação com febuxostate:
Objetivo primário em doentes com compromisso renal:
Tal como na população geral do estudo, a proporção de doentes com compromisso renal ligeiro a moderado (eClCr 30-89 mL/min) que alcançou os níveis alvo de ácido úrico sérico ao Mês 6 foi de 56% para Lesinurad 200 mg versus 29% para placebo quando associados com alopurinol, e de 40% para Lesinurad 200 mg versus 26% para placebo quando associados com febuxostate em doentes com valor basal AUs ≥ 5,0 mg/dl.
Resultados clínicos – exacerbações de gota que requerem tratamento:
Nos últimos 6 meses dos ensaios aleatorizados (uma vez interrompida a profilaxia de exacerbação de gota), as taxas de exacerbação de gota que necessitaram tratamento foram baixas e comparáveis a placebo com uma mediana das pontuações de 0. Nos ensaios abertos de extensão a longo prazo, as taxas de exacerbações de gota que necessitaram tratamento diminuíram ainda mais nos 60% de indivíduos que participaram nos estudos de extensão e continuaram o tratamento com Lesinurad 200 mg em associação com alopurinol ou febuxostate ao longo de um ano adicional de tratamento.
Resultados clínicos – resolução e redução dos tofos:
No estudo CRYSTAL, a proporção de indivíduos que experienciaram uma resolução completa (definida como uma resolução de 100% de pelo menos um tofo alvo e sem nenhum tofo a apresentar progressão) de ≥ 1 tofo alvo foi superior no grupo tratado com Lesinurad 200 mg em associação com febuxostate comparativamente com placebo em associação com febuxostate, apesar das diferenças não serem estatisticamente significativas (26% comparativamente a 21%). Após a continuação do tratamento até 24 meses com Lesinurad 200 mg em associação com febuxostate, a proporção de indivíduos que experimentaram resolução completa de pelo menos um tofo alvo aumentou para 53% dos indivíduos.
População pediátrica
A Agência Europeia de Medicamentos dispensou a obrigação de apresentação dos resultados dos estudos com Lesinurad em todos os subgrupos da população pediátrica para a prevenção e tratamento de hiperuricemia.
Propriedades farmacocinéticas
Absorção
A biodisponibilidade absoluta de Lesinurad é aproximadamente de 100%. Após administração oral o Lesinurad é rapidamente absorvido. Após a administração de uma dose oral única de Lesinurad, quer em jejum quer após ingestão de alimentos, as concentrações plasmáticas máximas (Cmax) foram alcançadas no prazo de 1 a 4 horas. As exposições de Cmax e AUC de Lesinurad aumentaram proporcionalmente com doses únicas de Lesinurad entre 5 a 1200 mg. Com ingestão de alimentos, após uma dose única de Lesinurad 200 mg, as médias geométricas de Cmax e AUC de Lesinurad foram de 6 µg/mL e 29 µg/h/mL, respetivamente. Aparentemente não há influência do conteúdo lipídico de uma refeição na farmacocinética de Lesinurad. Nos ensaios clínicos, Lesinurad foi administrado com alimentos, uma vez que a redução de ácido úrico sérico melhorava nessas condições.
Lesinurad é administrado como uma mistura 50:50 de atropisomeros de Lesinurad. A AUC(0-24) da razão do atropisomero 1 para atropisomero 2 foi de 44:56 porque o atropisomero 1 sofre uma metabolização mais extensiva do que o atropisomero 2, provocando uma exposição plasmática do atropisomero 1 inferior à do atropisomero 2.
Distribuição
O Lesinurad liga-se extensivamente (mais de 98%) às proteinas plasmáticas, maioritariamente à albumina.
A ligação às proteínas plasmáticas não é significativamente alterada em doentes com compromisso renal ou hepático. O volume de distribuição médio de Lesinurad em estado estacionário foi aproximadamente 20 l após administração intravenosa. Os quocientes médios plasma/sangue da AUC e Cmax de Lesinurad foram aproximadamente 1,8, indicando que a radioatividade ficou confinada em grande medida ao espaço plasmático e não houve penetração ou partição extensiva para os eritrócitos.
Biotransformação
O Lesinurad sofre metabolismo oxidativo principalmente via citocromo P450 (CYP) 2C9 para o metabolito intermédio M3c (não detetado in vivo) e é subsequentemente metabolizado pelo HEm no metabolito M4; existe uma contribuição mínima do CYP1A1, CYP2C19 e CYP3A no metabolismo do Lesinurad. O atropisomero 1 é extensivamente metabolizado pelo CYP2C9 enquanto que o atropisomero 2 sofre uma metabolização mínima por ambos CYP2C9 e CYP3A4. Não é claro que as exposições do metabolito plasmático sejam mínimas. Não se sabe se os metabolitos contribuem para os efeitos redutores de ácido úrico de Lesinurad.
Eliminação
A depuração renal é 25,6 mL/min (CV=56%). O Lesinurad liga se extensivamente às proteínas e a depuração renal é elevada (em comparação com a taxa de filtração glomerular humana típica), indicando que a excreção ativa desempenha um papel importante na excreção renal do Lesinurad. Nos 7 dias após uma toma única de Lesinurad marcado radioativamente, 63% da dose radioativa administrada foi recuperada na urina e 32% da dose radioativa administrada foi recuperada nas fezes. A maioria da radioatividade recuperada na urina (> 60% da dose) ocorreu nas primeiras 24 horas. O Lesinurad inalterado na urina representou aproximadamente 30% da dose. A semivida (t½) de eliminação de Lesinurad foi de aproximadamente 5 horas após uma dose única. Após múltiplas doses não há acumulação de Lesinurad.
Linearidade / não linearidade
Após múltiplas administrações de Lesinurad uma vez por dia, não houve evidência de alterações dependentes do tempo nas propriedades farmacocinéticas, conservado-se a proporcionalidade da dose.
Avaliação de interações in vitro
O Lesinurad é maioritariamente metabolizado pelo CYP2C9 e HEm, e em menor extensão pelo CYP1A1, CYP2C19 e CYP3A. In vitro, o Lesinurad é um inibidor do CYP2C8, mas não do CYP1A2, CYP2B6, CYP2C9, CYP2C19, CYP2D6, CYP3A4 e HEm. Adicionalmente in vitro, o Lesinurad é um indutor do CYP2B6 e CYP3A via CAR/PXR. In vivo, o Lesinurad não é nem um inibidor nem um indutor do CYP2C9 e 2C8, mas um indutor ligeiro a moderado do CYP3A. In vivo, o CYP2B6 não foi estudado.
O Lesinurad é um substrato do OATP1B1, OAT1, OAT3 e OCT1. In vitro, em concentrações plasmáticas clinicamente relevantes, o Lesinurad é um inibidor do OATP1B1, OAT1, OAT3, OAT4 e OCT1. Contudo, a atividade in vivo do OATP1B1, OAT1, OAT3 e OCT1 não foi afetada pelo Lesinurad. In vitro, o Lesinurad não é um inibidor da glicoproteína-P, BCRP, OATP1B3, MRP2, MRP4, OCT2, MATE1 e MATE2-K.
Populações especiais
Compromisso renal:
Os dados clínicos da análise farmacocinética populacional em doentes com gota tratados até 12 meses estimam aumentos na exposição de Lesinurad de aproximadamente 12%, 31% e 65% em doentes com compromisso renal ligeiro, moderado e grave, respetivamente, comparativamente a doentes com função renal normal.
Após a administração de uma dose única de Lesinurad a indivíduos com compromisso renal, comparativamente a indivíduos com função renal normal, a Cmax e AUC de Lesinurad foram, respetivamente, 36% e 30% superiores (200 mg) em doentes com compromisso renal ligeiro (eClCr de 60 a 89 mL/min), 20% e 73% superiores (200 mg) e 3% e 50% superiores (400 mg) em doentes com compromisso renal moderado (eClCr de 30 a 59 mL/min), e 13% inferiores e 113% superiores (400 mg) em doentes com compromisso renal grave (eClCr < 30 mL/min).
Compromisso hepático:
Após administração de uma dose única de Lesinurad 400 mg em doentes com compromisso hepático ligeiro (classe A de Child-Pugh) ou moderado (classe B de Child-Pugh), a Cmax de Lesinurad foi comparável a indivíduos com função hepática normal e a AUC de Lesinurad foi 7% e 33% superior, respetivamente. Não existe experiência clínica em doentes com compromisso hepático grave (classe C Child-Pugh).
Metabolizadores fracos do CYP2C9:
Aproximadamente metade de uma dose oral de Lesinurad é eliminada através da via metabólica CYP2C9.
O efeito do genótipo CYP2C9 na farmacocinética do Lesinurad foi estudado em 8 indivíduos saudáveis e 59 doentes com gota após uma dose diária de Lesinurad variando entre 200 mg a 600 mg na ausência ou presença de um inibidor da xantina oxidase. Na dose de 400 mg, quando comparado com grandes metabolizadores do CYP2C9 (CYP2C9 *1/*1 [N=41]) observou-se maior exposição de Lesinurad em metabolizadores intermédios do CYP2C9 (CYP2C9 *1/*3 [N=4], um aumento aproximado da AUC de 22%) e em metabolizadores fracos do CYP2C9 (CYP2C9 *3/*3 [N=1], um aumento aproximado da AUC de 111%) acompanhada de maior excreção renal de Lesinurad. Não obstante, os valores individuais encontravam-se dentro do intervalo observado para indivíduos que eram grandes metabolizadores.
Os doentes que se sabe ou se suspeita serem metabolizadores fracos do CYP2C9 com base em história prévia ou experiência com outros substratos CYP2C9 devem utilizar Lesinurad com precaução.
Outras populações especiais:
Com base na análise farmacocinética populacional, idade, género, raça e etnia não têm qualquer efeito clinicamente significativo na farmacocinética de Lesinurad. Com base numa simulação de um modelo farmacocinético, prevê-se que doentes com compromisso renal moderado e reduzida atividade CYP2C9 (administração concomitante de um inibidor CYP2C9 ou metabolizador fraco do CYP2C9) tenham um aumento da AUC de aproximadamente 200% em comparação com função renal normal e atividade CYP2C9 não comprometida.
Dados de segurança pré-clínica
Os dados não clínicos não revelam riscos especiais para o ser humano, segundo estudos convencionais de farmacologia de segurança, toxicidade de dose repetida, genotoxicidade, potencial carcinogénico, toxicidade reprodutiva e desenvolvimento.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)