Qual a ação da substância do Kaletra?
Resultados de Eficácia
Pacientes Sem Terapia Antirretroviral Prévia
Estudo M98-863: Lopinavir + Ritonavir cápsulas duas vezes ao dia + estavudina + lamivudina em comparação a nelfinavir três vezes ao dia + Estavudina + Lamivudina
O Estudo M98-863 foi um ensaio randomizado, duplo-cego, multicêntrico, comparando o tratamento com Lopinavir + Ritonavir cápsulas (400/100 mg duas vezes ao dia) mais estavudina e lamivudina versus nelfinavir (750 mg três vezes ao dia) mais estavudina e lamivudina em 653 pacientes sem tratamento antirretroviral prévio (naive).
Os pacientes tinham uma média de idade de 38 anos (faixa: 19 a 84), 57% eram caucasianos e 80% eram do sexo masculino. A contagem celular média basal de CD4 foi de 259 células/mm³ (faixa: 2 a 949 células/mm³) e a concentração plasmática basal média de RNA HIV-1 foi de 4,9 log10 cópias/mL (faixa: 2,6 a 6,8 log10 cópias/mL).
A resposta ao tratamento e os resultados do tratamento randomizado estão presentes na figura a seguir e na tabela a seguir, respectivamente:
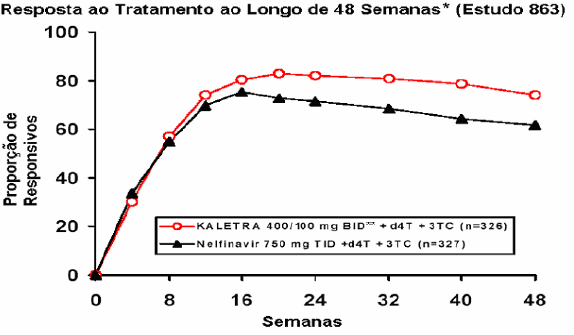
* Proporção de pacientes que, a cada momento na escala de tempo, atingiram e mantiveram uma concentração plasmática de RNA do HIV <400 cópias/mL, e que estão sob sua medição original do estudo e que não experimentaram um novo evento CDC Classe C.
** BID - Bis in die ou duas vezes ao dia.
Resultados do Tratamento Randomizado até a Semana 48 (Estudo 863) | ||
Resultado | Lopinavir + Ritonavir + d4T + 3TC (N=326) | Nelfinavir + d4T + 3TC (N=327) |
Respondedores*1 | 75% | 62% |
Falha virológica2 | 9% | 25% |
Rebote2 | 7% | 15% |
Nunca suprimiu até a Semana 482 | 2% | 9% |
Morte | 2% | 1% |
Descontinuou por evento adverso | 4% | 4% |
Descontinuou por outras razões3 | 10% | 8% |
* Corresponde às taxas na Semana 48 da Figura acima.
1 Pacientes atingiram e mantiveram RNA HIV confirmado de <400 cópias/mL até a Semana 48.
2 Inclui as situações confirmadas de rebotes virais e falhas para atingir <400 cópias/mL, até a Semana 48.
3 Inclui perda de acompanhamento, retirada do paciente, não-aderência, violação do protocolo e outras razões.
Descontinuação global até a Semana 48, incluindo pacientes que descontinuaram após a ocorrência de falha virológica, foi de 17% no grupo com Lopinavir + Ritonavir e de 24% no grupo com Nelfinavir.
Ao longo de 48 semanas de tratamento, houve uma proporção estatística e significativamente maior de pacientes no braço com Lopinavir + Ritonavir , em comparação ao braço com Nelfinavir, que apresentaram níveis plasmáticos de RNA HIV menores que 400 cópias/mL (75% versus 62%, respectivamente) e RNA HIV <50 cópias/mL (67% versus 52%, respectivamente).
A resposta ao tratamento pelos subgrupos de nível basal de RNA HIV é apresentada na tabela a seguir:
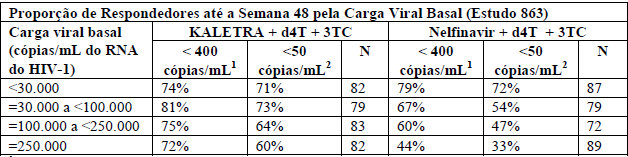 1 Pacientes atingiram e mantiveram concentração plasmática confirmada do RNA do HIV <400 cópias/mL até a Semana 48.
1 Pacientes atingiram e mantiveram concentração plasmática confirmada do RNA do HIV <400 cópias/mL até a Semana 48.
2 Pacientes atingiram RNA HIV <50 cópias/mL até a Semana 48.
Ao longo de 48 semanas de tratamento, o aumento médio desde a linha basal na contagem de células CD4 foi de 207 células/mm³ para o braço com Lopinavir + Ritonavir e de 195 células/mm³ para o braço com Nelfinavir.
A Figura a seguir exibe as estimativas de Kaplan-Meier do tempo para a falha de tratamento no Estudo 863. O tempo até a falha de tratamento foi definido como o menor tempo para que o paciente experimentasse falha virológica (2 valores consecutivos de RNA HIV demonstrando rebote, acima de 400 cópias/mL), um novo evento CDC de Classe C ou descontinuação prematura do estudo.
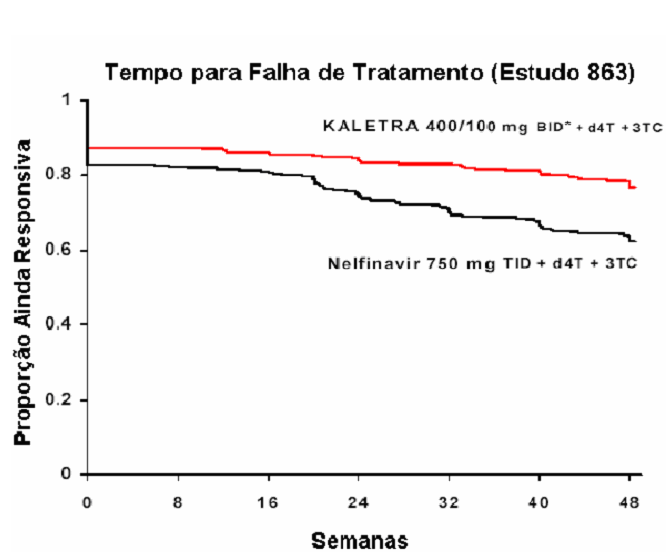
*BID - Bis in die ou duas vezes ao dia.
Estudo M97-720: Lopinavir + Ritonavir cápsulas duas vezes ao dia + Estavudina + Lamivudina
O Estudo M97-720 foi um ensaio randomizado, cego e multicêntrico avaliando o tratamento com Lopinavir + Ritonavir cápsulas em três diferentes doses (Grupo I: 200/100 mg duas vezes ao dia e 400/100 mg duas vezes ao dia; Grupo II: 400/100 mg duas vezes ao dia e 400/200 mg duas vezes ao dia) mais Lamivudina (150 mg duas vezes ao dia) e Estavudina (40 mg duas vezes ao dia), em 100 pacientes.
Todos os pacientes foram convertidos a Lopinavir + Ritonavir para o estudo de forma aberta na concentração de 400/100 mg duas vezes ao dia entre as Semanas 48 e 72 do estudo. Os pacientes tinham uma média de idade de 35 anos (faixa: 21 a 59), 70% eram caucasianos e 96% eram do sexo masculino.
A contagem celular média basal de CD4 era de 338 células/mm³ (faixa: 3 a 918 células/mm³) e o nível plasmático médio basal de RNA HIV-1 era de 4,9 log10 cópias/mL (faixa: 3,3 a 6,3 log10 cópias/mL).
Ao longo das 360 semanas de tratamento no Estudo 720, a proporção de pacientes com RNA HIV < 400 cópias/mL (< 50 cópias/mL) foi de 61% (59%) [n=100] e o aumento médio correspondente na contagem de células CD4 foi de 501 células/mm³. Trinta e nove pacientes (39%) descontinuaram o estudo, incluindo 15 (15%) descontinuações por eventos adversos e uma (1%) morte.
Dezoito pacientes demonstraram perda da resposta virológica (2 valores plasmáticos consecutivos para o RNA HIV-1 acima de 400 cópias/mL, um valor de rebote do RNA do HIV-1 seguido por descontinuação, ou falha em atingir o RNA HIV-1 <400 cópias/mL).
Análise genotípica de isolados virais foi conduzida nestes pacientes e em 10 pacientes adicionais com valores de RNA HIV-1 isolados > 400 cópias/ml após a semana 24. Os resultados de 19 pacientes não mostraram mutações primárias ou ativas na protease (aminoácidos nas posições 8, 30, 32, 36, 47, 48, 50, 82, 84 e 90) ou resistência fenotípica a inibidor de protease.
Estudo M05-730: Lopinavir + Ritonavir comprimidos uma vez a dia + Tenofovir DF + emtricitabina comparado com Lopinavir + Ritonavir duas vezes ao dia + Tenofovir DF + entricitabina
O Estudo M05-730 foi um ensaio randomizado, aberto e multicêntrico comparando o tratamento de Lopinavir + Ritonavir 800/200 mg uma vez ao dia com tenofovir DF e Emtricitabina com Lopinavir + Ritonavir 400/100 mg duas vezes ao dia mais tenofovir DF e entricitabina em 664 pacientes sem tratamento antirretroviral prévio (naive).
Os pacientes foram randomizados na razão 1:1 para receber Lopinavir + Ritonavir 800/200mg uma vez ao dia (n=333) ou Lopinavir + Ritonavir 400/100 mg duas vezes ao dia (n=331).
Uma estratificação adicional foi feita em cada grupo na proporção 1:1 (comprimidos versus cápsulas). Os pacientes que receberam cápsulas foram transferidos para a formulação comprimidos na oitava semana e mantidos na posologia da randomização. Os pacientes receberam 200 mg de emtricitabina e 300 mg de tenofovir DF uma vez ao dia. A média de idade dos pacientes foi de 39 anos (faixa: 19 a 71 anos); 75% eram caucasianos e 78% do sexo masculino.
A contagem celular média basal de CD4 era de 216 células/mm³ (faixa: 20 a 775 células/mm³) e o nível plasmático médio basal de RNA HIV-1 era de 5,0 log10 cópias/mL (faixa: 1,7 a 7,0 log10 cópias/mL).
A resposta ao tratamento e os resultados do tratamento randomizado na semana 48 estão presentes na tabela a seguir:
Resultados do Tratamento Randomizado até a Semana 48 (Estudo 730) | ||
Resultado | Lopinavir + Ritonavir uma vez ao dia + TDF + FTC (N=333) | Lopinavir + Ritonavir duas vezes ao dia + TDF + FTC (N=331) |
Respondedores1 | 78% | 77% |
Falha virológica2 | 10% | 8% |
Rebote2 | 5% | 5% |
Nunca suprimiu até a Semana 482 | 5% | 3% |
Morte | 1% | < 1% |
Descontinuou por evento adverso | 4% | 3% |
Descontinuou por outras razões3 | 8% | 11% |
1 Pacientes atingiram e mantiveram RNA HIV-1 confirmado de <50 cópias/mL até a Semana 48.
2 Inclui as situações confirmadas de rebotes virais e falhas para atingir <50 cópias/mL, até a Semana 48.
3 Inclui perda de acompanhamento, retirada do paciente, não-aderência, violação do protocolo e outras razões.
Até a Semana 48 de terapia, 78% dos pacientes do braço de Lopinavir + Ritonavir uma vez ao dia e 77% do braço Lopinavir + Ritonavir duas vezes ao dia atingiram e mantiveram RNA HIV-1 <50 cópias/mL (95% do intervalo de confiança e diferença de 5,9% para 6,8%).
A contagem celular média de CD4 aumentou na Semana 48 foi de 186 células/mm³ no braço Lopinavir + Ritonavir uma vez ao dia e 198 células/mm³ no braço Lopinavir + Ritonavir duas vezes ao dia.
Pacientes com Tratamento Antirretroviral Prévio
Atividade Antiviral de Lopinavir + Ritonavir em Pacientes com Terapia Prévia com Inibidor de Protease
A relevância clínica da sensibilidade reduzida in vitro a lopinavir foi examinada pela avaliação da resposta virológica à terapia com Lopinavir + Ritonavir com relação ao genótipo e fenótipo viral basal, em 56 pacientes naive para NNRTI* com RNA HIV superior a 1.000 cópias/mL, a despeito de terapia prévia com pelo menos 2 inibidores de protease, selecionados entre Nelfinavir, Indinavir, Saquinavir e Ritonavir (Estudo M98-957).
Nesse estudo, os pacientes foram inicialmente randomizados para receber uma de duas doses de Lopinavir + Ritonavir , em combinação com efavirenz e inibidores nucleosídeos da transcriptase reversa.
*NNRTI = Non-Nucleoside Reverse Transcriptase Inhibitor ou Inibidor Não-nucleosídeo da Transcriptase Reversa.
Os valores para a EC50 de lopinavir contra os 56 isolados virais basais, variaram de números entre 0,5 a 96 vezes mais elevados que a EC50 contra o tipo selvagem de HIV. Cinquenta e cinco por cento (31/56) destes isolados basais exibiram uma sensibilidade a lopinavir reduzida mais que 4 vezes. Estes 31 isolados tiveram uma redução média na sensibilidade a lopinavir de 27,9 vezes.
Após 48 semanas de tratamento com Lopinavir + Ritonavir , efavirenz e inibidores nucleosídeos da transcriptase reversa, um valor plasmático para o RNA HIV menor que, ou igual a, 400 cópias/mL, foi observado em 93% (25/27), 73% (11/15) e 25% (2/8) dos pacientes com sensibilidade a lopinavir reduzida, menos que ou igual a 10 vezes; mais que 10 e menos que 40 vezes e mais que, ou igual a, 40 vezes àquela da linha basal, respectivamente.
A sensibilidade ao lopinavir foi determinada pela tecnologia de fenotipagem recombinante desenvolvida pela Virologic; o genótipo também foi determinado pela Virologic. Um valor plasmático para o RNA HIV menor que, ou igual, a 50 cópias/mL, foi observado em 81% (22/27), 60% (9/15) e 25% (2/8) nos grupos de pacientes acima, respectivamente.
Há dados insuficientes neste momento para identificar os padrões de mutação associados ao lopinavir nos isolados provenientes de pacientes sob tratamento com Lopinavir + Ritonavir. Outros estudos são necessários para avaliar a associação entre padrões mutacionais específicos e taxas de resposta virológica.
Estudo M98-888: Lopinvair + Ritonavir Lopinavir + Ritonavir cápsulas duas vezes ao dia + Nevirapina + ITRNs em comparação a outros inibidores de protease selecionados pelo Investigador + Nevirapina + ITRNs
O Estudo 888 foi um ensaio randomizado, aberto, multicêntrico comparando o tratamento com Lopinavir + Ritonavir cápsulas (400/100 mg duas vezes ao dia) + Nevirapina e inibidores nucleosídeos da transcriptase reversa versus outros inibidores de protease selecionados pelo Investigador + Nevirapina e inibidores nucleosídeos da transcriptase reversa, em 288 pacientes que já haviam recebido esquema com inibidor de protease único e que nunca haviam recebido inibidores não-nucleosídeos da transcriptase reversa (NNRTI).
Os pacientes tinham uma média de idade de 40 anos (faixa: 18 a 74), 68% eram caucasianos e 86% eram do sexo masculino.
A contagem celular basal média de CD4 foi de 322 células/mm³ (faixa: 10 a 1.059 células/mm³) e o nível plasmático médio de RNA HIV-1 à linha basal era de 4,1 log10 cópias/mL (faixa: 2,6 a 6,0 log10 cópias/mL).
A resposta ao tratamento e os resultados dos tratamentos randomizados até a Semana 48 são apresentados na figura e na tabela a seguir, respectivamente:
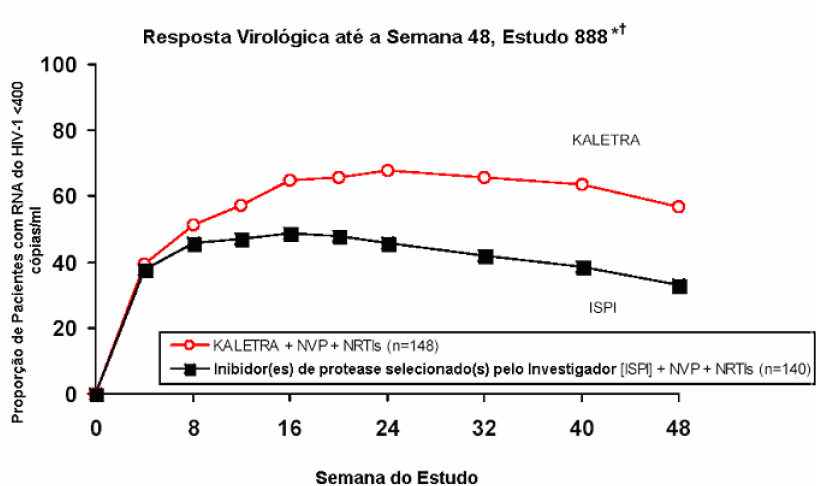
* Ensaio AMPLICOR HIV-1 MONITOR, da Roche.
† Responsivos a cada visita, são os pacientes que habiam atingido e mantido uma concentração de RNA do HIV -1 <400 cópias/ML sem descontinuação naquela visita.
Resultados do Tratamento Randomizado até a Semana 48 (Estudo 888) | ||
Resultado | Lopinavir + Ritonavir + Nevirapina+ ITRNs (N=148) | Inibidor(es) de protease selecionado(s) pelo Investigador + Nevirapina+ ITRNs (N=140) |
Respondedores*1 | 57% | 33% |
Falha virológica2 | 24% | 41% |
Rebote2 | 11% | 19% |
Nunca suprimiu até a Semana 482 | 13% | 23% |
Morte | 1% | 2% |
Descontinuou por evento adverso | 5% | 11% |
Descontinuou por outras razões3 | 14% | 13% |
* Corresponde às taxas na Semana 48 da Figura acima.
1 Pacientes atingiram e mantiveram RNA HIV confirmado de <400 cópias/mL, até a Semana 48.
2 Inclui as situações confirmadas de rebotes virais e falhas para atingir <400 cópias/mL, até a Semana 48.
3 Inclui perda de acompanhamento, retirada do paciente, não-aderência, violação do protocolo e outras razões.
Estudo M97-765: Lopinavir + Ritonavir cápsulas duas vezes ao dia + Nevirapina + NRTIs
O Estudo M97-765 foi um ensaio randomizado, cego, multicêntrico, avaliando tratamento com Lopinavir + Ritonavir cápsulas em 2 níveis de dose (400/100 mg duas vezes ao dia e 400/200 mg duas vezes ao dia) mais Nevirapina(200 mg duas vezes ao dia) e 2 NRTIs em 70 pacientes que já haviam recebido esquema com inibidor de protease único, que nunca haviam recebido inibidores não-nucleosídeos de transcriptase reversa (NNRTI).
Os pacientes tinham uma média de idade de 40 anos (faixa: 22 a 66 anos), 73% eram caucasianos e 90% do sexo masculino. A contagem celular média basal de CD4 era 372 células/mm³ (faixa: 72 a 807 células/mm³) e a concentração plasmática basal média de RNA do HIV-1 era de 4,0 log10 cópias/mL (faixa: 2,9 a 5,8 log10 cópias/mL).
Ao longo de 144 semanas de tratamento no Estudo 765, a proporção de pacientes com RNA HIV <400 (<50) cópias/mL foi de 54% (50%) [n=70] e o correspondente aumento médio na contagem de células CD4 foi de 212 células/mm³. 27 pacientes (39%) descontinuaram o estudo, incluindo 9 (13%) descontinuações secundárias a eventos adversos e 2 (3%) óbitos.
Estudo M06-802 Lopinavir + Ritonavir comprimidos 800/200 mg uma vez ao dia versus Lopinavir + Ritonavir comprimidos 400/100 mg duas vezes ao dia e coadministrados com inibidores da Transcriptase Reversa Análogos de Nucleosídeo/Nucleotídeo em pacientes infectados pelo HIV-1 com experiência aos antirretrovirais
O estudo M06-802 foi um ensaio randomizado, aberto, comparando-se a segurança, tolerabilidade e atividade antirretroviral de Lopinavir + Ritonavir uma vez ao dia e duas vezes ao dia em 599 pacientes com carga viral detectável enquanto recebiam a terapia antirretroviral.
Os pacientes foram randomizados na razão 1:1 para receber Lopinavir + Ritonavir 800/200mg uma vez ao dia (n=300) ou Lopinavir + Ritonavir 400/100 mg duas vezes ao dia (n=299).
Os pacientes recebiam, pelo menos, dois inibidores da transcriptase reversa análogos de nucleosídeos/nucleotídeos selecionados pelo investigador. A média de idade dos pacientes foi de 41 anos (faixa: 21 a 73 anos); 51% eram caucasianos e 66% do sexo masculino.
A contagem celular média basal de CD4 era de 254 células/mm³ (faixa: 4 a 952 células/mm³) e o nível plasmático médio basal de RNA HIV-1 era de 4,3 log10 cópias/mL (faixa: 1,7 a 6,6 log10 cópias/mL).
A resposta ao tratamento e os resultados dos tratamentos randomizados até a Semana 48 são apresentados na tabela a seguir:
Resultados do Tratamento Randomizado até a Semana 48 (Estudo 802) | ||
Resultado | Lopinavir + Ritonavir uma vez ao dia + ITRNs | Lopinavir + Ritonavir duas vezes ao dia + ITRNs |
Respondedores*1 | 55% | 52% |
Falha virológica2 | 25% | 28% |
Rebote2 | 12% | 14% |
Nunca suprimiu até a Semana 482 | 13% | 14% |
Morte | 1% | 1% |
Descontinuou por evento adverso | 4% | 6% |
Descontinuou por outras razões3 | 15% | 14% |
1 Pacientes atingiram e mantiveram RNA HIV-1 confirmado de <50 cópias/mL até a Semana 48.
2 Inclui as situações confirmadas de rebotes virais e falhas para atingir <50 cópias/mL, até a Semana 48.
3 Inclui perda de acompanhamento, retirada do paciente, não-aderência, violação do protocolo e outras razões.
Uso Pediátrico
Estudo M98-9405: Um estudo aberto de fase I/II de ABT-378/ritonavir em combinação com inibidores de transcriptase reversa em pacientes pediátricos infectados com HIV
O Estudo M98-940 foi um ensaio aberto e multicêntrico avaliando o perfil farmacocinético, tolerabilidade, segurança e eficácia de Lopinavir + Ritonavir solução oral contendo lopinavir 80 mg/mL e ritonavir 20 mg/mL, em 100 pacientes pediátricos naive (44%) e que já haviam sido tratados (56%) com algum antirretroviral. Todos os pacientes eram naive para inibidor não-nucleosídeo da transcriptase reversa.
Os pacientes foram randomizados ou para 230 mg lopinavir/57,5 mg Ritonavir por m² ou para 300 mg lopinavir/75 mg Ritonavir por m². Os pacientes naive também receberam Lamivudina e Estavudina. Os pacientes que já haviam sido tratados receberam Nevirapinae até 2 inibidores nucleosídeos da transcriptase reversa.
A segurança, eficácia e perfis farmacocinéticos dos 2 regimes posológicos foram avaliados após 3 semanas de tratamento em cada paciente. Após a análise destes dados, todos os pacientes continuaram sob uma dose de 300 mg de lopinavir/75 mg de ritonavir por m².
Os pacientes tinham uma média de idade de 05 anos (faixa: 06 meses a 12 anos) com 14% deles sendo menores que 02 anos de idade. A contagem celular basal média de CD4 era de 838 células/mm³ e a concentração plasmática média basal de RNA HIV-1 era de 4,7 log10 cópias/mL.
Ao longo das 48 semanas de tratamento, a proporção de pacientes que atingiu e manteve uma concentração plasmática de RNA HIV <400 cópias/mL foi de 80% entre os pacientes naive para antirretrovirais e de 71% entre os pacientes experientes com antirretrovirais.
O aumento médio desde a linha basal na contagem celular de CD4 foi de 404 células/mm³ para os pacientes naive para antirretrovirais e de 284 células/mm³ para os pacientes experimentados, ao longo da 48 semanas.
Descontinuações prematuras foram notadas em 2 (2%) indivíduos antes da Semana 48. Uma destas foi considerada pelo Investigador como “não-relacionada” ao fármaco do estudo, a segunda como “possivelmente” relacionada ao fármaco do estudo.
A seleção de dose para pacientes com 06 meses a 12 anos de idade baseou-se nos resultados a seguir. O regime com 230/57,5 mg/m² duas vezes ao dia sem Nevirapinae o regime com 300/75 mg/m² duas vezes ao dia com Nevirapinaforneceram concentrações plasmáticas de lopinavir similares àquelas obtidas em pacientes adultos recebendo o regime de 400/100 mg duas vezes ao dia (sem nevirapina).
KONCERT/PENTA 18: Estudo randomizado de farmacocinética, segurança e eficácia do uso de Lopinavir + Ritonavir comprimidos duas vezes por dia versus uma vez por dia doseados por peso como parte da combinação da terapia antirretroviral em pacientes pediátricos/crianças, da rede européia. infectados pelo HIV-1 para o tratamento da AIDS
KONCERT/PENTA 18 é um estudo multicêntrico prospectivo, randomizado e aberto que avaliou o perfil farmacocinético, de eficácia e de segurança de dosagem duas vezes por dia versus uma vez por dia de Lopinavir + Ritonavir comprimidos 100/25 mg dosados por peso como parte da terapia antiretroviral combinada (cART) em crianças infectadas com HIV-1 virologicamente suprimidas (n = 173).
As crianças foram elegíveis quando elas tinham idade < 18 anos, ≥ 15 kg de peso, recebendo cART que incluia Lopinavir + Ritonavir , ácido ribonucleico (RNA) de HIV-1 < 50 cópias/mL por pelo menos 24 semanas e capazes de engolir comprimidos.
Na semana 24, a eficácia e segurança com a dosagem de 2 vezes por dia (n=87) na população pediátrica que recebeu Lopinavir + Ritonavir comprimidos 100/25 mg foi consistente com os estudos de eficácia e a segurança em estudos pediátricos e em adultos anteriores, usando Lopinavir + Ritonavir duas vezes por dia.
Características Farmacológicas
Geral
Lopinavir + Ritonavir é uma formulação combinada de lopinavir e ritonavir. O Lopinavir é um inibidor das proteases do HIV-1 e do HIV-2.
O Ritonavir presente na formulação de Lopinavir + Ritonavir inibe o metabolismo mediado pelo CYP3A (citocromo P450 3A) do lopinavir, proporcionando, deste modo, níveis plasmáticos maiores de lopinavir.
Farmacodinâmica
Mecanismo de ação:
Lopinavir é um inibidor das proteases do HIV-1 e HIV-2. A inibição da protease previne a clivagem da poliproteína gag-pol levando à formação de um vírus imaturo, não infeccioso.
O tempo de início de ação não é aplicável para Lopinavir + Ritonavir uma vez que este medicamento é administrado cronicamente. Com uma dose de 400/100 mg, duas vezes ao dia, as concentrações mínimas de lopinavir são superiores a EC50 do vírus de tipo selvagem (0,07 mcg / mL) por um fator maior que 50, sugerindo que as concentrações de lopinavir são mantidas para a eficácia em todo o intervalo de doses.
Atividade antiviral in vitro:
A atividade antiviral de lopinavir foi avaliada in vitro contra cepas laboratoriais e clínicas do HIV em linhagens de células linfoblásticas e isolados clínicos do HIV em linfócitos periféricos de sangue, infectados agudamente.
Na ausência do soro humano, a CE50 (concentração eficaz 50%) de lopinavir contra cinco cepas laboratoriais diferentes de HIV-1 variou de 10 a 27 nM (0,006 a 0,017 mcg/mL, 1 mcg/mL equivalente a 1,6 μM) e variou de 4 a 11 nM (0,003 a 0,007 mcg/mL) contra vários isolados clínicos de HIV-1 (n=6).
Na presença de 50% de soro humano, a CE50 do Lopinavir contra essas 5 cepas laboratoriais variou de 65 a 289 nM (0,04 a 0,18 mcg/mL), representando uma atenuação de 7 a 11 vezes. Estudos sobre a atividade da combinação de substâncias com Lopinavir e outros inibidores de proteases ou inibidores da transcriptase reversa não foram completados.
Resistência:
Isolados de HIV-1 com sensibilidade reduzida ao Lopinavir foram selecionados in vitro. A presença do ritonavir não parece influenciar a seleção de vírus resistentes ao lopinavir in vitro.
Ainda não foi caracterizada a seleção de resistência ao Lopinavir + Ritonavir no tratamento antirretroviral em pacientes que nunca receberam antirretrovirais. Em um estudo de fase III envolvendo 653 pacientes que nunca haviam recebido tratamento antirretroviral (Estudo 863), foram analisados os isolados virais plasmáticos de cada paciente em tratamento que apresentou HIV plasmático maior do que 400 cópias/mL nas semanas 24, 32, 40 e/ou 48.
Nenhuma evidência de resistência genotípica ou fenotípica a Lopinavir + Ritonavir foi observada em 37 pacientes avaliáveis tratados com Lopinavir + Ritonavir (0%).
Evidência de resistência genotípica a nelfinavir, definida como a presença de mutação D30N e/ou L90M na protease do HIV, foi observada em 25/76 (33%) dos pacientes avaliáveis tratados com nelfinavir. A seleção de resistência a Lopinavir + Ritonavir em pacientes pediátricos que nunca haviam recebido tratamento antirretroviral (Estudo 940), parece ser consistente com aquela vista em pacientes adultos (Estudo 863).
Resistência ao Lopinavir + Ritonavir foi observada em pacientes que fizeram uso prévio de outros inibidores de protease antes da terapia com Lopinavir + Ritonavir.
Em estudos de Fase II com 227 pacientes que nunca haviam recebido tratamento com antirretroviral e multiexperimentados com inibidores de protease, 4 de 23 pacientes com carga viral maior que 400 cópias/mL após tratamento com Lopinavir + Ritonavir por 12 a 100 semanas, mostraram sensibilidade significativamente reduzida ao lopinavir em comparação aos correspondentes isolados virais basais.
Três desses pacientes haviam recebido previamente tratamento com um único inibidor de protease (Nelfinavir, Indinavir ou Saquinavir) e um paciente havia recebido tratamento com múltiplos inibidores de proteases (indinavir, saquinavir, ritonavir).
Os quatro pacientes apresentavam pelo menos 4 mutações associadas à resistência ao inibidor de protease imediatamente antes do tratamento com Lopinavir + Ritonavir.
Depois da replicação viral, todos os isolados desses pacientes continham mutações adicionais, algumas das quais são sabidamente associadas à resistência a inibidores de protease. Entretanto, os dados são insuficientes até o momento para identificar padrões de mutação associada ao lopinavir em isolados de pacientes em tratamento com Lopinavir + Ritonavir. A avaliação desses padrões de mutação está em estudo.
Resistência cruzada:
Estudos pré-clínicos:
Entre os inibidores de proteases foram observados vários graus de resistência cruzada. Foi determinada a atividade in-vitro do lopinavir contra isolados clínicos de pacientes previamente tratados com um único inibidor de protease.
Isolados que apresentaram sensibilidade reduzida acima de 4 vezes, ao nelfinavir (n=13) e saquinavir (n=4), apresentaram sensibilidade reduzida abaixo de 4 vezes ao lopinavir.
Isolados com sensibilidade reduzida acima de 4 vezes ao indinavir (n=16) e ritonavir (n=3) apresentaram a média de redução de sensibilidade de 5,7 e 8,3 vezes em relação ao lopinavir, respectivamente. Isolados de pacientes previamente tratados com dois ou mais inibidores de protease apresentaram maior redução da sensibilidade ao Lopinavir, conforme descrito no item “Resultados de Eficácia: Atividade antiviral do Lopinavir + Ritonavir em pacientes previamente tratados com inibidores de protease”.
Resistência cruzada durante tratamento com Lopinavir + Ritonavir:
Dispõe-se de pouca informação a respeito da resistência cruzada de vírus selecionados durante o tratamento com Lopinavir + Ritonavir.
Isolados de quatro pacientes tratados previamente com um ou mais inibidores de protease que desenvolveram resistência fenotípica ao Lopinavir durante o tratamento com Lopinavir + Ritonavir , tanto permaneceram com a resistência cruzada ou desenvolveram resistência cruzada ao Ritonavir, Indinavir e Nelfinavir.
Todos os vírus permaneceram completamente sensíveis ou apresentaram sensibilidade modestamente reduzida ao amprenavir (resistência de até 8,5 vezes concomitante a 99 vezes ao lopinavir). Os isolados virais de dois indivíduos sem tratamento prévio ao saquinavir permaneceram completamente sensíveis ao saquinavir.
Correlatos genotípicos de resposta virológica reduzida em pacientes com tratamento antirretroviral prévio iniciando terapia combinada com Lopinavir + Ritonavir:
A resposta virológica a Lopinavir + Ritonavir mostrou-se afetada pela presença de três ou mais das seguintes substituições aminoácidas na protease basal: L10F/I/R/V, K20M/N/R, L24I, L33F, M36I, I47V, G48V, I54L/T/V, V82A/C/F/S/T e I84V.
A tabela abaixo mostra a resposta virológica de 48 semanas (RNA HIV menor que 400 cópias/ mL) de acordo com as mutações da resistência de inibição de protease basal acima mencionadas nos Estudos 888 e 765 e Estudo 957.
Resposta virológica (RNA HIV menor que 400 cópias/ mL) na Semana 48 pela susceptibilidade basal de Lopinavir + Ritonavir e pelo número de substituições de protease associado à resposta a Lopinavir + Ritonavir 1:
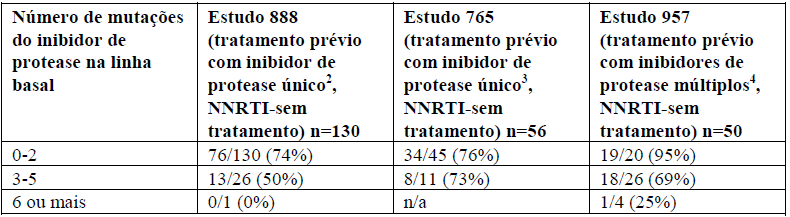 1 Substituições consideradas na análise incluem L10F/I/R/V, K20M/N/R, L24I, L33F, M36I, I47V, G48V, I54L/T/V, V82A/C/F/S/T e I84V.
1 Substituições consideradas na análise incluem L10F/I/R/V, K20M/N/R, L24I, L33F, M36I, I47V, G48V, I54L/T/V, V82A/C/F/S/T e I84V.
2 43% indinavir, 42% Nelfinavir, 10% ritonavir, 15% saquinavir.
3 41% indinavir, 38% Nelfinavir, 4% ritonavir, 16% saquinavir.
4 86% indinavir, 54% nelfinavir, 80% ritonavir, 70% saquinavir.
Farmacocinética
As propriedades farmacocinéticas do lopinavir coadministrado com ritonavir foram avaliadas em voluntários adultos sadios e em pacientes infectados pelo HIV; e não foram observadas diferenças substanciais entre os 2 grupos. O Lopinavir é completamente metabolizado pelo CYP3A. O Ritonavir inibe o metabolismo do lopinavir, aumentando, deste modo, os níveis plasmáticos de lopinavir.
Nos estudos, a administração de Lopinavir + Ritonavir 400/100 mg, duas vezes ao dia, proporcionou concentrações plasmáticas médias no estado de equilíbrio (steady-state) 15 a 20 vezes maiores do que aquelas com ritonavir, em pacientes infectados pelo HIV.
Os níveis plasmáticos de ritonavir são menos de 7% daqueles obtidos após a administração de 600 mg de ritonavir duas vezes ao dia. A CE50 antiviral do lopinavir in vitro é aproximadamente 10 vezes menor do que a do Ritonavir. Deste modo, a atividade antiviral de Lopinavir + Ritonavir é devida ao Lopinavir.
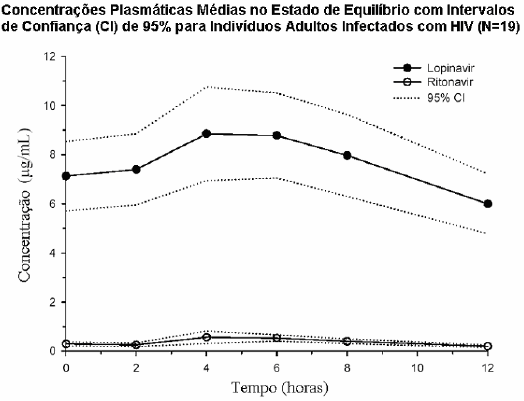
A Figura a seguir mostra as concentrações plasmáticas médias obtidas no estado de equilíbrio de lopinavir e ritonavir, após Lopinavir + Ritonavir 400/100 mg duas vezes ao dia com alimentação por 3 semanas; dado este proveniente de um estudo farmacocinético em indivíduos adultos infectados com HIV (n=19).
As concentrações plasmáticas de lopinavir e ritonavir após a administração de 2 comprimidos de 200/50 mg, são equivalentes àquelas de 3 cápsulas de 133/33 mg sob condição de não-jejum, com menos variabilidade farmacocinética.
Absorção:
Em um estudo de farmacocinética com 19 pacientes infectados pelo HIV, a administração múltipla de Lopinavir + Ritonavir 400/100 mg, duas vezes ao dia, com alimentos, durante 3 semanas produziu uma concentração plasmática pico (Cmáx) (média ± desvio padrão) de 9,8 ± 3,7 μg/mL, que ocorreu aproximadamente 4 horas após a administração.
A concentração média no estado de equilíbrio antes da dose matinal foi de 7,1 ± 2,9 μg/mL e a Cmin no intervalo da dose foi de 5,5 ± 2,7 μg/mL. A AUC do lopinavir durante um período de administração de 12 horas foi em média de 92,6 ± 36,7 μg.h/mL.
A biodisponibilidade absoluta de lopinavir em fórmula combinada com ritonavir não foi determinada em humanos. Sob condições pós–prandiais (500 kcal/ 25% proveniente de gordura), as concentrações de lopinavir foram similares na administração de Lopinavir + Ritonavir cápsulas e solução oral.
Na administração de Lopinavir + Ritonavir em jejum, a AUC e a Cmáx do lopinavir foram 22% menores para o Lopinavir + Ritonavir solução oral em relação às cápsulas.
Efeitos da alimentação sobre a absorção oral:
Lopinavir + Ritonavir cápsulas e solução oral foram bioequivalentes em condições pós-prandiais (refeição com teor moderado de gordura).
A administração de uma dose única de 400/100 mg de Lopinavir + Ritonavir cápsulas com uma refeição com teor moderado de gordura (500-682 Kcal, 23 a 25% de calorias provenientes de gordura) foi associada com um aumento médio de 48% e 23% na AUC e na Cmáx do lopinavir, respectivamente, em relação ao jejum.
Para Lopinavir + Ritonavir solução oral os aumentos correspondentes na AUC e na Cmáx de lopinavir foram de 80% e 54%, respectivamente. A administração de Lopinavir + Ritonavir com uma refeição rica em gorduras (872 Kcal, 56% provenientes de gordura) aumentou a AUC e a Cmáx do lopinavir em 97% e 43%, respectivamente, para as cápsulas e 130% e 56%, respectivamente, para a solução oral.
Para aumentar a biodisponibilidade e minimizar a variabilidade, Lopinavir + Ritonavir deve ser tomado com as refeições.
Distribuição:
No estado de equilíbrio, lopinavir está aproximadamente 98-99% ligado a proteínas plasmáticas. O lopinavir se liga tanto à alfa-1 glicoproteína ácida quanto à albumina, no entanto, tem maior afinidade pela alfa-1 glicoproteína ácida.
No estado de equilíbrio, a ligação de lopinavir a proteínas permanece constante em todas as concentrações observadas após a administração de Lopinavir + Ritonavir , 400/100 mg, duas vezes ao dia, e é similar em voluntários sadios e pacientes HIV- positivos.
Metabolismo:
Experiências in vitro com microssomas hepáticos humanos indicam que lopinavir sofre principalmente metabolismo oxidativo. Lopinavir é extensamente metabolizado pelo sistema citocromo P450 hepático, quase que exclusivamente pela isoenzima CYP3A. O ritonavir é um potente inibidor do CYP3A, inibindo o metabolismo do lopinavir e, deste modo, aumentando os níveis plasmáticos de lopinavir.
Um estudo com Lopinavir marcado com 14C em humanos mostrou que 89% da radioatividade plasmática após uma administração única de Lopinavir + Ritonavir 400/ 100 mg foi decorrente da droga-mãe.
Pelo menos 13 metabólitos oxidativos de lopinavir foram identificados no ser humano. O Ritonavir mostrou induzir enzimas metabólicas, resultando na indução de seu próprio metabolismo. As concentrações de Lopinavir antes da administração diminuem com o tempo com a administração múltipla, estabilizando após cerca de 10 a 16 dias.
Eliminação:
Após uma dose de 400/100 mg de Lopinavir/Ritonavir marcados com 14C, aproximadamente 10,4 ± 2,3% e 82,6 ± 2,5% de uma dose administrada de lopinavir marcado com 14C pode ser encontrado na urina e nas fezes, respectivamente, depois de 8 dias. Lopinavir inalterado correspondeu a aproximadamente 2,2% e 19,8% da dose administrada na urina e fezes, respectivamente. Após múltiplas doses, menos de 3% da dose de lopinavir é excretada inalterada pela urina. A depuração aparente (CL/F) do lopinavir é 5,98 ± 5,75 L/h (média ± desvio padrão, n= 19).
Administração uma vez ao dia:
A farmacocinética de Lopinavir + Ritonavir comprimido administrado uma única vez ao dia foi avaliada em pacientes sem tratamento antirretroviral prévio (naive). Lopinavir + Ritonavir (Lopinavir/Ritonavir) 800mg/200mg foi administrado em combinação com emtricitabina 200mg e tenofovir DF 300mg como parte do esquema posológico de uma vez ao dia.
Múltiplas doses de Lopinavir + Ritonavir comprimido 800mg/200mg uma vez ao dia por 2 semanas sem restrição alimentar (n=16) produziram uma média ± desvio padrão da Cmax de 14,8 ± 3,5μg/mL, a qual ocorreu aproximadamente 6 horas após a administração. A concentração mínima no estado de equilíbrio de lopinavir antes da administração matinal foi de 5,5 ± 5,4 μg/mL e a concentração mínima dentro do período entre doses foi de 3,2 ± 3,4 μg/mL. A AUC de lopinavir em um intervalo de 24 horas de administração foi em média 206,5 ± 89,7 μg•h/mL.
Efeitos no Eletrocardiograma:
O intervalo QTcF foi avaliado em um estudo controlado cruzado, randomizado, placebo e ativo (moxifloxacina 400 mg/uma vez ao dia), com 39 adultos sadios, com 10 medidas durante 12 horas no Dia 3. A média de diferença máxima (intervalo de confiança superior a 95%) no QTcF do placebo foi de 3,6 (6,3) mseg e 13,1 (15,8) mseg para Lopinavir/Ritonavir 400/100 mg duas vezes ao dia e supraterapêutica de 800/200 mg duas vezes ao dia, respectivamente.
Os dois regimes resultaram em exposições no Dia 3 de, aproximadamente, 1,5 a 3 vezes maior que as observadas com as doses recomendadas nas terapias de dose única diária e duas doses diárias no estado de equilíbrio. Nenhum voluntário teve um aumento na QTcF > 60 mseg da baseline ou um intervalo QTcF que excedesse o limite clinicamente relevante de 500 mseg.
Um discreto prolongamento no intervalo PR também foi verificado em voluntários recebendo Lopinavir/Ritonavir durante o mesmo estudo no Dia 3. O intervalo PR máximo foi de 286 mseg e não houve bloqueio cardíaco de segundo ou terceiro graus em voluntários deste estudo.
Carcinogênese e mutagênese:
Estudos de longo prazo sobre carcinogênese com Lopinavir + Ritonavir em ratos revelaram a indução não-genotóxica, não-mitogênica de tumores hepáticos, geralmente considerados de baixo risco em humanos. Estudos de carcinogênese em ratos não se mostraram tumorigênicos.
O Lopinavir não se mostrou mutagênico ou clastogênico em uma bateria de ensaios in vitro, incluindo o teste de Ames de mutação bacteriana reversa, o teste de linfoma em camundongos e testes de aberração cromossômica em linfócitos humanos. Lopinavir + Ritonavir não foi mutagênico ou clastogênico em testes in vivo com micronúcleos de camundongos.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)