Como o Arava age no organismo?
Resultados de Eficácia
Artrite Reumatoide
A eficácia da leflunomida foi demonstrada em três estudos, mostrando redução de sinais/sintomas e inibição de danos nas juntas. Em dois estudos, também melhorou a função física. Todos usaram dose inicial de 100 mg/dia por três dias, seguida de 20 mg/dia.
US301
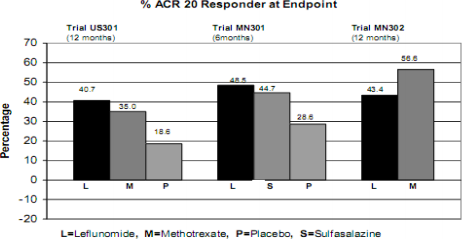
Estudo placebo-controlado de 2 anos com 482 pacientes. Após 52 semanas, 52,2% no grupo leflunomida tiveram resposta ACR20 vs 26,3% no placebo.
MN301/303/305
Estudo placebo-controlado de 24 semanas com 358 pacientes. Após 6 meses, 54,6% no grupo leflunomida tiveram resposta ACR20 vs 28,6% no placebo.
MN302/304
Estudo ativo-controlado (sem placebo) de 52 semanas com 999 pacientes. Após 12 meses, 51,1% no grupo leflunomida tiveram resposta ACR20 vs 65,2% no metotrexato.
Sinais e Sintomas
Avaliados pelo índice ACR20. Leflunomida foi superior ao placebo em redução de sinais/sintomas. O efeito apareceu após 1 mês, estabilizou entre 3-6 meses e continuou. Respostas ACR50 e ACR70 também foram melhores.
Figura 1: Taxas de resposta ACR no desfecho
| - | Comparações | Intervalo de Confiança | Valor p |
US301 | Leflunomida vs. Placebo | (12, 32) | < 0,0001 |
Metotrexato vs. Placebo | (8, 30) | < 0,0001 | |
Leflunomida vs. Metotrexato | (-4, 16) | NS | |
MN301 | Leflunomida vs. Placebo | (7, 33) | 0,0026 |
Sulfassalazina vs. Placebo | (4, 29) | 0,0121 | |
Leflunomida vs. Sulfassalazina | (-8, 16) | NS | |
MN302 | Leflunomida vs. Metotrexato | (-19, -7) | < 0,0001 |
Figura 2: Percentual de pacientes com resposta ACR20 ao longo do tempo*
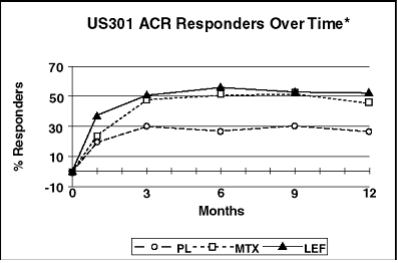
*Última observação realizada.
Tabela 1: Resumo das Taxas de Resposta ACR*
Grupo de Estudo e Tratamento | ACR20 | ACR50 | ACR70 |
Estudos Placebo-Controlados | |||
US301 (12 meses) | |||
Leflunomida (n=178)† | 52,2‡ | 34,3‡ | 20,2‡ |
Placebo (n=118)† | 26,3 | 7,6 | 4,2 |
Metotrexato (n=180)† | 45,6 | 22,8 | 9,4 |
MN301 (6 meses) | |||
Leflunomida (n=130)† | 54,6‡ | 33,1‡ | 10,0§ |
Placebo (n=91)† | 28,6 | 14,3 | 2,2 |
Sulfassalazina (n=132)† | 56,8 | 30,3 | 7,6 |
Estudos sem grupo placebo | |||
MN302 (12 meses) | |||
Leflunomida (n=495)† | 51,1 | 31,1 | 9,9 |
Metotrexato (n=489)† | 65,2 | 43,8 | 16,4 |
*Análise por intenção de tratamento (ITT) utilizando a técnica da Última Observação Realizada (LOCF), para pacientes que interromperam o tratamento precocemente.
† N é o número de pacientes ITT para os quais havia dados adequados disponíveis para cálculo das taxas indicadas.
‡ p > 0,001 leflunomida vs. placebo.
§ p > 0,02 leflunomida vs. placebo.
Tabela 2: Alteração Média nos Componentes do Índice ACR*:
Componentes | Estudos Placebo-Controlados | Estudo Não-Placebo Controlado | ||||||
| --- | US301 (12 meses) | MN301 - Não-EUA (6 meses) | MN302 - Não-EUA (12 meses) | |||||
| --- | Leflunomida | Metotrexato | Placebo | Leflunomida | Sulfassalazina | Placebo | Leflunomida | Metotrexato |
Contagem de articulação dolorosa1 | -7,7 | -6,6 | -3,0 | -9,7 | -8,1 | -4,3 | -8,3 | -9,7 |
Contagem de articulação tumefacta1 | -5,7 | -5,4 | -2,9 | -7,2 | -6,2 | -3,4 | -6,8 | -9,0 |
Avaliação global do paciente2 | -2,1 | -1,5 | 0,1 | -2,8 | -2,6 | -0,9 | -2,3 | -3,0 |
Avaliação global do médico2 | -2,8 | -2,4 | -1,0 | -2,7 | -2,5 | -0,8 | -2,3 | -3,1 |
Função física /desabilidade (MHAQ/HAQ) | -0,29 | -0,15 | 0,07 | -0,50 | -0,29 | -0,04 | -0,37 | -0,44 |
Intensidade da dor2 | -2,2 | -1,7 | -0,5 | -2,7 | -2,0 | -0,9 | -2,1 | -2,9 |
Taxa de sedimentação eritrocitária | -6,26 | -6,48 | 2,56 | -7,48 | -16,56 | 3,44 | -10,12 | -22,18 |
Proteína C-reativa | -0,62 | -0,50 | 0,47 | -2,26 | -1,19 | 0,16 | -1,86 | -2,45 |
Não incluído no Índice ACR | ||||||||
Rigidez matinal (min) | -101,4 | -88,7 | 14,7 | -93,0 | -42,4 | -6,8 | -63,7 | -86,6 |
* Última observação realizada; Alterações negativas indicam melhoras.
1 Com base na contagem de 28 articulações.
2 Escala Visual Analógica: 0 = Melhor; 10 = Pior.
Inibição do dano estrutural
Avaliada pelo Escore Sharp (erosões e redução do espaço articular). Leflunomida foi superior ao placebo na inibição da progressão da doença.
Figura 3: Alteração média no Escore Sharp total*
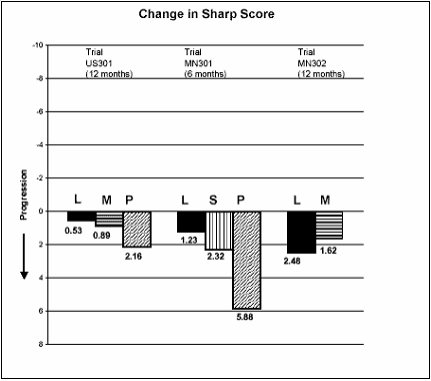
L = leflunomida.
M = metotrexato.
S = sulfassalazina.
P = placebo.
Comparações | Intervalo de Confiança 95% | Valor p | |
US301 | Leflunomida vs. Placebo | (-4,0 , -1,1) | 0,0007 |
Metotrexato vs. Placebo | (-2,6 , -0,2) | 0,0196 | |
Leflunomida vs. Metotrexato | (-2,3 , 0,0) | 0,0499 | |
MN301 | Leflunomida vs. Placebo | (-6,2 , -1,8) | 0,0004 |
Sulfassalazina vs. Placebo | (-6,9 , 0,0) | 0,0484 | |
Leflunomida vs. Sulfassalazina | (-3,3 , 1,2) | NS | |
MN302 | Leflunomida vs. Metotrexato | (-2,2 , 7,4) | NS |
Melhora na função física
Avaliada pelo HAQ (Questionário de Avaliação de Saúde). Leflunomida foi superior ao placebo na melhora da função física.
Figura 4: Alteração média no HAQ DI*
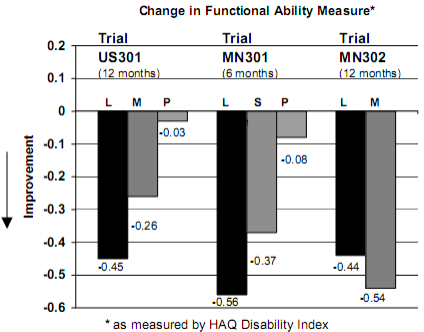
L = leflunomida.
M = metotrexato.
S = sulfassalazina.
P = placebo.
Comparações | Intervalo de Confiança 95% | Valor p | |
US301 | Leflunomida vs. Placebo | (-0,58 , -0,29) | 0,0001 |
Leflunomida vs. Metotrexato | (-0,34 , -0,07) | 0,0026 | |
MN301 | Leflunomida vs. Placebo | (-0,67 , -0,36) | < 0,0001 |
Leflunomida vs. Sulfassalazina | (-0,33 , -0,03) | 0,0163 | |
MN302 | Leflunomida vs. Metotrexato | (0,01 , 0,16) | 0,0221 |
Artrite Psoriásica
Estudo de 6 meses com leflunomida vs placebo. 59,0% no grupo leflunomida tiveram resposta PsARC vs 29,7% no placebo (p<0,0001). Também houve melhora significativa nos escores PASI (avaliação de psoríase).
Tabela 3: Alteração Média nos Componentes do Índice PsARC*
Componentes | Estudo placebo-controlado (6 meses) | ||
| --- | Leflunomida (n=95) | Placebo (n=91) | Valores de p |
Escore de articulação dolorosa* | -9,1 | -4,6 | 0,0022 |
Escore de articulação tumefacta* | -6,8 | -4,2 | 0,0013 |
Avaliação global do médico – com melhora em pelo menos uma categoria1 | 52,6% | 34,1% | < 0,0001 |
Auto-avaliação global do paciente – com melhora em pelo menos uma categoria1 | 31,6% | 30,8% | 0,0036 |
* Alterações negativas indicam melhoras.
1 escala Likert de 5 pontos: 1 = Muito bom; 5 = Muito pobre.
Gravidez
Estudo prospectivo mostrou defeitos congênitos em 5,4% dos nascidos vivos após exposição inadvertida no primeiro trimestre (vs 4,2% nos grupos controle). O estudo não altera a contraindicação.
Estudos pós-comercialização
Estudo com pacientes virgens de tratamento com DMARD não mostrou benefício adicional com dose inicial de ataque. A resposta ACR20 foi 58,5% com dose de ataque vs 77,8% sem (p = 0,025).
Características Farmacológicas
Farmacodinâmica
A leflunomida é um agente antirreumático com propriedades antiproliferativas. Seu metabólito ativo (A771726) inibe a enzima di-hidroorotato desidrogenase (DHODH), reduzindo a síntese de pirimidina em linfócitos e outras células de divisão rápida.
Farmacocinética
A leflunomida é rapidamente convertida em A771726. Após dose única, o pico plasmático de A771726 ocorre entre 1-24 horas. A absorção não é afetada por alimentos. A dose de manutenção é 20 mg/dia, com concentração plasmática média de 35 µg/mL. Ligação às proteínas plasmáticas é extensa (≈99,4%). Meia-vida de eliminação é ≈2 semanas. Eliminada por metabolismo hepático e excreção biliar/fecal. Pacientes com problemas renais ou hepáticos requerem cautela.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)