Qual a ação da substância do Oncaspar?
Resultados de Eficácia
Estudos clínicos LLA em primeira linha
A segurança e eficácia de Pegaspargase foram avaliadas em um estudo aberto, multicêntrico, randomizado, com controle ativo (Estudo 1). Neste estudo foram randomizados, na proporção de 1:1, Pegaspargase ou L-asparaginase nativa de E. coli, 118 pacientes pediátricos com idade de 1 a 9 anos e LLA de risco padrão, não tratada anteriormente, como parte de uma terapia combinada.
O Pegaspargase foi administrado por via intramuscular, na dose de 2500 Unidades/m2, no Dia 3 da fase de Indução de 4 semanas e no Dia 3 de cada uma dasfases de Intensificação Tardia (DI) de 8 semanas. A L-asparaginase nativa de E. coli foi administrada por via intramuscular, na dose de 6.000 Unidades/m2, três vezes por semana, por 9 doses durante a fase de indução e por 6 doses durante cada fase de intensificação tardia.
A determinação primária da eficácia foi baseada na demonstração da depleção da asparagina similar (magnitude e duração) nos grupos de Pegaspargase e L-asparaginase nativa de E. coli. O objetivo especificado pelo protocolo foi atingir uma concentração sérica de asparagina ≤ 1 µM. A proporção de pacientes com este nível de depleção foi similar entre os 2 braços do estudo, durante todas as 3 fases de tratamento, nos timepoints especificados pelo protocolo.
Em todas as fases de tratamento, as concentrações séricas de asparagina diminuíram dentro de 4 dias após a primeira dose de asparaginase na fase de tratamento, permanecendo baixas por aproximadamente 3 semanas para os grupos de Pegaspargase e L-asparaginase nativa de E. coli.
As concentrações séricas de asparagina durante a fase de indução são demonstradas na Figura 1. Os padrões de depleção da asparagina sérica nas duas fases de intensificação tardia são similares ao padrão de depleção da asparagina sérica na fase de indução.
Figura 1 - Asparagina sérica média (± erro padrão) durante a fase de indução do Estudo 1:
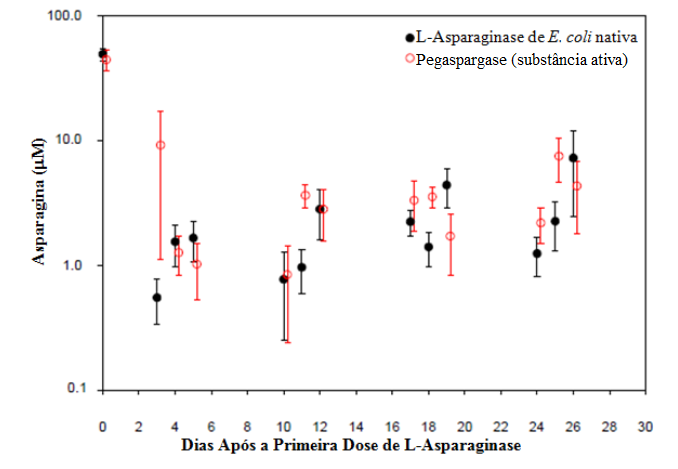
Observação: Pegaspargase (2500 Unidades/m2 por via intramuscular) foi administrado no Dia 3 da fase de indução de 4 semanas. A Lasparaginase nativa de E. coli (6000 Unidades/m2 por via intramuscular) foi administrada 3 vezes por semana, por 9 doses durante a indução.
As concentrações de asparagina no líquido cefalorraquidiano (LCR) foram determinadas em 50 pacientes durante a fase de indução. A asparagina no LCR foi reduzida de uma concentração pré-tratamento média de 3,1 µM para 1,7 µM no Dia 4 ± 1 e 1,5 µM em 25 ± 1 dias após a administração de Pegaspargase. Estes achados foram similares aos observados no grupo de tratamento com a L-asparaginase nativa de E. coli.
Embora a Sobrevida Livre de Eventos (SLE) em três anos para os braços de estudo com Pegaspargase e L-asparaginase nativa de E. coli fosse semelhante e na faixa de 80%, o Estudo 1 não foi projetado para avaliar as diferenças nas taxas de SLE.
Pacientes com LLA hipersensíveis à Asparaginase
A segurança e eficácia do Pegaspargase foi avaliada em 4 estudos abertos que registraram um total de 42 pacientes com múltiplas recaídas de leucemia aguda [39 (93%) com LLA] com histórico de reação alérgica clínica prévia à asparaginase. A hipersensibilidade à asparaginase foi definida por histórico de rash sistêmico, urticária, broncoespasmo, edema laríngeo, hipotensão, ou eritema local, urticária, ou inchaço, superior a 2 centímetros, pelo menos 10 minutos após a administração de qualquer forma de L-asparaginase nativa de E. coli. Todos os pacientes receberam Pegaspargase na dose de 2.000 ou 2.500 Unidades/m2 administradas por via intramuscular ou intravenosa a cada 14 dias.
Os pacientes receberam Pegaspargase como agente único ou em combinação com outras quimioterapias. A taxa de resposta à reindução foi de 50% (intervalo de confiança de 95%: 35%, 65%), com base em 36% de remissões completas e 14% de remissões parciais. Estes resultados foram semelhantes às taxas de resposta globais relatadas para pacientes com LLA que receberam quimioterapia de reindução de segunda linha contendo L asparaginase nativa de E. coli. A atividade antitumoral também foi observada com o Pegaspargase como agente único. Três respostas (1 remissão completa e 2 remissões parciais) foram observadas em 9 pacientes adultos e pediátricos com LLA recidivado e hipersensibilidade à L-asparaginase nativa de E. coli.
Características Farmacológicas
Mecanismo de ação
Considera-se que o mecanismo de ação de Pegaspargase seja baseado em morte seletiva das células leucêmicas devido à depleção da asparagina plasmática. Algumas células leucêmicas são incapazes de sintetizar a asparagina devido à falta de asparagina sintetase e são dependentes de uma fonte exógena de asparagina para sobrevivência. A depleção de asparagina, que resulta do tratamento com a enzima L-asparaginase, mata as células leucêmicas. As células normais, no entanto, são menos afetadas pela depleção devido a sua capacidade de sintetizar a asparagina.
Farmacodinâmica
No Estudo 1, a farmacodinâmica foi avaliada em 57 pacientes pediátricos recém diagnosticados com LLA de risco padrão que receberam três doses intramusculares de Pegaspargase (2.500 Unidades/m2), uma durante a fase de tratamento de indução e duas na fase de intensificação tardia.
A atividade farmacodinâmica foi avaliada através de medições seriadas de asparagina no soro (n = 57) e líquido cefalorraquidiano (LCR) (n = 50). Os dados para a depleção de asparagina foram apresentados nos resultados de eficácia.
Farmacocinética
Avaliações farmacocinéticas foram baseadas em um ensaio enzimático medindo a atividade da asparaginase. A farmacocinética sérica foi avaliada em 34 pacientes pediátricos recém diagnosticados com LLA de risco padrão no Estudo 1 após administração intramuscular de 2.500 Unidades /m2. A meia-vida de eliminação de Pegaspargase foi aproximadamente 5,8 dias durante a fase de indução. Meias-vidas de eliminação similares foram observadas durante a fase de intensificação tardia 1 e intensificação tardia 2. Concentrações maiores que 0,1 Unidade/mL foram observadas em mais de 90% das amostras dos pacientes tratados com Pegaspargase durante a fase de intensificação tardia 1 e intensificação tardia 2 por aproximadamente 20 dias.
Em 3 estudos farmacocinéticos, 37 pacientes com LLA recidivada receberam 2.500 Unidades/m2 de Pegaspargase por via intramuscular a cada 2 semanas. A meia-vida plasmática de Pegaspargase foi 3,2 ± 1,8 dias em 9 pacientes que eram hipersensíveis anteriormente à Lasparaginase nativa de E. coli e 5,7 ± 3,2 dias em 28 pacientes não hipersensíveis. A área sob a curva de concentração-tempo (AUC) foi 9,5 ± 4,0 unidades internacionais/mL/dia nos pacientes hipersensíveis anteriormente e 9,8 ± 6,0 unidades internacionais/mL/dia nos pacientes não hipersensíveis.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)