Qual a ação da substância do Nexviazyme?
Resultados de Eficácia
A segurança e a eficácia do Alfa-Avalglicosidase têm sido avaliadas em estudos clínicos de pacientes sem tratamento prévio ou com experiência de tratamento no início do tratamento.
Estudos Clínicos em pacientes com Doença de Pompe de início tardio (LOPD)
O estudo 1, EFC14028/COMET, foi um estudo multinacional, multicêntrico, randomizado, duplo-cego, comparando a eficácia e segurança do Alfa-Avalglicosidase e alfa-alglicosidase em 100 pacientes LOPD sem tratamento prévio entre 16 a 78 anos de idade do início do tratamento. Os pacientes foram randomizados em uma proporção de 1:1 com base na capacidade vital forçada (CVF) no período basal, sexo, idade e país para receber 20 mg/kg de Alfa-Avalglicosidase ou de alfa-alglicosidase uma vez em semanas alternadas durante 12 meses (49 semanas). O estudo incluiu uma fase de acompanhamento de até 5 anos para todos os pacientes, cujos pacientes do braço alfa-alglicosidase foram trocados para o tratamento com Alfa-Avalglicosidase.
O desfecho primário do estudo 1 foi a mudança na CVF (% prevista) na posição vertical desde o período basal até 12 meses (semana 49). Na semana 49, a alteração da média do MQ (EP) na % da CVF prevista para pacientes tratados com Alfa-Avalglicosidase e alfa-alglicosidase foi de 2,89% (0,88) e 0,46% (0,93), respectivamente. A diferença da média do MQ clinicamente importante de 2,43% (IC 95%: -0,13, 13, 0 4,99) entre a % da CVF do Alfa-Avalglicosidase e alfa-alglicosidase excedeu a margem de não inferioridade pré-definida de -1,1 e alcançou não-inferioridade estatística (p=0,0074). O estudo não demonstrou significância estatística para superioridade (p=0,0626) e o teste dos desfechos secundários foi realizado sem ajuste de multiplicidade.
Os resultados para o desfecho primário estão detalhados na Tabela 1 e Figura 1.
Tabela 1 – Alteração da média do MQ desde período basal até a semana 49 na CVF (% prevista) em posição vertical
| - | - | Alfa-Avalglicosidase (n=51) | Alfa-alglicosidase (n=49) |
| Período basal pré-tratamento | Média (DP) | 62,5 (14,4) | 61,6 (12,4) |
| Semana 49 | Média (DP) | 65,49 (17,42) | 61,16 (13,49) |
| Diferença estimada entre os grupos na mudança desde o período basal até a semana 49 (MMRM) | Média dos MQ (EP) | 2,89* (0,88) | 0,46* (0,93) |
| Diferença estimada entre os grupos na mudança desde o período basal até a semana 49 (MMRM) | Média dos MQ (IC 95%) | 2,43* (-0,13, 4,99) | |
| valor p** | 0,0074 | ||
| valor p*** | 0,0626 | ||
DP = Desvio padrão;
MQ = mínimos quadrados;
EP= erro padrão;
IC = intervalo de confiança;
MMRM: medidas repetidas em modelo misto.
*Com base no modelo MMRM, o modelo inclui a % CVF prevista basal (como contínua), sexo, idade (em anos no período basal), grupo de tratamento, visita, termo de interação entre grupo de tratamento e visita como efeitos fixos.
** Margem de não inferioridade de -1,1%.
*** Superioridade não alcançada.
Figura 1 - Gráfico da mudança na média MQ (EP) desde o período basal médio da CVF (% prevista) em posição vertical ao longo do tempo – em pacientes com LOPD sem tratamento prévio (Estudo 1)*
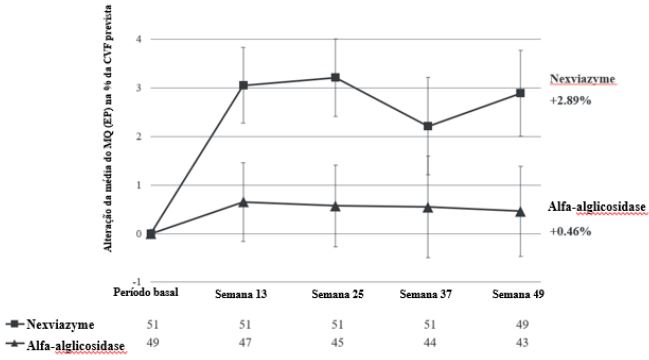
*Todos pacientes randomizados.
O principal desfecho secundário do estudo 1 foi a mudança na distância total percorrida em 6 minutos (Teste de Caminhada de 6 Minutos, TC6M) desde o período basal para 12 meses (semana 49). Na semana 49, a alteração da média do MQ desde o período basal (EP) no TC6M para pacientes tratados com Alfa-Avalglicosidase e alfa-alglicosidase foi de 32,21 m (9,93) e 2,19 m (10,40), respectivamente. A diferença da média dos MQ clinicamente significativa de 30,01 m (IC 95%: 1,33,58,69; p=0,0405 nominal) apresentou melhora numérica com Alfa-Avalglicosidase em relação ao alfa-alglicosidase. Os resultados do TC6M estão detalhados na Tabela 2 e Figura 2. Os desfechos secundários adicionais do estudo foram pressão inspiratória máxima (PIM), pressão expiratória máxima (PEM), pontuação resumida de Dinamometria portátil (HHD), pontuação total do teste rápido de função motora (QMFT) e SF-12 (pesquisa relacionada à saúde sobre a qualidade de vida, escores dos componentes físicos e mentais). Os resultados destes desfechos estão detalhados na Tabela 3.
Tabela 2 - Mudança na média MQ (EP) desde o período basal para a semana 49 no TC6M (teste de caminhada de 6 minutos)
| - | - | Alfa-Avalglicosidase (n=51) | Alfa-alglicosidase (n=49) |
| Período basal pré-tratamento | Média (DP) | 399,3 (110,9) | 378,1 (116,2) |
| Semana 49 | Média (DP) | 441,31 (109,77) | 378,1 (116,2) |
| Mudança desde o período basal estimada até a semana 49 (MMRM) | Média dos MQ (EP) | 32,21* (9,93) | 2,19* (10,40) |
| Diferença estimada entre os grupos na mudança desde o período basal até a semana 49 (MMRM) | Média dos MQ (95% IC) valor p** | 30,01* (1,33, 58,69) 0,0405 | |
*O modelo MMRM para distância do TC6M se ajusta a % basal prevista da CVF e TC6M basal (distância caminhada em metros), idade (em anos, no período basal), sexo, grupo de tratamento, visita e interação de tratamento por visita como efeitos fixos.
** valor p em nível nominal, sem ajuste de multiplicidade.
Figura 2 - Gráfico da mudança na média MQ (EP) desde o período basal do TC6M (distância percorrida em 6 minutos, em metros) ao longo do tempo – em pacientes LOPD sem tratamento prévio (Estudo 1)*
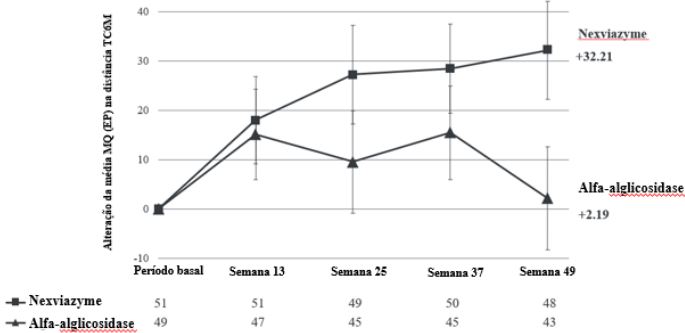
*Todos pacientes randomizados.
Tabela 3 – Mudança na média dos MQ desde o período basal até a semana 49 para os desfechos secundários adicionais
| Desfecho | Alfa-Avalglicosidase Mudança média de MQ (EP) | Alfa-alglicosidase Mudança média de MQ (EP) | Diferença da média dos MQ (IC 95%) |
| Pressão Inspiratória Máxima (PIM) (% prevista) * | 8,70 (2,09) | 4,29 (2,19) | 4,40 (-1,63,10,44) |
| Pressão Expiratória Máxima (% prevista) * | 10,89 (2,84) | 8,38 (2,96) | 2,51 (-5,70,10,73) |
| Pontuações resumidas de Dinamometria portátil (HHD) | 260,69 (46,07) | 153,72 (48,54) | 106,97 (-26,56,240,5) |
| Pontuação total do Teste de função Motora Rápida (QMFT) | 3,98 (0,63) | 1,89 (0,69) | 2,08 (0,22,3,95) |
| Pesquisa relacionada à saúde sobre a qualidade de vida (SF-12) | Pontuação PCS: 2,37 (0,99) Pontuação MCS: 2,88 (1,22) | 1,60 (1,07) 0,76 (1,32) | 0,77 (-2,13,3,67) 2,12 (-1,46,5,69) |
*Análise de sensibilidade post-hoc excluindo 4 pacientes (2 em cada braço do tratamento) com valores basais supra fisiológicos de PIM e PEM.
No estudo 1, os dados de eficácia estavam disponíveis em 24 pacientes na semana 97, 17 pacientes na semana 121 e 11 pacientes na semana 145. Adicionalmente, 9 pacientes randomizados para alfaalglicosidase que mudaram o tratamento para alfa-avalglicosidase após a semana 49 continuaram o tratamento por até 2 anos. Os valores de % prevista da CVF permaneceram elevados em relação ao período basal ao longo da dosagem com alfa-avalglicosidase por até 97 semanas em 24 pacientes que atingiram este momento. No mesmo estudo, os dados de eficácia na semana 97 para pacientes que mudaram de alfaalglicosidase para alfa-avalglicosidase na semana 49 mostraram melhora numérica para a % prevista da CVF e TC6M. A distância média observada do TC6M permaneceu elevada em relação ao período basal ao longo da dosagem com alfa-avalglicosidase por até 145 semanas em 10 pacientes que atingiram esse período de tempo.
No estudo 3, LTS13769/NEO-Ext, que é um estudo aberto e não controlado em 19 pacientes com LOPD, sem tratamento prévio ou tratado previamente com alfa-alglicosidase, que completaram o estudo de variação de dose TDR12857/NEO1 e que alteraram para alfa-avalglicosidase 20 mg/kg em semanas alternadas, a % da CVF prevista e o TC6M mostraram manutenção do efeito durante o tratamento de longo prazo por até 6 anos.
Estudo Clínico em pacientes com Doença de Pompe de início precoce / infantil (IOPD)
O estudo 2, ACT14132/mini-COMET, foi um estudo de múltiplos estágios, de fase 2, aberto, multicêntrico, estudo de coorte de dose ascendente repetida de Alfa-Avalglicosidase em pacientes pediátricos com IOPD (< 18 anos de idade) que demonstraram declínio clínico ou resposta clínica abaixo do ideal durante o tratamento com alfa-alglicosidase. O estudo incluiu um total de 22 pacientes (idade média = 6,8 anos variando de 1 a 12 anos); a coorte 1 tinha 6 pacientes que demonstraram declínio clínico e receberam 20 mg/kg de Alfa-Avalglicosidase administrado intravenosamente em semanas alternadas (0,5 vezes a dose aprovada recomendada) por 25 semanas, a coorte 2 tinha 5 pacientes que demonstraram declínio clínico e receberam 40 mg/kg de Alfa-Avalglicosidase administrado intravenosamente em semanas alternadas por 25 semanas, e a coorte 3 tinha 11 pacientes que demonstraram resposta abaixo do ideal e receberam Alfa-Avalglicosidase 40 mg/kg em semanas alternadas durante 25 semanas ou alfa-alglicosidase em sua dose intravenosa de pré-estudo estável (variando entre 20 mg/kg em semanas alternadas e 40 mg/kg semanalmente) por 25 semanas (6 pacientes).
O objetivo primário do estudo 2 foi avaliar a segurança e a tolerabilidade da administração do Alfa-Avalglicosidase. O objetivo secundário inclui determinação da eficácia do Alfa-Avalglicosidase na função motora, habilidades funcionais, desfechos de ecocardiograma e posição da pálpebra. Os dados mostraram estabilização ou melhora nos resultados de eficácia dos escores Medida de função motora bruta (GMFM88), Teste de função rápida (QMFT), Inventário de avaliação pediátrica de incapacidade de Pompe (PompePEDI), Massa ventricular esquerda (LVMZ), e medidas de posição das pálpebras em pacientes anteriormente em declínio ou insuficientemente controlados com alfa-alglicosidase. O efeito do tratamento foi mais pronunciado com 40 mg/kg em semanas alternadas em comparação com os 20 mg/kg em semanas alternadas. Dois dos seis pacientes tratados com Alfa-Avalglicosidase 20 mg/kg em semanas alternadas (coorte 1) demonstraram maior declínio clínico e receberam aumento da dose de 20 a 40 mg/kg em semanas alternadas na semana 55 e 61, respectivamente. Todos os pacientes que receberam 40 mg/kg em semanas alternadas mantiveram esta dose durante o estudo.
Devido à inclusão sequencial, os efeitos a longo prazo do tratamento com Alfa-Avalglicosidase foram avaliados em 10 pacientes na semana 49 (6 em coorte 1 e 4 em coorte 2), 8 pacientes na semana 73 (6 em coorte 1 e 4 em coorte 2) e 3 pacientes na semana 97 (todos em coorte 1). Em pacientes com IOPD anteriormente em declínio com alfa-alglicosidase, a eficácia em parâmetros específicos de declínio, incluindo função motora, massa ventricular esquerda cardíaca e medidas de posição das pálpebras, como medida pela distância da fissura interpalpebral (non-FLASH) foi sustentada até 2 anos.
Características Farmacológicas
Mecanismo de ação
A doença de Pompe (também conhecida como doença de armazenamento de glicogênio tipo II, deficiência de maltase ácida e glicogenose tipo II) é uma doença muscular metabólica rara herdada de forma recessiva autossômica definida por uma deficiência de α-glicosidase ácida (GAA), que é necessária para a degradação do glicogênio lisossômico. GAA cliva as ligações alfa-1,4 e alfa-1,6 em glicogênio sob as condições ácidas do lisossomo. A doença de Pompe resulta no acúmulo intralisossomal de glicogênio em vários tecidos, particularmente músculos cardíacos e esqueléticos, levando ao desenvolvimento de cardiomiopatia, fraqueza muscular progressiva e comprometimento da função respiratória.
A alfa-avalglicosidase é uma α-glicosidase recombinante humana (rhGAA) ácida que fornece uma fonte exógena de GAA. A alfa-avalglicosidase é uma modificação do alfa-alglicosidase na qual aproximadamente 7 estruturas hexamanose, cada uma contendo frações de bis-manose-6-fosfato (bis-M6P) terminal, são conjugadas a resíduos de ácido siálico oxidado em alfa-alglicosidase. A alfa-avalglicosidase tem um aumento de 15 vezes nas frações de manose-6-fosfato (M6P) em comparação com alfaalglicosidase. O aumento do nível de bis-M6P no rhGAA fornece um mecanismo para conduzir a absorção no diafragma e outros músculos esqueléticos através do receptor M6P independente do cátion, onde ele pode degradar o glicogênio e amenizar o dano ao tecido. A ligação aos receptores M6P na superfície celular tem sido mostrada como ocorrendo através de grupos de carboidratos na molécula GAA, após a qual é internalizada e transportada para os lisossomos, nos quais sofre clivagem proteolítica que resulta em aumento da atividade enzimática.
Propriedades farmacodinâmicas
Em pacientes com LOPD sem tratamento prévio com idades entre 16 e 78 anos, incluídos no estudo EFC14028/COMET, a variação percentual média (SD) nos tetrassacarídeos de hexose urinária desde o período basal para pacientes tratados com Alfa-Avalglicosidase 20 mg/kg em semanas alternadas e alfaalglicosidase 20 mg/kg em semanas alternadas foi -53,90% (24,03) e -10,8% (32,33), respectivamente, na semana 49.
Em pacientes pediátricos com IOPD (< 18 anos de idade) incluídos no estudo ACT14132/mini-COMET, tratados com Alfa-Avalglicosidase a 40 mg/kg em semanas alternadas que demonstraram declínio clínico (coorte 2) ou resposta clínica abaixo do ideal (coorte 3) durante o tratamento com alfa-alglicosidase, o percentual médio (SD) da variação nos tetrassacarídeos de hexose urinária desde o período basal foi de - 40,97% (16,72) e -37,48% (17,16), respectivamente, após 6 meses. Em pacientes anteriormente em declínio tratados com Alfa-Avalglicosidase 20 mg/kg em semanas alternadas, a variação percentual média (SD) foi de 0,34% (42,09).
Propriedades farmacocinéticas
Pacientes com doença de Pompe de início tardio (LOPD)
A farmacocinética da alfa-avalglicosidase foi avaliada em uma análise populacional de 3 estudos clínicos (EFC14028/COMET, TDR12857/NEO e LTS13769/NEO-EXT), incluindo 75 pacientes com LOPD de 16 a 78 anos que receberam de 5 a 20 mg/kg de alfa-avalglicosidase em semanas alternadas por até 5 anos.
Pacientes com doença de Pompe de início precoce/infantil (IOPD)
A farmacocinética da alfa-avalglicosidase foi caracterizada em 16 pacientes de 1 a 12 anos que foram tratados com alfa-avalglicosidase no estudo ACT14132/mini-COMET, que incluiu 6 pacientes tratados com 20 mg/kg e 10 pacientes tratados com doses de 40 mg/kg em semanas alternadas por até 25 semanas.
A exposição à alfa-avalglicosidase aumentou de forma proporcional entre 5 a 20 mg/kg em pacientes com LOPD e entre 20 e 40 mg/kg em pacientes com IOPD. Nenhum acúmulo foi observado após a dosagem em semanas alternadas.
Em pacientes com LOPD, para uma infusão IV de 20 mg/kg por 4 horas em semanas alternadas, a Cmáx média e a AUC2W média foram 273 μg/mL (24%) e 1220 µg.h/mL (29%), respectivamente.
Em pacientes com IOPD, para uma infusão IV de 20 mg/kg por 4 horas em semanas alternadas e infusão IV de 40 mg/kg por 7 horas em semanas alternadas, a Cmax média variou de 175 a 189 μg/mL para a dose de 20 mg/kg e 205 a 403 μg/mL para a dose de 40 mg/kg. A AUC2W média variou de 805 a 923 μg•hr/mL para a dose de 20 mg/kg e de 1720 a 2630 μg•hr/mL para a dose de 40 mg/kg.
Distribuição
Em pacientes com LOPD, o modelo PK típico da população previu que o volume central do compartimento de distribuição da alfa-avalglicosidase foi de 3,4 L. Em pacientes com IOPD tratados com alfa-avalglicosidase 20 mg/kg e 40 mg/kg em semanas alternadas, o volume médio de distribuição no estado estacionário variou entre 3,5 a 5,4 L.
Metabolismo
A via metabólica da alfa-avalglicosidase não foi caracterizada. Como glicoproteína, espera-se que a alfaavalglicosidase seja degradada em pequenos peptídeos ou aminoácidos através de via catabólica não saturável.
Eliminação
Em pacientes com LOPD, o modelo típico de PK populacional previu que a depuração linear foi de 0,87 L/h. Após 20 mg/kg em semanas alternadas, a média de eliminação plasmática foi de 1,55 horas.
Em pacientes IOPD tratados com alfa-avalglicosidase 20 mg/kg e 40 mg/kg em semanas alternadas, a depuração média do plasma variou de 0,53 a 0.70 L/h, e a meia-vida da depuração média do plasma foi de 0,60 a 1,19 horas.
Imunogenicidade
No estudo 1, EFC14028/COMET, 96,1% (49 de 51 pacientes) que receberam Alfa-Avalglicosidase desenvolveram AAD emergente do tratamento. Como apenas 2 pacientes foram AAD-negativos, o impacto do AAD na PK foi avaliado pela categorização dos pacientes AAD-positivos em 3 grupos de título de pico: ≤ 800, 1.600-6.400 e ≥ 12.800. Cinco pacientes tiveram ≥ 50% de mudança na AUC na semana 49 desde o período basal, mas nenhum padrão óbvio nos títulos. A comparação intraindividual da AUC no Dia 1 ou 2 e na semana 49 corroborou a análise geral da mudança percentual na positividade de AUC e AAD categorizada pelos títulos AAD. Avaliação “in vitro” de anticorpos neutralizantes que inibiram a atividade enzimática ou a captação celular inibida não demonstraram nenhuma relação clara de positividade do ensaio com a AUC (vide item 9. Reações Adversas). Os pacientes com IOPD com tratamento apresentaram títulos ≤ 6.400, e como as alterações na PK não foram observadas, a relação com AAD não foi avaliada para este grupo.
Populações especiais
Análises farmacocinéticas populacionais em pacientes com LOPD mostraram que idade e gênero não influenciaram significativamente a farmacocinética da alfa-avalglicosidase.
Foram observadas diferenças nas exposições de alfa-avalglicosidase no estado de equilíbrio após 20 mg/kg, com uma AUC2W mediana 32% mais baixa em pacientes com <50 kg e 41% mais alta em pacientes com ≥ 100 kg em comparação a pacientes pesando entre 50 e 100 kg. Pacientes com baixo peso podem requerer aumento da dose, conforme a resposta clínica.
Insuficiência Hepática
A farmacocinética da alfa-avalglicosidase não foi estudada em pacientes com insuficiência hepática.
Insuficiência Renal
Não foi realizado nenhum estudo formal sobre o efeito de insuficiência renal na farmacocinética da alfaavalglicosidase. Com base em uma análise farmacocinética populacional de dados de 75 pacientes com LOPD recebendo 20 mg/kg, incluindo 6 pacientes com insuficiência renal leve (taxa de filtração glomerular: 60 a 89 mL/min; no período basal), nenhum efeito relevante de insuficiência renal na exposição à alfa-avalglicosidase foi observado.
Dados de segurança não clínica
Toxicidade de dose única
Não foram realizados estudos de toxicidade não clínica de dose única com Alfa-Avalglicosidase.
Toxicidade de dose repetida
Em um estudo de toxicidade de dose repetida de 26 semanas, Alfa-Avalglicosidase foi administrado em macacos através de infusão intravenosa de 6 horas a uma dose de 0, 50 ou 200 mg/kg em semanas alternadas. Efeitos adversos não foram observados. O NOAEL foi 200 mg/kg em semanas alternadas, a maior dose testada. A exposição média após a 13ª infusão no NOAEL foi de 28 162 μg*hr/mL (AUC0-inf).
Genotoxicidade e Carcinogenicidade
Não foram conduzidos estudos de genotoxicidade e carcinogenicidade com Alfa-Avalglicosidase.
Toxicidade para a reprodução e o desenvolvimento
Todos os estudos de toxicidade reprodutiva em camundongos incluíram pré-tratamento com DFH para prevenir ou minimizar reações de hipersensibilidade. Os efeitos do Alfa-Avalglicosidase foram avaliados com base em comparação com um grupo controle tratado apenas com DFH. Coelhos testados em estudos de toxicidade reprodutiva não foram pré-tratados com DFH porque as reações de hipersensibilidade não foram observadas.
Fertilidade
Em um estudo combinado de fertilidade sexual em camundongos, os efeitos do Alfa-Avalglicosidase (0, 10, 20 ou 50 mg/kg IV em dias alternados) no desempenho de acasalamento, fertilidade e desenvolvimento embrionário inicial foram avaliados após a administração antes da coabitação (camundongos machos: 10 semanas, camundongos fêmeas: 2 semanas) através da concepção, ao Dia Gestacional (DG) 7. Houve 4, 7 e 3 camundongos machos e 2, 3 e 1 camundongos fêmeas que foram encontrados mortos nos grupos de 10, 20 e 50 mg/kg/dose, respectivamente. A causa da morte foi considerada relacionada a uma resposta imunológica (incluindo uma resposta anafilactóide). Nos camundongos machos, não houve efeitos no índice de acasalamento, índice de fertilidade, pesos de órgãos, observações macroscópicas ou achados microscópicos, e nenhuma alteração nos parâmetros de espermatozoides (motilidade e densidade do esperma). Nos camundongos fêmeas, não houve efeitos no índice de acasalamento, índice de fertilidade, pesos de órgãos, parâmetros ovarianos e uterinos, ou avaliações microscópicas. O NOAEL de fertilidade masculina e feminina foi de 50 mg/kg/dose.
Desenvolvimento Embriofetal
Os camundongos prenhes foram administrados com Alfa-Avalglicosidase a uma dose de 0, 10, 20 ou 50 mg/kg/dia IV uma vez por dia no DG 6 a 15. As cesarianas foram realizadas no DG18. Estudos de transferência placentária determinaram que a alfa-avalglicosidase não é transportada da circulação materna para a circulação fetal. Houve 2 camundongos no grupo de 50 mg/kg/dia que foram encontrados mortos no DG14 que foram considerados relacionado a uma resposta imunológica (incluindo uma resposta anafilactóide). Duas mortes a 10 mg/kg/dia foram relacionadas ao procedimento de coleta de sangue. Não houve efeitos relacionados ao artigo de teste sobre o peso corporal materno, observações macroscópicas, taxa de gravidez, número médio de corpo lúteo, número de implantes, fetos femininos vivos ou masculinos vivos, número de fetos vivos, número de fetos mortos, número total de fetos, peso corporal fetal, contagens de local de ossificação fetal, ou exames externos, viscerais ou esqueléticos. O aumento da perda pósimplantação e o número médio de reabsorções tardias foram observados em grupo de 50 mg/kg/dia. O NOAEL materno foi de 50 mg/kg/dia IV (AUC0-24 = 2080 μg*h/mL), e o NOAEL de desenvolvimento foi de 20 mg/kg/dia IV (AUC0-24 = 582 μg*h/mL).
Os coelhos prenhes foram administrados com Alfa-Avalglicosidase com uma dose de 0, 30, 60 e 100 mg/kg/dia por infusão IV uma vez por dia do DG6-19. Observou-se perda média de peso corporal estatisticamente significativa do DG19-20 a 100 mg/kg/dia e menor ganho médio de peso corporal e consumo de alimentos nos grupos de 60 e 100 mg/kg/dia durante o intervalo do DG13-20; o consumo médio de alimentos nesses grupos também foi menor quando foi avaliado todo o período de tratamento (DG6-20). O crescimento intrauterino e a sobrevida não foram afetados pela administração materna do artigo de teste e não foram observadas malformações relacionadas ao artigo de teste ou variações de desenvolvimento. O NOAEL materno foi de 30 mg/kg/dia IV (DG19 AUC0-24 = 1260 μg*h/mL) e o NOAEL embrionário-fetal foi de 1100 mg/kg/dia IV (AUC0-24 materna no DG19 = 7910 μg*h/mL).
Desenvolvimento Pré e Pós-natal
Os camundongos gestantes foram administrados com Alfa-Avalglicosidase 0, 10, 20 ou 50 mg/kg/dose IV uma vez a cada dois dias do DG6 até o DPP 20. DFH foi administrada antes da administração de Alfa-Avalglicosidase começando com a quinta dose. Não houve mortes relacionadas ao artigo de teste nos camundongos F0 e F1. A mortalidade ou eutanásia precoce que ocorreu em fêmeas F0 incluíram 2 a 10 mg/kg/dose (DG18 e Dia de Lactação (LD) 12), 1 a 20 mg/kg/dose (LD20) e 1 a 50 mg/kg/dose (DG16). A mortalidade ou eutanásia precoce que ocorreu em camundongos F1 incluíram 1 macho a 0/5 mg/kg/dose de DFH (DPP 29), 1 fêmea a 0/0 (DPP 23), e 1 fêmea a 20 mg/kg/dose (DPP71). Não houve efeito sobre a maturação sexual de F1, parâmetros neurocomportamentais (atividade motora, habituação auditiva ou desempenho em paradigma de evasão passiva), parâmetros de acasalamento e fertilidade, observações macroscópicas, pesos de testículos e epidídimo, parâmetros de cesariana e ninhada, ou exames embrionários externos. O NOAEL materno e o NOAEL para reprodução nas mães e para viabilidade e crescimento na prole foram 50 mg/kg/dose IV.
Outros estudos de toxicidade
Tolerância Local
O exame dos locais de infusão IV em macacos não mostrou efeitos adversos relacionados à administração de Alfa-Avalglicosidase.
Toxicidade Juvenil
Em camundongos juvenis, a toxicidade potencial do Alfa-Avalglicosidase (0, 20, 50 ou 100 mg/kg IV em semanas alternadas em camundongos fêmeas e 0, 25, 50 ou 100 mg/kg IV em semanas alternadas em machos) foi avaliada após a administração por aproximadamente 9 semanas a partir do Dia Pós-Natal (DPN) 21 ao DPN 77 ou DPN 91 (para camundongos machos apenas na coorte de fertilidade). DFH (5 mg/kg) foi administrada em camundongos em grupos tratados devido ao potencial de hipersensibilidade. Houve 25 mortes não programadas, incluindo 15 camundongos do sexo masculino (1, 10, 3 e 1 em 0, 25, 50, e 100 mg/kg em semanas alternadas, respectivamente) e 10 camundongos fêmeas (1, 7 e 2 a 0, 20 e 50 mg/kg em semanas alternadas, respectivamente). Quatro dessas mortes (1 macho e 1 camundongo fêmea a 0 mg/kg em semanas alternadas, 1 macho a 25 mg/kg em semanas alternadas e 1 fêmea a 50 mg/kg em semanas alternadas) não estavam relacionadas com a administração de Alfa-Avalglicosidase. A causa da morte nos camundongos restantes foi indeterminada, mas provavelmente estava relacionada a uma resposta imunológica (incluindo uma resposta anafilactóide). Aumento da contagem total de leucócitos, linfócitos, monócitos, neutrófilos segmentados, basófilos (20, 50 e 100 mg/kg em semanas alternadas), e eosinófilos (50 e 100 mg/kg em semanas alternadas) foram observados em machos sobreviventes, consistentes com uma resposta imunológica (anafilactóide). Não houve efeitos relacionados à alfa-avalglicosidase nas observações clínicas, peso corporal, comprimento do fêmur, consumo alimentar, química clínica, densidade óssea, pesos de órgãos, observações macroscópicas ou achados microscópicos. Não foram realizados efeitos nos testes funcionais neurocomportamentais de desenvolvimento (campo aberto, evasão passiva, habituação auditiva ou atividade motora), ou na maturação sexual, ciclicidade estral, acasalamento e índices de fertilidade, ou peso corporal materno ou consumo alimentar. Além disso, não houve efeitos nos parâmetros ovarianos e uterinos; no peso dos órgãos reprodutivos masculinos; ou em parâmetros de esperma (motilidade espermática, densidades de espermatozoides e espermátides ou morfologia dos espermatozoides). O NOAEL em camundongos juvenis foi de 100 mg/kg em semanas alternadas, a maior dose avaliada. A exposição na DPN 77 no NOAEL foi de 8140 e 5400 μg*h/mL (AUC0-24) em camundongos machos e fêmeas, respectivamente.
Qualificação de Impurezas
O aumento das concentrações do glicano (Genz-669342) na dose de alfa-avalglicosidase administrada a macacos por 13 semanas não teve efeito sobre a toxicidade até a alta dose de 50 mg/kg de alfaavalglicosidase/12,55 mg/kg de Genz-669342 em semanas alternadas. Genz-669342 foi não genotóxico no teste de mutação reversa bacteriana “in vitro” em Salmonella typhimurium (até 5000 μg/placa) e teste de aberração cromossômica “in vitro” em linfócitos humanos (até 500 μg/mL).
Potencial de Responsabilidade por Abuso de Medicamentos
Não foram realizados estudos de avaliação de risco de abuso de medicamentos. Não houve sinal de dependência ou potencial de abuso, ou semelhanças com medicamentos de abuso conhecidos de acordo com estrutura química, farmacologia, mecanismo de ação e dados não clínicos e clínicos. Portanto, nenhum risco para a saúde pública como resultado de abuso é previsto.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)