Qual a ação da substância do Elprolix?
Resultados de Eficácia
A segurança, eficácia e farmacocinética de Alfaeftrenonacogue foram avaliadas em um estudo multicêntrico, aberto, pivotal de Fase 3. Este estudo comparou a eficácia de dois regimes de tratamento profilático até o tratamento episódico (conforme demanda), determinou a eficácia hemostática no tratamento de episódios hemorrágicos e determinou eficácia hemostática durante o manejo perioperatório de pacientes submetidos a procedimentos cirúrgicos de grande porte. Um total de 123 pacientes previamente tratados (PPTs), com idade entre 12 a 71 anos, com hemofilia B grave (atividade endógena de fator IX de coagulação ≤ 2%) foram acompanhados por até 77 semanas.
Sessenta e três pacientes no braço de intervalo fixo semanal receberam Alfaeftrenonacogue para a profilaxia de rotina, a partir de uma dose inicial de 50 UI/kg. A dose foi ajustada para manter níveis séricos mínimos de fator IX entre 1% e 3% acima do nível basal ou superior, conforme clinicamente indicado para evitar o sangramento. A dose semanal mediana durante os últimos 6 meses de estudo, em 58 pacientes que estavam no estudo durante pelo menos nove meses, foi de 40,7 UI/kg (intervalo interquartil: 32,3, 54,1).
Vinte e nove pacientes no braço de intervalo individualizado receberam Alfaeftrenonacogue para a profilaxia de rotina a uma dose de 100 UI/kg a cada 10 dias, com o intervalo ajustado para manter níveis séricos mínimos de fator IX entre 1% e 3% acima do nível basal ou superior, conforme clinicamente indicado para prevenir o sangramento. O intervalo mediano durante os últimos 6 meses, em 26 pacientes que estavam no estudo durante pelo menos nove meses, foi de 13,8 dias (intervalo interquartil, 10,5, 14,0).
Vinte e sete pacientes receberam Alfaeftrenonacogue conforme necessário para o tratamento de episódios de hemorragia, no braço de tratamento episódico (conforme demanda).
Doze pacientes receberam Alfaeftrenonacogue para o manejo perioperatório em 14 procedimentos cirúrgicos de grande porte. Quatro pacientes neste braço não participaram de outros braços de tratamento.
Controle de Sangramento
Um total de 636 eventos hemorrágicos foi observado em 114 pacientes nos braços de profilaxia de intervalo fixo semanal, profilaxia de intervalo individualizado e tratamento episódico (conforme demanda). A avaliação da resposta para cada injeção foi registrada pelos pacientes 8-12 horas póstratamento. Uma escala de avaliação de 4 pontos de excelente, boa, moderada e sem resposta foi utilizada para avaliar a resposta. Os episódios de sangramento são resumidos na Tabela 1.
Tabela 1: Resumo de Eficácia no Controle de Sangramento
Episódios hemorrágicos | (N= 636) |
Nº de injeções para tratar o episódio hemorrágico | 1 injeção 575 (90,4%) |
2 injeções 44 (6,9%) | |
3 injeções 17 (2,7%) | |
Dose mediana média por injeção (UI/kg) para tratar o episódio hemorrágico (IQR) | 46,07 |
(32,86, 57,03) | |
Resposta à primeira injeção | (N= 613) |
Excelente ou boa | 513 (83,7%) |
Moderada | 90 (14,7%) |
Sem resposta | 10 (1,6%) |
Profilaxia de rotina
Houve uma redução na taxa anualizada de hemorragia (TAH) de 83% (76% a 89%) para os pacientes no braço de intervalo fixo semanal e uma redução de 87% (80% a 92%) para os pacientes no braço de intervalo individualizado, em comparação ao braço de tratamento episódico (conforme demanda) baseado em um modelo binomial negativo. A duração mediana do tratamento no estudo foi de 51,4 semanas (intervalo <1-77). Uma comparação das taxas anuais de sangramento em pacientes passíveis de avaliação para eficácia é resumida na Tabela 2.
Tabela 2: Resumo da taxa anualizada de hemorragia (TAH) mediana (IQR)1 por braço de tratamento em pacientes ≥12 anos de idade
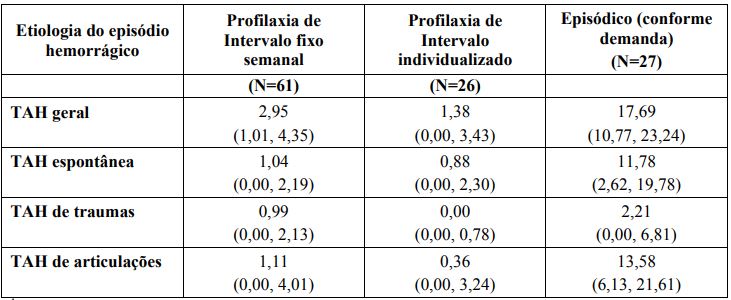
1Mediana (intervalo interquartil, 25º e 75º percentis).
Manejo Perioperatório
Cirurgias de grande porte
A eficácia hemostática foi avaliada em vinte e oito (28) cirurgias de grande porte em dezoito (18) pacientes (≥17 anos) no estudo completo de fase 3 e no estudo de extensão em andamento. Das 28 cirurgias de grande porte, 23 cirurgias (82,1%) requereram uma dose pré-operatória para manter a hemostase durante a cirurgia. A dose mediana por injeção para manter a hemostase durante a cirurgia foi de 89,9 UI/kg (intervalo: 49 a 152 UI/kg).
A hemostase foi avaliada em 24 horas pós-operatório pelo investigador utilizando uma escala de avaliação de 4 pontos de excelente, boa, regular e nenhuma. A resposta hemostática foi avaliada por 27 cirurgias de grande porte e 100% foram classificadas como excelente ou boa. Não houve evidência clínica de complicações trombóticas em qualquer um dos pacientes.
A resposta hemostática da dosagem durante a cirurgia e pós-operatória para o estudo completo de fase 3 e o estudo de extensão em andamento encontram-se resumidos na Tabela 3.
Tabela 3: Resumo da resposta hemostática durante a cirurgia e pós-operatória
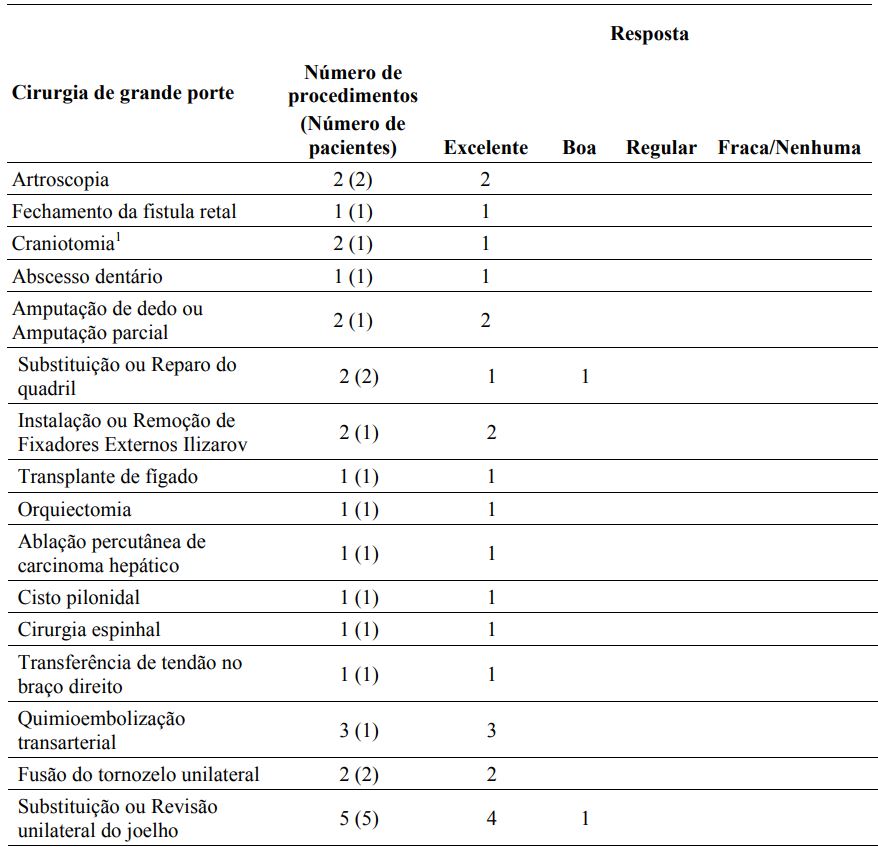
1Uma cirurgia não foi avaliada com relação à resposta.
Cirurgias menores
Foi realizada uma avaliação hemostática em quarenta (40) procedimentos cirúrgicos menores em 26 pacientes no estudo completo de fase 3 e em um estudo de extensão em andamento. A resposta hemostática foi avaliada para 22 cirurgias menores, das quais 20 cirurgias menores foram classificadas como excelentes ou boas e 2 como regulares.
Impacto na Qualidade de Vida
No estudo completo de fase 3, a qualidade de vida foi mensurada utilizando o HAEM-A-QoL, um instrumento de qualidade de vida específico para a hemofilia. HAEM-A-QoL foi realizada em adultos (com idade igual ou superior a 18 anos) nos braços de tratamento profilático. As pontuações mais baixas representam melhor qualidade de vida; portanto, uma variação negativa da linha de base representa melhoria durante o curso do estudo. A mudança geral da linha de base sugere que os indivíduos relataram uma melhoria na sua qualidade de vida geral, independentemente do regime de pré-estudo. A alteração a partir da linha de base até à Semana 26, nos braços de profilaxia combinados por regime de pré-estudo, está resumida na Tabela 4.
Tabela 4: Alteração mediana da linha de base para o questionário HAEM-A-QoL (Braços de Intervalo fixo semanal e Intervalo individualizado combinados)
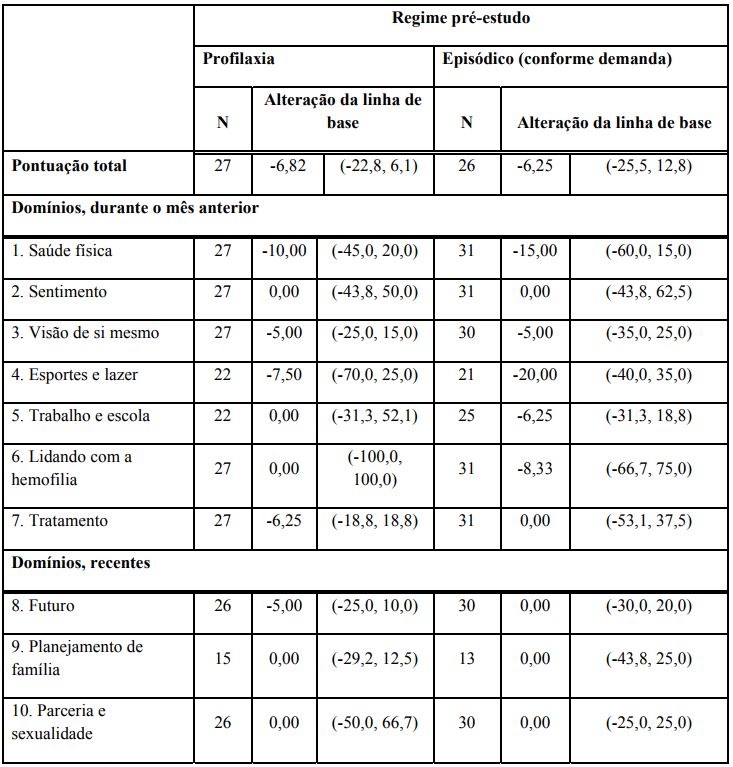
Nota: estatísticas resumidas são medianas (mínimo, máximo).
Características Farmacológicas
Alfaeftrenonacogue é uma proteína de fusão recombinante do fator IX de coagulaçãoFc, com longa ação, que consiste no fator IX de coagulação humano (rFIX) covalentemente ligado ao domínio Fc da imunoglobulina humana G1 (IgG1). A porção de fator IX de Alfaeftrenonacogue possui uma sequência primária de aminoácidos idêntica à forma alélica Thr148 do fator IX de coagulação derivado do plasma e possui características estruturais e funcionais semelhantes ao fator IX de coagulação endógeno. O domínio Fc de Alfaeftrenonacogue contém as regiões de dobradiça, CH2 e CH3 de IgG1. Alfaeftrenonacogue contém 867 aminoácidos com um peso molecular de aproximadamente 98 kDa.
Alfaeftrenonacogue não é derivado de sangue humano e não contém conservantes. A proteína de fusão recombinante do fator IX de coagulação-Fc é expressa em linhagem celular de rim embrionário humano (HEK), que produz alfaeftrenonacogue em um meio de cultura de células definido, que não contém proteínas derivadas de fontes animais ou humanas. O processo de purificação de alfaeftrenonacogue não inclui o uso de um reagente de anticorpo monoclonal. Para aumentar a segurança em relação a vírus, o processo de purificação possui uma etapa de nanofiltração e uma etapa de purificação em coluna cromatográfica que foi validada para a depuração viral. O conteúdo de proteína de fusão do fator IX-Fc ativado é limitado a ≤0,035 mol percentual alfaeftrenonacogue ativado/alfaeftrenonacogue.
Mecanismo de ação
Alfaeftrenonacogue é uma proteína de fusão recombinante que substitui temporariamente o fator IX de coagulação ausente, necessário para uma hemostasia eficaz. Alfaeftrenonacogue contém a região Fc da imunoglobulina humana G1 (IgG1) que se liga ao receptor Fc neonatal (FcRn). FcRn é parte de uma via que ocorre naturalmente e atrasa a degradação lisossômica de imunoglobulinas por colocá-las novamente na circulação, prolongando sua meia-vida no plasma.
Farmacodinâmica
A hemofilia B é um distúrbio hemorrágico caracterizado por uma deficiência funcional do fator IX de coagulação (FIX), que leva a um tempo de coagulação prolongado no ensaio do tempo de tromboplastina parcial ativada (TTPA), um teste convencional in vitro para a atividade biológica do fator IX de coagulação. O tratamento com Alfaeftrenonacogue diminui o TTPA durante o período eficaz de dosagem.
Farmacocinética
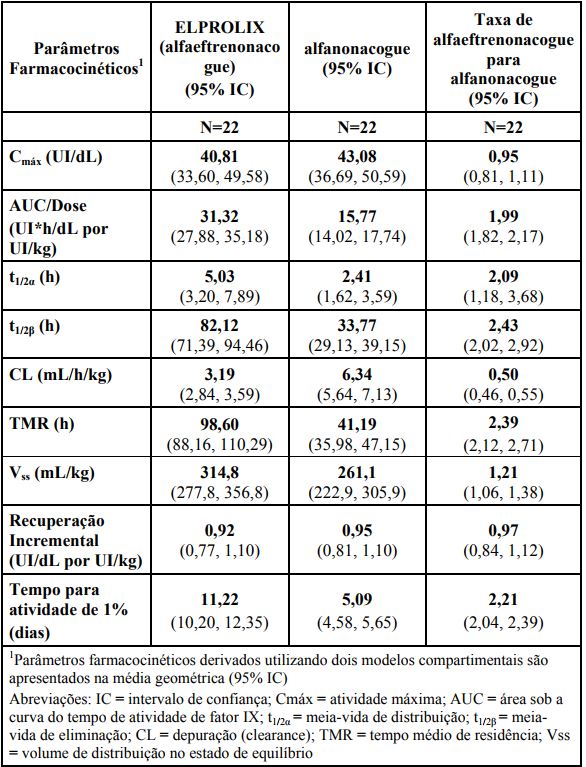
A farmacocinética de Alfaeftrenonacogue (alfaeftrenonacogue - fator IX de coagulação recombinante de longa duração) em relação ao alfanonacogue (fator IX de coagulação recombinante) foi avaliada em 22 pacientes (≥19 anos) após uma infusão intravenosa de 10 minutos em um estudo completo de fase 3. Os pacientes foram submetidos a um período de eliminação (washout) de 5 dias, antes de receber 50 UI/kg de alfanonacogue. A amostragem farmacocinética foi conduzida antes da administração, seguida por avaliações em 8 períodos de tempo até 96 horas após a dose. Após o período de eliminação (washout) de 120 horas (5 dias), os pacientes receberam uma única dose de 50 UI/kg de Alfaeftrenonacogue. As amostras farmacocinéticas foram coletadas antes da administração, e então subsequentemente em 11 períodos de tempo até 240 horas (10 dias) após a dose. Uma avaliação de repetição de farmacocinética de Alfaeftrenonacogue foi conduzida na Semana 26.
Os parâmetros farmacocinéticos para Alfaeftrenonacogue foram estimados com base no perfil de atividade de fator IX plasmático ao longo do tempo. Um laboratório central analisou todas as amostras de plasma do estudo utilizando um teste de coagulação de um estágio com reagente de TTPA com base em sílica calibrado contra padrões de fator IX plasmático. Para Alfaeftrenonacogue, a atividade máxima (Cmáx) foi observada imediatamente após a infusão, por exemplo, em 10 minutos após o início da administração. O aumento da média geométrica na atividade de fator IX circulante a partir do nível pré-infusão foi 0,92 UI/dL por UI/kg e a meia-vida de eliminação foi de 82 horas. A meia-vida é influenciada pela região Fc de Alfaeftrenonacogue, na qual os modelos animais demonstraram ser mediadas através da via cíclica FcRn. O perfil farmacocinético de Alfaeftrenonacogue foi estável ao longo de doses repetidas conforme demonstrado pelos parâmetros farmacocinéticos comparáveis na Semana 26.
Um resumo dos parâmetros farmacocinéticos para Alfaeftrenonacogue e alfanonacogue é apresentado na Tabela 5.
Tabela 5: Parâmetros farmacocinéticos de Alfaeftrenonacogue e alfanonacogue
Farmacocinética na população pediátrica
Os parâmetros farmacocinéticos de Alfaeftrenonacogue foram determinados em adolescentes com 12 a menos de 18 anos de idade em um estudo fase 3 completo.
Os parâmetros farmacocinéticos foram avaliados após uma infusão intravenosa de 10 minutos em 11 adolescentes que receberam uma dose única de Alfaeftrenonacogue. Foram coletadas amostras farmacocinéticas previamente à administração do medicamento e em vários períodos de tempo até 336 horas (14 dias) após a dose. Os parâmetros farmacocinéticos de Alfaeftrenonacogue foram estimados com base no perfil da atividade de fator IX plasmático sobre o tempo (Tabela 6). Um laboratório central analisou todas as amostras de plasma do estudo farmacocinético utilizando o teste de coagulação de um estágio com um reagente de TTPA com base em sílica calibrado contra padrões de fator IX plasmático.
Tabela 6: Comparação de parâmetros farmacocinéticos de Alfaeftrenonacogue para pacientes com 12 a <18 anos de idade
Parâmetros farmacocinéticos1 | 12 a <18 anos de idade (12, 17) |
N=11 | |
RI (UI/dL por UI/kg) | 0,8470 (0,6767, 1,0600) |
AUC/Dose (UI*h/dL por UI/kg) | 29,50 (25,13, 34,63) |
t½ (h) | 82,22 (72,30, 93,50) |
TMR (h) | 93,46 (81,77, 106,81) |
CL (mL/h/kg) | 3,390 (2,888, 3,979) |
Vss (mL/kg) | 316,8 (267,4, 375,5) |
1Parâmetros farmacocinéticos derivados de análise não compartimental são apresentados em média geométrica (95% IC).
Abreviações: IC = Intervalo de confiança; RI = Recuperação incremental; AUC = área sob a curva do tempo de atividade de fator IX; t½ = meia-vida terminal; TMR = tempo médio de residência; CL = depuração (clearance); Vss = volume de distribuição no estado de equilíbrio.
Toxicologia não clínica
Carcinogênese, mutagênese, diminuição da fertilidade
Não foram realizados estudos com animais que investigam os efeitos carcinogênicos de Alfaeftrenonacogue, uma vez que é um fator de reposição para a atividade de coagulação. Alfaeftrenonacogue não foi avaliado em ensaios de mutagenicidade ou testes de aberração cromossômica, uma vez que é um fator de proteína substituto para coagulação.
Alfaeftrenonacogue não foi avaliado em estudos de fertilidade animal. Não se sabe se (alfaeftrenonacogue) podem afetar a fertilidade ou o desenvolvimento de esperma em pacientes com hemofilia B. Nenhum impacto sobre os órgãos reprodutores masculinos ou femininos foi demonstrado em estudos toxicológicos.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)