Qual a ação da substância do Elaprase?
Resultados de Eficácia
A segurança e a eficácia deIdursulfase foram primeiramente estudadas em um estudo randomizado, duplocego, controlado com placebo, realizado em 96 pacientes com a síndrome de Hunter (TKT024); esse estudo foi complementado pela demonstração de administração segura no estudo HGT-ELA-038 em crianças de 16 meses de idade a 7,5 anos de idade. O estudo TKT024 incluiu pacientes com deficiência documentada da atividade da enzima iduronato-2 sulfatase, com percentual estimado da capacidade vital forçada inferior a 80% (%- CVF estimada). A idade dos pacientes variou entre 5 a 31 anos. Pacientes que não tinham condições de realizar os testes de função respiratória adequadamente ou pacientes que não puderam seguir as instruções do protocolo foram excluídos do estudo. Os pacientes receberam uma dose de 0,5 mg/kg deIdursulfase por semana (n=32); uma dose de 0,5 mg/kg deIdursulfase em semanas alternadas (n=32); ou placebo (n=32). A duração do estudo foi de 53 semanas.
O primeiro resultado de eficácia foi a somatória da pontuação de dois componentes, conforme a classificação da alteração do ponto inicial até a semana 53, da distância percorrida durante o teste de caminhada seis minutos (TDC-6) e da alteração da % CVF. Este desfecho principal formado pela composição destes dois parâmetros, foi estatisticamente diferente entre os três grupos, e a diferença foi maior entre o grupo placebo e o grupo que recebeu tratamento semanal (grupo sob tratamento semanal comIdursulfase x grupo placebo, p= 0,0049).
O exame individual dos parâmetros utilizados na composição mostrou que, na análise ajustada, o grupo sob tratamento semanal apresentou um aumento médio de 35 metros a mais na distância caminhada em seis minutos em relação ao grupo placebo. As alterações no parâmetro % CVF não foram estatisticamente significativas. (Tabela 1).
Tabela 1 - Resultados do Estudo Clínico TKT024
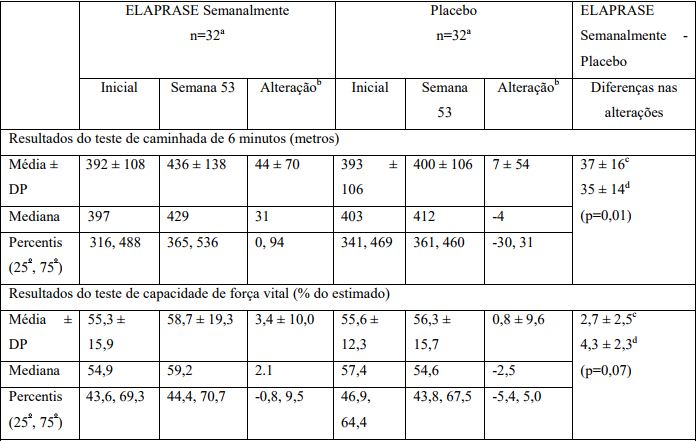
a Um paciente no grupo placebo e um paciente no grupo sob tratamento com Idursulfase morreram antes da semana 53, a determinação foi feita com base na última observação, transferida para a análise de intenção de tratamento.
b Alteração calculada como semana 53 menos ponto inicial.
c Média ± ES observado.
d Média ± ES com base no modelo ANCOVA, ajustado para a gravidade inicial da doença, região, idade.
As medidas da bioatividade foram os níveis urinários de GAG e alterações no tamanho do baço e do fígado. Os níveis urinários de GAG foram avaliados em todos os pacientes no início do estudo. Após a semana 53 os níveis eram significativamente inferiores no grupo sob tratamento semanal, embora os níveis de GAG ainda estivessem acima do limite normal em metade dos pacientes tratados. Os níveis urinários de GAG permaneceram elevados e praticamente inalterados no grupo placebo. Foram observadas reduções sustentáveis nos volumes do fígado e do baço no grupo sob tratamento semanal com Idursulfase na semana 53, comparativamente ao grupo placebo. Praticamente não houve alteração do volume do fígado e do baço no grupo placebo. Não foram estudadas nos ensaios clínicos mulheres heterozigóticas.
Um estudo aberto, multicêntrico, braço-único (HGT-ELA-038) foi conduzido para avaliar a segurança das infusões de Idursulfase em pacientes do sexo masculino com a Síndrome de Hunter de 16 meses a 7,5 anos de idade. Além disso, o estudo avaliou a eficácia, resultados clínicos e a farmacocinética de Idursulfase nessa população de pacientes.
Em geral, os resultados do estudo demonstraram que Idursulfase via intravenosa, quando administrado semanalmente em dose 0,5 mg/kg, é seguro e demonstra farmacodinâmica e resultados de eficácia similares em crianças com a Síndrome de Hunter de 16 meses a 7,5 anos de idade com menos ou mais de 5 anos de idade.
Características Farmacológicas
Idursulfase é uma formulação de idursulfase, forma purificada da iduronato-2-sulfatase, uma enzima lisossômica. A idursulfase é produzida por tecnologia de DNA recombinante em linhagens de células humanas. A idursulfase é uma enzima que hidrolisa os ésteres 2-sulfato dos resíduos terminais de sulfato de iduronato dos glicosaminoglicanos dermatan-sulfato e heparan-sulfato nos lisossomos de vários tipos de células.
A idursulfase é uma glicoproteína, de 525 aminoácidos, com um peso molecular de aproximadamente 76 kilodaltons. A enzima contém oito locais de glicosilação ligada à asparagina ocupados por estruturas oligosacarídeas complexas. A atividade enzimática da idursulfase é dependente da modificação pós-translacional de uma cisteína específica para formilglicina. A idursulfase apresenta atividade específica variando de 46 a 74 U/mg de proteína (uma unidade é definida como a quantidade de enzima necessária para hidrolisar 1 µmol do substrato dissacarídeo de heparina por hora sob condições específicas de ensaio).
Mecanismo de ação
A síndrome de Hunter (Mucopolissacaridose II - MPS II) é uma doença recessiva ligada ao cromossomo X causada por níveis insuficientes da enzima lisossômica iduronato-2-sulfatase. Esta enzima é responsável pela hidrólise da porção terminal 2-O-sulfato dos glicosaminoglicanos (GAG) dermatan-sulfato e heparan-sulfato. Devido à ausência ou defeito da enzima iduronato-2-sulfatase, nos pacientes com a síndrome de Hunter, há um acúmulo progressivo do GAG no interior dos lisossomos de uma variedade de células, levando a um ingurgitamento celular, organomegalia, destruição tecidual e disfunção orgânica sistêmica.
O tratamento de pacientes com a síndrome de Hunter com Idursulfase fornece a enzima exógena para captação pelos lisossomos no interior das células. Resíduos de manose-6-fosfato (M6P) nas cadeias de oligossacarídeos permitem a ligação da enzima com os receptores M6P na superfície das células, levando à internalização da enzima tendo como alvo os lisossomos e subsequente catabolismo dos GAGs acumulados.
Farmacodinâmica
Os efeitos farmacodinâmicos do tratamento com Idursulfase foram avaliados em crianças ≤5 anos de idade no estudo HGT-ELA-038. Neste estudo a idade, na linha de base, dos pacientes incluídos variou de 16 meses a 7,5 anos, e eles foram analisados em três grupos de idade (um ano de idade, dois a quatro anos de idade, e cinco ou mais anos de idade). No estudo HGT-ELA-038, o tratamento com Idursulfase resultou na redução da média do valor basal de aproximadamente 40 a 60% nos níveis de GAG urinário na semana 53, dependendo do grupo etário. A magnitude das reduções foi comparada com o registro anterior no estudo TKT024, o qual reportou uma redução de aproximadamente 60% para a mesma dose semanal de Idursulfase na semana 53. Reduções nos níveis de GAG urinário foram evidentes em todos os grupos de idade e apareceram logo na semana 18, continuando até a semana 53. O efeito farmacodinâmico do tratamento com Idursulfase, avaliado pela concentração de GAG urinário, foi menos pronunciado em indivíduos que desenvolveram resposta imune a Idursulfase.
Farmacocinética
As características farmacocinéticas da idursulfase foram avaliadas em 59 pacientes com a síndrome de Hunter. A concentração plasmática de idursulfase foi determinada pelo ensaio ELISA antígeno-específico. A área sob a curva de concentração versus tempo (AUC) aumentou mais do que a proporção da dose na faixa entre 0,15 mg/kg a 1,5 mg/kg, após uma única infusão de uma hora de duração com Idursulfase.
Os parâmetros farmacocinéticos no regime posológico recomendado (0,5 mg/ kg administrados semanalmente durante uma infusão de 3 horas) foram determinados na semana 1 e na semana 27 em dez pacientes com idade entre 7,7 e 27 anos. (Ver tabela 2). Não houve diferenças aparentes entre os valores dos parâmetros farmacocinéticos entre as semanas 1 e 27, independente do nível de anticorpos em tais pacientes.
Tabela 2 - Parâmetros farmacocinéticos no estudo TKT024 (média, desvio padrão)
Parâmetros farmacocinéticos | Semana 1 | Semana 27 |
Cmax (µg/mL) | 1,5 (0,6) | 1,1 (0,3) |
AUC (min x µg/mL) | 206 (87) | 169 (55) |
t1/2 (min) | 44 (19) | 48 (21) |
Cl (mL/min/kg) | 3,0 (1,2) | 3,4 (1,0) |
Vss (% PC) | 21 (8) | 25 (9) |
A farmacocinética também foi avaliada no estudo HGT-ELA-038 em pacientes entre 16 meses e 7,5 anos de idade que receberam 0,5 mg/kg de Idursulfase em infusão de 3h de duração. A farmacocinética foi avaliada na semana 1 (n=27) e na semana 27 (n=19) (vide Tabela 3). As concentrações séricas estavam abaixo do limite inferior de quantificação (LLOQ) em todos os pontos de tempo em 8 dos 27 indivíduos (30%) na semana 27, e mensurável somente em alguns pontos de tempo nos demais 19 indivíduos (70%). Os perfis farmacocinéticos de todos os 11 indivíduos anticorpos-negativos na semana 27 foram similares aos perfis na semana 1. Os 8 indivíduos anticorpos-positivos com concentrações séricas mensuráveis, exibiram taxa de clearance significantemente altas na semana 27 quando comparada à semana 1.
Tabela 3 - Média de parâmetros farmacocinéticos no estudo HGT-ELA-038 (n=27) 1 (DP)
Parâmetros farmacocinéticos | Média da Semana 1 (DP) n=27 | Média da Semana 27 (DP)** n=11 |
Cmax (µg/mL) | 1,3 (0,8) | 1,4 (0,4) |
AUC (min*µg/mL) | 224,3 (76,9) | 269,9 (78,3) |
t1/2 (min) | 160 (69) | 138(24) |
Cl (mL/min/kg) | 2,4 (0,7) | 2,0 (1,0) |
Vss (% BW) | 394 (423) | 280(102) |
*Valor t ½ estimado na fase terminal de 240 min até o ultimo ponto de dado mensurável.
**Pacientes que apresentaram teste negativo para anticorpos anti-idursulfase IgG na semana 27.
A exposição sistêmica (Cmax e AUC0-∞) e o clearance (Cl e Vss) de Idursulfase observados na semana 1 nos estudos TKT024 e HGT-ELA-038 estão resumidos na Tabela 2 e na Tabela 3.
De forma geral, não houve tendência aparente nem para a exposição sistêmica nem para taxa de clearance de Idursulfase em relação a idade ou ao peso corporal.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)