Qual a ação da substância do Xenpozyme?
Resultados de Eficácia
A eficácia de Alfaolipudase foi avaliada em 3 estudos clínicos (estudo DFI12712/ASCEND em pacientes adultos, estudo DFI13803/ASCEND-Peds em pacientes pediátricos e estudo de extensão LTS13632 em pacientes adultos e pediátricos) envolvendo um total de 61 pacientes com ASMD.
Estudo clínico em pacientes adultos
O estudo ASCEND é um estudo multicêntrico, randomizado, duplo-cego, controlado por placebo, de dose repetida fase II/III em pacientes adultos com ASMD (diagnóstico clínico consistente com ASMD tipo B e A/B). Um total de 36 pacientes foram randomizados em uma proporção 1:1 para receber Alfaolipudase ou placebo. O tratamento foi administrado em ambos os grupos como uma infusão intravenosa uma vez a cada 2 semanas. Os pacientes que receberam Alfaolipudase tiveram a dose escalonada de 0,1 mg/kg para uma dose alvo de 3 mg/kg.
O estudo foi dividido em 2 períodos consecutivos:
- Um período de análise primária (PAP) controlado por placebo randomizado e duplo-cego que durou até à semana 52, seguido de uma extensão do período de tratamento (ETP) por até 4 anos.
Os pacientes do braço placebo passaram a serem tratados com escalonamento de dose até 3 mg/kg de Alfaolipudase no ETP, enquanto os pacientes no braço original de Alfaolipudase continuaram o tratamento. A duração do estudo mais longo por paciente foi de até 5 anos e 3 meses.
Pacientes em condição clínica grave, incluindo malignidade, doença cardíaca significativa, uso de suporte ventilatório invasivo, hepatite B ou C ativa ou infecção pelo vírus da imunodeficiência humana (HIV), pacientes com contagem de plaquetas 250 UI/L, razão internacional normalizada (INR)>1,5 foram excluídos.
Os pacientes incluídos no estudo tinham uma capacidade de difusão pulmonar para o monóxido de carbono (DLco) ≤70% do valor normal previsto, um volume do baço ≥6 múltiplos do normal (MN) medido por imagem de ressonância magnética (MRI) e pontuações ≥5 na pontuação relacionada à esplenomegalia (SRS). Em geral, as características demográficas e da doença no momento basal foram semelhantes entre Os pacientes incluídos no estudo tinham uma capacidade de difusão pulmonar para o monóxido de carbono (DLco) ≤70% do valor normal previsto, um volume do baço ≥6 múltiplos do normal (MN) medido por imagem de ressonância magnética (MRI) e pontuações ≥5 na pontuação relacionada à esplenomegalia (SRS). Em geral, as características demográficas e da doença no momento basal foram semelhantes entre
Este estudo incluiu 2 desfechos primários de eficácia separados:
- A alteração percentual em DLco (em % prevista de normal) e o volume do baço (MN), conforme medido por MRI, do momento basal para a semana 52.
Os desfechos secundários de eficácia incluíram a alteração percentual no volume hepático (em MN) e a contagem de plaquetas do momento basal para a semana 52.
Melhorias na alteração percentual média em % prevista de DLco (p=0,0004) e volume do baço (p<0,0001), bem como no volume médio do fígado (p<0,0001) e contagem de plaquetas (p=0,0185) foram observados no grupo Alfaolipudase em comparação com o grupo placebo durante o período de análise primária de 52 semanas (ver Tabela 1, Figura 1 e Figura 2). Na semana 26 de tratamento, a primeira avaliação do desfecho pós-dose, observou-se uma melhoria significativa na alteração percentual média da % prevista de DLco, volume do baço, volume hepático e contagem de plaquetas.
Tabela 1: Valores médios (SD) para os desfechos de eficácia no momento basal e alteração percentual da média LS (SE) do momento basal para a semana 52
| - | Placebo (n=18) | Alfaolipudase (n=18) | Diferença [IC 95%] | Valor de p* |
| Desfechos Primários | ||||
| Média da % prevista de DLco no momento basal | 48,45 (10,77) | 49,44 (10,99) | NA | NA |
| Alteração percentual em % prevista de DLco do momento basal para a semana 52 | 2,96 (3.38) | 21,97 (3,34) | 19,01 (4,76) [9,32, 28,70] | 0,0004 |
| Desfechos Secundários | ||||
| Média do volume do fígado (MN) no momento basal | 1,62 (0,50) | 1,44 (0,32) | NA | NA |
| Alteração percentual no volume do fígado do momento basal para a semana 52 | -1,47 (2,54) | -28,06 (2,49) | -26,60 (3,59) [-33,91, -19,28] | <0,0001 |
| Média da contagem de plaquetas (109 /L) no momento basal | 115,58 (36,27) | 107,18 (26,93) | NA | NA |
| Alteração percentual da contagem de plaquetas do momento basal para a semana 52 | 2,49 (4,19) | 16,82 (3,96) | +14,33 (5,78) [2,56, 26,10] | 0,0185 |
*Estatisticamente significativo após ajuste de multiplicidade.
SD = desvio padrão, LS = mínimos quadrados, SE = erro padrão, MN = múltiplos do normal, IC = intervalo de confiança.
Figura 1: Gráfico da média LS (IC 95%) da alteração percentual em DLco (% prevista) do momento basal para a Semana 104 - população mITT (intenção de tratamento modificada)
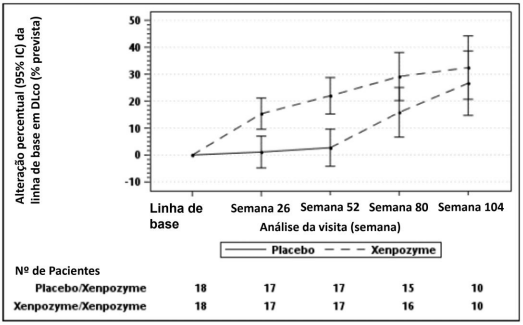
As barras verticais representam o IC 95% para a média LS.
A média LS e IC 95% são baseados em um modelo misto para abordagem de medidas repetidas, usando dados até a Semana 104.
Os pacientes do grupo placebo/ Alfaolipudase receberam placebo até a semana 52 e mudaram para Alfaolipudase depois disso.
Figura 2: Gráfico da média LS (IC 95%) da alteração percentual no volume do baço (MN) do momento basal para a semana 104 - população mITT (intenção de tratamento modificada)
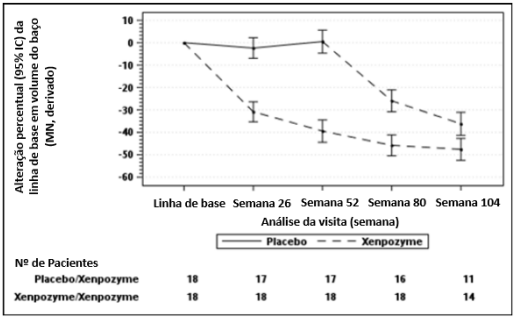
As barras verticais representam IC 95% para a média LS.
A média LS e IC 95% são baseados em um modelo misto para abordagem de medidas repetidas, usando dados até a Semana 104.
Os pacientes do grupo placebo/Alfaolipudase receberam placebo até a semana 52 e mudaram para Alfaolipudase depois disso.
Dezessete dos 18 pacientes que receberam previamente placebo e 18 dos 18 pacientes previamente tratados com Alfaolipudase durante 52 semanas (PAP) iniciaram ou continuaram o tratamento com Alfaolipudase, respectivamente, por até 4 anos. Na semana 104, os pacientes inicialmente randomizados para placebo receberam Alfaolipudase por 52 semanas e demonstraram as seguintes mudanças nos parâmetros clínicos a partir do momento basal (antes da primeira administração de Alfaolipudase): o aumento percentual médio (SE) do DLco previsto foi de 28,04% (6,16) (ver Figura 1); a redução percentual média (SE) no volume do baço (MN) foi de 35,93% (2,99) (ver Figura 2); a redução percentual média (SE) no volume hepático (MN) foi de 30,66 (2,45), o aumento percentual médio (SE) na contagem de plaquetas foi de 21,73 (6,43).
Os pacientes do grupo anterior Alfaolipudase demonstraram uma melhoria sustentada do momento basal para a semana 104 nos seguintes parâmetros: aumento percentual médio (SE) na % prevista DLco foi de 28,49 (6,16) (ver Figura 1); redução percentual média (SE) no volume do baço (MN) foi de 46,95 (2,65) (ver Figura 2); redução percentual média (SE) no volume do fígado (MN) foi de 33,42 (2,16); aumento percentual médio (SE) na contagem de plaquetas foi de 24,94 (6,91).
Estudo clínico em pacientes pediátricos
O estudo ASCEND-Peds (Estudo clínico fase 1/2) é um estudo multicêntrico, aberto, de dose repetida para avaliar a segurança e tolerabilidade do Alfaolipudase administrado durante 64 semanas em pacientes pediátricos com menos de 18 anos de idade com ASMD (diagnóstico clínico consistente com ASMD tipo B e A/B). Além disso, os desfechos de eficácia exploratórios relacionados à visceromegalia, funções pulmonares e hepáticas, e crescimento linear foram avaliados na semana 52.
Pacientes com anormalidades neurológicas agudas ou rapidamente progressivas, em condição clínica grave, incluindo malignidade, doença cardíaca significativa, uso de suporte ventilatório invasivo, hepatite B ou C ativa, pacientes com contagem média de plaquetas 250 UI/L ou bilirrubina total >1,5 mg/dL, ou uma razão internacional normalizada (INR) >1,5 e pacientes que são homozigotos para as mutações do gene SMPD1 p.Arg498Leu, p.Leu304Pro ou p.Phe333SerfsTer52 ou qualquer combinação dessas 3 mutações foram excluídos.
Não há dados de eficácia e segurança da utilização de Alfaolipudase em pacientes pediátricos com ASMD tipo A.
Os pacientes foram distribuídos em todas as idades de 1,5 a 17,5 anos em geral, com ambos os sexos representados em cada coorte de idade e igualmente representados no grupo geral (total de 10 homens e 10 mulheres). Os pacientes foram diagnosticados por volta dos 2 anos de idade (mediana), com os sintomas aparecendo por volta de 1 ano de idade (mediana). No início da doença, 18 pacientes (90,0%) apresentavam hepatomegalia e/ou esplenomegalia e 7 pacientes (35,0%) apresentavam doença respiratória. Doze pacientes (60,0%) tiveram esplenomegalia grave (>15 MN) no momento basal, e 1 paciente (11,0%) teve um valor percentual de DLco previsto severamente reduzido (<40,0%) entre aqueles que puderam realizar o teste.
Um total de 20 pacientes (4 adolescentes de 12 a 18 anos, 9 crianças de 6 a 12 anos e 7 bebês/crianças < 6 anos) foram titulados com Alfaolipudase através de um esquema de escalonamento de dose de 0,03 mg/kg para uma dose alvo de 3 mg/kg (ver Tabela 6 para informação sobre escalonamento de dose). O tratamento foi administrado como uma infusão intravenosa uma vez a cada 2 semanas por até 64 semanas.
Os pacientes incluídos no estudo tinham um volume de baço ≥5 MN medido por ressonância magnética.
Os pacientes foram distribuídos por todos os grupos etários de 1,5 a 17,5 anos de idade, com ambos os sexos igualmente representados.
A avaliação exploratória de eficácia de Alfaolipudase indica que houve melhorias na alteração percentual média em % prevista dos volumes de DLco, baço e fígado, contagem de plaquetas e progressão linear do crescimento (medida pelas pontuações Z de Altura) na semana 52 em comparação com o momento basal (ver Tabela 2).
Tabela 2: Média LS da alteração percentual (SE) ou variação (SD) do momento basal para a semana 52
| - | Valor do momento basal (n=20) | Semana 52 (n=20) |
| Média da % prevista de DLco (SD)b Alteração percentual em % prevista DLcob 95% IC Valor de pa | 54,79 (14,23) | 71,66 (14,80) 32,94 (8,27) 13,37; 52,50 0,0053 |
| Volume médio do baço (MN) (SD)c Alteração percentual no volume do baço (em MN)c 95% IC Valor de pa | 18,98 (8,77) | 9,27 (3,89) -49,21 (1,99) -53,39; -45,04 <0,0001 |
| Volume médio do fígado (MN) (SD)c Alteração percentual no volume do fígado (em MN)c 95% IC Valor de pa | 2,65 (0,74) | 1,53 (0,32) -40,56 (1,67) -44,07; -37,05 <0,0001 |
| Média da contagem de plaquetas (109/L) (SD)c Alteração percentual da contagem de plaquetasc 95% IC Valor de pa | 137,74 (62,32) | 173,61 (60,46) 34,03 (7,63) 17,94; 50,13 0,0003 |
| Altura média no escore Z (SD)c Alteração no escore Z de alturac 95% IC Valor de pa | -2,14 (0,84) | -1,64 (0,78) 0,56 (0,385) (0,377; 0,733) <0,0001 |
aValor nominal de p.
bDLco foi avaliado em 9 pacientes pediátricos com idade ≥ 5 anos, que foram capazes de realizar o teste.
cAll age cohorts.
Os efeitos de Alfaolipudase nos volumes do baço e do fígado, e o escore Z de altura foram semelhantes em todas as coortes de idade pediátrica incluídas no estudo.
Embora diferentes desenhos de estudos tenham sido empregados, os resultados da eficácia em populações adultas e pediátricas foram consistentes.
Olipudase alfa foi geralmente bem tolerada em todas as faixas etárias. A maioria dos TEAEs foram leves ou moderados. Cinco pacientes tiveram um total de 12 TEAEs graves, incluindo 3 pacientes que tiveram 5 TEAEs graves potencialmente relacionados (2 eventos de aumento de ALT em 1 paciente; urticária difusa e erupção cutânea difusa em 1 paciente e reação anafilática em 1 paciente). Nenhum paciente descontinuou permanentemente o tratamento devido a TEAEs ou se retirou do estudo, e nenhum paciente morreu. Todos os pacientes foram escalados para a dose alvo de 3,0 mg/kg.
Entre os 11 pacientes (55,0%) que apresentaram RIs especificadas pelo protocolo (6 pacientes na coorte infantil e 5 pacientes na coorte infantil/infantil), 2 pacientes (na coorte infantil/infantil) apresentaram RIs graves.
Um total de 7 pacientes (35,0%) apresentou aumento transitório de transaminases durante a fase de escalonamento de dose e isso levou à repetição ou diminuição de uma dose. Além disso, 16 dos 16 pacientes com ALT basal elevada apresentaram ALT dentro da faixa normal e 16 dos 17 pacientes com AST basal elevada apresentaram AST dentro da faixa normal ao longo de 52 semanas de tratamento com Alfaolipudase.
Todos os casos de reduções de dose relacionadas ao medicamento ocorreram durante a fase de escalonamento de dose, exceto 1 caso em um paciente que teve uma reação de hipersensibilidade seguida por consecutivas doses perdidas não relacionadas.
Outras medidas laboratoriais, sinais vitais e ECGs não levantaram nenhuma preocupação de segurança.
Estudo de extensão em pacientes adultos e pediátricos
Os pacientes que participaram do estudo DFI13412 (estudo de dose ascendente aberto em pacientes adultos ASMD) ou estudos DFI13803/ASCEND-Peds continuaram o tratamento em um estudo de extensão aberto (LTS13632). Cinco pacientes adultos do estudo DFI13412 e 20 pacientes pediátricos do estudo DFI13803/ASCEND-Peds receberam Alfaolipudase a 3 mg/kg uma vez a cada 2 semanas por infusão intravenosa por até 7 anos e 5 anos em pacientes adultos e pediátricos, respectivamente.
Melhorias sustentadas na % prevista de DLco, volume do baço e fígado e contagem de plaquetas, em comparação ao momento basal, foram observadas em pacientes adultos e pediátricos durante o curso do estudo. Além disso, pacientes pediátricos (todas as coortes de idade) apresentaram uma melhora contínua no escore Z de Altura e uma melhora na idade óssea (por raio-X manual) no mês 48, indicando que a idade óssea estava se aproximando da idade cronológica.
Características Farmacológicas
Mecanismo de ação
A deficiência de esfingomielinase ácida (ASMD) é um distúrbio de armazenamento lisossomal raro e potencialmente fatal. Pacientes com ASMD têm prejuízo variável no metabolismo da esfingomielina devido a variantes patogênicas no SMPD1, o gene que codifica a esfingomielinase ácida (ASM) que resulta na expressão de ASM defeituosa com atividade reduzida. Como a ASM catalisa a hidrólise da esfingomielina em ceramida e fosfocolina, a redução da atividade da ASM resulta no acúmulo progressivo de esfingomielina lisossomal principalmente dentro das células da linhagem de monócitos/macrófagos que residem em tecidos reticuloendoteliais, ou seja, no baço, fígado, pulmão, medula óssea, e linfonodos. Com a doença grave, os neurônios também podem ser afetados. O espectro fenotípico varia desde a forma neurovisceral infantil grave (ASMD tipo A) para a forma visceral crônica (ASMD tipo B), com uma apresentação fenotípica neurovisceral intermediária ou crônica também sendo descrita (ASMD tipo A/B).
A Alfaolipudase é uma esfingomielinase ácida humana recombinante expressa em células de ovário de hamster chinês, desenvolvida como uma terapia de reposição enzimática para o tratamento de manifestações não relacionadas ao SNC. Não se espera que Alfaolipudase atravesse a barreira hematoencefálica ou que apresente atividade em relação às manifestações da doença no SNC.
Propriedades farmacodinâmicas
A ceramida é um catabólito direto do metabolismo da esfingomielina mediado pela Alfaolipudase e a lisoesfingomielina é a forma desacetilada da esfingomielina (SM); ambos os parâmetros são usados para avaliar os efeitos farmacodinâmicos do Alfaolipudase.
Após a administração repetida de Alfaolipudase em pacientes adultos e pediátricos, os níveis plasmáticos de ceramida mostraram um aumento transitório após cada dose (pós-infusão), com uma diminuição gradual nos níveis plasmáticos durante o período de tratamento. No estudo DFI12712/ASCEND, a alteração percentual da média dos mínimos quadrados (LS) desde o início até a semana 52 (erro padrão, SE) no nível de ceramida plasmática pré-infusão foi de -36,4% (5,3) no grupo em tratamento com Alfaolipudase em comparação com -0,2% (5,6) no grupo placebo. Em pacientes pediátricos, a média LS do nível de ceramida plasmática pré-infusão foi reduzido em 57% (SE: 5,1) em comparação com o momento basal após 52 semanas de tratamento.
A liso-esfingomielina é substancialmente elevada no plasma de pacientes adultos e pediátricos com ASMD.
Após a administração repetida de Alfaolipudase, os níveis de liso-esfingomielina plasmática diminuíram significativamente, refletindo a redução do conteúdo de esfingomielina no tecido. No estudo DFI12712/ASCEND, a alteração percentual média LS do momento basal para a Semana 52 (SE) do nível da liso-esfingomielina plasmática pré-infusão foi de -77,7% (3,9) no grupo em tratamento com Alfaolipudase em comparação com -5% (4,2) no grupo placebo. Em pacientes pediátricos, a média LS do nível de liso-esfingomielina plasmática pré-infusão foi reduzido em 87,2% (SE: 1,3) em comparação com o momento basal após 52 semanas de tratamento.
Em pacientes adultos, o conteúdo de esfingomielina do fígado, conforme avaliado pela histopatologia, diminuiu 92% (SE: 8,1) do momento basal para a semana 52 no grupo em tratamento com Alfaolipudase (comparado com +10,3% (SE: 7,8) no grupo placebo).
Propriedades farmacocinéticas
A farmacocinética (PK) de Alfaolipudase foi avaliada em 49 pacientes adultos com ASMD de todos os estudos clínicos, recebendo uma ou várias administrações.
A Alfaolipudase exibiu farmacocinética linear na faixa de doses de 0,03 a 3 mg/kg. Seguindo um esquema de escalonamento de dose de 0,1 mg/kg para a dose de manutenção de 3 mg/kg administrada uma vez a cada 2 semanas, houve um acúmulo mínimo nos níveis plasmáticos de Alfaolipudase. Na dose de 3 mg/kg administrada uma vez a cada 2 semanas, a média (coeficiente de variação percentual, CV%) de concentração máxima (Cmax) e área sob a curva de tempo-concentração ao longo de um intervalo de dosagem (AUC0-τ) no estado estacionário foram de 30,2 μg/mL (17%) e 607 μg.h/mL (20%), respectivamente.
Absorção
Não há absorção uma vez que Alfaolipudase é administrado por via intravenosa.
Distribuição
A média estimada (CV%) do volume de distribuição de Alfaolipudase é de 13,1 L (18%).
Metabolismo
A Alfaolipudase é uma enzima recombinante humana e espera-se que seja eliminada através da degradação proteolítica em pequenos peptídeos e aminoácidos.
Eliminação
A média (CV%) de depuração de Alfaolipudase é de 0,331 L/h (22%). A meia-vida terminal média (t1/2) variou de 31,9 a 37,6 horas.
Populações especiais
Gênero
Não houve diferenças clinicamente relevantes na farmacocinética de Alfaolipudase com base no sexo.
Raça
Existe informação limitada da farmacocinética de Alfaolipudase em grupos étnicos não caucasianos.
Pacientes idosos (≥ 65 anos de idade)
Existe informação limitada sobre farmacocinética de Alfaolipudase em pacientes idosos (apenas 2 pacientes entre 65 e 75 anos de idade incluídos em estudos clínicos com Alfaolipudase).
Pacientes pediátricos
A PK de Alfaolipudase foi avaliada em 20 pacientes pediátricos, incluindo 4 pacientes adolescentes, 9 pacientes crianças e 7 pacientes crianças/recém-nascidos (Tabela 3). As exposições de Alfaolipudase foram menores em pacientes pediátricos do que em pacientes adultos. Estas diferenças não foram consideradas como clinicamente relevantes.
Tabela 3 - Média (CV%) dos parâmetros PK de Alfaolipudase seguidos da administração de 3 mg/kg a cada 2 semanas em adolescentes, crianças e crianças/recém-nascidos com ASMD
| Grupo de idade | Idade (ano) | Cmax (µg/mL) | AUC0-τ (µg.h/mL) |
| Adolescente (n=4) | 12, < 18 | 27,5 (8) | 529 (7) |
| Criança (n=9) | 6, < 12 | 24 (10) | 450 (15) |
| Criança/Recém-nascido (n=7) | < 6 | 22,8 (8) | 403 (11) |
As estatísticas descritivas representam as estimativas post hoc da exposição em estado estacionário usando a análise farmacocinética da população.
AUC0-τ: área sob a concentração plasmática versus curva de tempo ao longo de um intervalo de dosagem; Cmax: concentração plasmática máxima; n: número total de pacientes.
Deficiência Hepática
A Alfaolipudase é uma proteína recombinante e espera-se que seja eliminada por degradação proteolítica. Portanto, não se espera que o comprometimento da função hepática afete a farmacocinética de Alfaolipudase.
Deficiência Renal
Não houve diferenças clinicamente relevantes na farmacocinética de Alfaolipudase em pacientes com comprometimento renal leve. O impacto da insuficiência renal moderada a grave na farmacocinética de Alfaolipudase não é conhecido. Não se espera que Alfaolipudase seja eliminada por excreção renal. Portanto, não se espera que a insuficiência renal afete a farmacocinética de Alfaolipudase.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)