Qual a ação da substância do Venclexta?
Resultados de Eficácia
Estudo M13-982
O estudo clínico M13-9821 foi um estudo multicêntrico, aberto de braço único de 107 pacientes com LLC previamente tratados e com a deleção 17p. Dos pacientes, 65,4% eram do sexo masculino e 97,2% eram brancos. A idade média foi de 67 anos (variação: 37-85 anos), e o tempo médio desde o diagnóstico foi de 6,8 anos (variação: 0,1 a 32 anos; N=106). O número médio de tratamentos anteriores para LLC foi de 2 (intervalo: 1-10 tratamentos). No início do estudo, 53,3% dos pacientes tinham um ou mais nódulos ≥ 5 cm, e 50,5% dos pacientes apresentaram ALC ≥ 25 x 109 / L. O estado de performance baseline do ECOG foi zero para 39,3%, um para 52,3%, e 2 para 8,4% dos pacientes.
Dos pacientes, 37,4% (34/91) eram refratários à fludarabina, 81,1% (30/37) apresentavam o gene IGHV não mutado, e 23,8% (19/80) tiveram deleção 11q.
Os pacientes receberam Venetoclax através de uma programação de escalonamento de dose semanal a partir de 20 mg e aumentando até 50 mg, 100 mg, 200
mg e, finalmente, 400 mg uma vez por dia. Os pacientes continuaram a receber 400 mg de Venetoclax por via oral, uma vez ao dia, até a progressão da doença ou toxicidade inaceitável. O tempo médio de tratamento no momento da avaliação foi de 12,1 meses (variação: 0-21,5 meses).
O desfecho primário de eficácia foi a taxa de resposta global (ORR) como avaliado por uma Comissão de Revisão Independente (IRC) usando o Workshop Internacional para Leucemia Linfocítica Crônica (IWCLL) atualizadas pelas diretrizes do Grupo de Trabalho patrocinado pela National Cancer Institute (NCI-WG) (2008). Os resultados de eficácia estão apresentados na Tabela 01.
Tabela 01. Resultados de eficácia do Estudo M13-982
| - | Avaliação IRC (n=107)a | Avaliação do investigador (n=107)a |
ORR, % (95% CI) | 79,4 (70,5; 86,6) | 73,8 (64,4; 81,9) |
CR + CRi (%) | 7,5 | 15,9 |
nPR (%) | 2,8 | 3,7 |
PR (%) | 69,2 | 54,2 |
Dor, % (95% CI) Estimado de 12 meses | 84,7 (74,5; 91,0) | 89,1 (79,2; 94,4) |
a Um paciente não apresentava deleção 17p.
CI: intervalo de confiança.
CR: remissão completa.
CRi: remissão completa com recuperação incompleta da medula óssea.
DOR: duração da resposta.
IRC: Comitê de Revisão Independente.
nPR: remissão nodular parcial.
ORR: taxa de resposta global (CR + CRi + nPR + PR).
PR: remissão parcial.
A doença residual mínima (MRD) foi avaliada por citometria de fluxo em 45 dos 107 pacientes que alcançaram a remissão completa (CR), a remissão completa com a recuperação incompleta da medula óssea (CRi), ou remissão parcial (PR) com a doença permanecendo limitada com o tratamento de Venetoclax. O ponto de corte para um estado negativo era uma célula de LLC por 104 leucócitos na amostra (isto é, um valor de MRD de <10-4 foi considerado MRD negativo). Dezessete por cento (18/107) dos pacientes estavam com MRD negativo no sangue periférico, incluindo 06 pacientes que eram também MRD negativo na medula óssea.
Houve 73 pacientes que completaram a avaliação do estado de saúde global (GHS) e 76 pacientes que completaram as avaliações de Funcionamento emocional (FE) e Social (FS) no questionário EORTC QLQ-C30, tanto no baseline quanto na semana 24. Houve 74 e 77 pacientes, respectivamente, que completaram as avaliações do papel funcional (RF) e a da escala de sintomas de fadiga, tanto no baseline quanto na semana 24. Após o tratamento com Venetoclax, os pacientes apresentaram melhora no GHS (16%), FE (10,6%), FS(17,1%), RF (16,2%), e a pontuação de sintomas de fadiga (17,5%) na semana 24. As melhoras nestas medidas já foram observadas a partir da semana 04.
Estudo M14-032
O estudo M14-0322,3 foi um estudo aberto, multicêntrico que avaliou a eficácia de Venetoclax em pacientes com LLC previamente tratados e que haviam progredido durante ou após o uso de ibrutinibe (Braço A) ou idelalisibe (Braço B). Os pacientes receberam uma dose diária de 400 mg de Venetoclax após a fase de escalonamento de dose. Os pacientes continuaram a receber Venetoclax 400 mg, uma vez ao dia, até que a progressão da doença ou toxicidade inaceitável fosse observada.
A eficácia foi avaliada por uma Comissão de Revisão Independente (IRC) utilizando o Workshop Internacional para Leucemia Linfocítica Crônica (IWCLL) atualizadas pelas diretrizes do Grupo de Trabalho patrocinado pela National Cancer Institute (NCI-WG). As avaliações de resposta foram realizadas na Semana 08, Semana 24 e posteriormente, a cada 12 semanas para os 64 pacientes da coorte principal, enquanto os pacientes recrutados na coorte de expansão tiveram avaliação da doença nas semanas 12 e 36.
Um total de 127 pacientes foram recrutados no estudo: 64 pacientes no coorte principal (43 previamente com ibrutinibe, 21 previamente com idelalisibe) e 63 pacientes no coorte de expansão (48 previamente com ibrutinibe, 15 previamente com idelalisibe). A idade média dos pacientes era 66 anos (intervalo: 28-85 anos), 70% eram do sexo masculino e 92% eram brancos. O tempo médio desde o diagnóstico foi de 8,3 anos (intervalo: 0,3- 18,5 anos; N = 96). O número médio de tratamentos anteriores para LCC foi de 4 (intervalo: 1-15 tratamentos). No baseline, 41% dos pacientes tinham um ou mais nódulos ≥ 5 cm e 31% dos pacientes apresentavam CAL ≥25 x 109 / L.
Os dados de eficácia são apresentados com data de corte de 31 de janeiro de 2017. A eficácia avaliada pelo investigador (N = 108) incluiu todos os 64 pacientes na coorte principal com mais de 24 semanas de avaliação, 37 pacientes da coorte de expansão com 36 semanas de avaliação e 7 pacientes que haviam progredido antes da avaliação de 36 semanas. Os resultados de eficácia pelo IRC (N = 97) incluíram 64 pacientes da coorte principal e 33 pacientes da coorte de expansão.
Os resultados de eficácia para 108 pacientes avaliados pelo investigador e 97 pacientes avaliados pelo IRC são apresentados na Tabela 02.
Tabela 02. Resultados de Eficácia para Pacientes que apresentaram progressão com ibrutinibe ou idelalisibe por IRC no Estudo M14-032
| - | Avaliação IRC (N=97) | Avaliação do Investigador (N=108) |
ORR, n (%), (95% CI) | 73,2, (63,2; 81,7) | 65,7, (56; 74,6) |
CR + CRi, n (%) | 1 | 9,3 |
nPR, n (%) | 0 | 1,9 |
PR, n (%) | 72,2 | 54,6 |
Dor, % (95% CI), Estimado de 6 meses, Estimado de 12 meses | N=71, 96,8 (87,6; 99,2), NA | N=71, 95,5 (86,8; 98,5), 85,2 (72,0; 92,4) |
Tempo para a primeira resposta, mediana, meses (intervalo) | 2,5 (1,0-8,9) | 2,5 (1,6; 14,9) |
CI: intervalo de confiança.
CR: remissão completa.
CRi: remissão completa com recuperação incompleta da medula óssea.
DOR: duração da resposta.
IRC: Comitê de Revisão Independente.
nPR: remissão nodular parcial.
ORR: taxa de resposta global (CR + CRi + nPR + PR).
PR: remissão parcial.
A duração média do tratamento com Venetoclax para 127 pacientes com avaliação do investigador foi de 10,2 meses (intervalo: 0,1 a 25,6 meses). A duração média do tratamento com Venetoclax para 97 pacientes com avaliação do IRC foi de 12,3 meses (intervalo: 0,1 a 25,6 meses). A taxa de DRM negativo no sangue periférico para todos os 127 pacientes foi de 30% (29/127), incluindo 5 pacientes que alcançaram DRM negativo na medula óssea.
Referências Bibliográficas
1.Stilgenbauer S, Eichhorst B, Schetelig J, et al. Venetoclax in relapsed or refractory chronic lymphocytic leukaemia with 17p deletion: a multicentre, openlabel, phase 2 study.Lancet Oncol. 2016 Jun;17(6):768-778.
2.Jones JA, Mato AR, Wierda WG, et al. Venetoclax for chronic lymphocytic leukaemia progressing after ibrutinib: an interim analysis of a multicentre, openlabel, phase 2 trial. Lancet Oncol. 2018 Jan;19(1):65-75.
3.Coutre S, Choi M, Furman RR, et al. Venetoclax for patients with chronic lymphocytic leukemia who progressed during or after idelalisib therapy. Blood. 2018 Apr 12;131(15):1704-1711.
Características Farmacológicas
O ativo de Venetoclax é um sólido amarelo claro a amarelo escuro com fórmula empírica C45H50ClN7O7S e peso molecular de 868,44. Venetoclax tem solubilidade muito baixa em água.
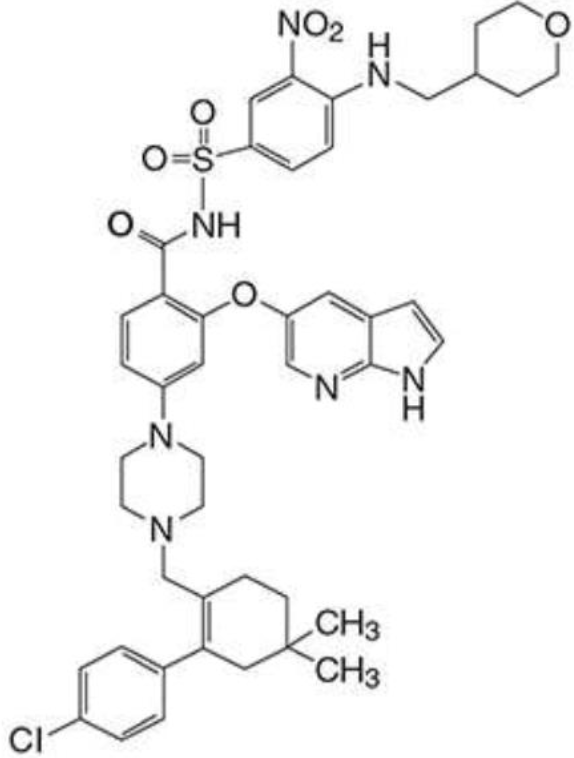
O nome químico de Venetoclax é definido como 4-(4-{[2-(4-clorofenil)- 4,4-dimetilciclohex-1-em-1-il]metil}piperazina-1-il)-N-({3-nitro-4-[(tetrahidro-2H-piran- 4-ilmetil)amino]fenil}sulfonil)-2-(1H-pirrolo[2,3-b]piridina-5-iloxi)benzamida) e possui a seguinte estrutura química.
Mecanismo de ação
Venetoclax é um potente, seletivo e oralmente biodisponível inibidor de pequena molécula da célula de linfoma B (Bcl-2), uma proteína antiapoptótica. A superexpressão da Bcl-2 tem sido demonstrada em várias doenças malignas hematológicas e tumores sólidos, e tem sido implicada como um fator de resistência para determinados agentes terapêuticos. Venetoclax se liga diretamente ao canal de ligação-BH3 da Bcl-2, deslocando a proteína pro-apoptótica BH3 motif-containing como BIM, para iniciar a permeabilização da membrana mitocondrial externa (MOMP), a ativação de caspase e, a morte celular programada. Em estudos não clínicos, Venetoclax demonstrou atividade citotóxica em uma grande variedade de células B e outras doenças malignas hematológicas.
Farmacodinâmica
Eletrofisiologia Cardíaca
O efeito no intervalo QTc de doses múltiplas de Venetoclax de até 1200 mg uma vez por dia foi avaliado em um estudo aberto de braço único de 176 pacientes com LLC ou Linfoma não-Hodgkin (NHL) tratados previamente. Venetoclax não teve efeito sobre o intervalo QTc e não houve relação entre a exposição de Venetoclax e mudanças no intervalo QTc
Farmacocinética
Absorção
Após múltiplas administrações orais, a concentração plasmática máxima de Venetoclax foi atingida em 5-8 horas após a dose. A AUC no estado estacionário de Venetoclax aumentou proporcionalmente no intervalo de doses de 150-800mg. Em condições de refeição com baixo teor de gordura, a média (± desvio padrão) da Cmax no estado estacionário foi de 2,1 ± 1,1 μg / mL e AUC24 foi de 32,8 ± 16,9 μg • h/mL na dose de 400 mg uma vez por dia.
Efeito dos Alimentos
A administração com uma refeição de baixo teor de gordura aumentou a exposição de Venetoclax em cerca de 3,4 vezes e a administração com uma refeição rica em gorduras aumentou a exposição de Venetoclax de 5,1 para 5,3 vezes em comparação com condições de jejum. Venetoclax deve ser administrado durante as refeições.
Distribuição
Venetoclax é fortemente ligado às proteínas do plasma humano com fração livre no plasma <0,01 em uma faixa de concentração de 1-30 mM (0,87-26 ug / mL). A proporção média de sangue para plasma foi de 0,57. A estimativa da população para o volume aparente de distribuição (Vdss / F) de Venetoclax variou de 256 – 321 L em pacientes.
Metabolismo
Estudos in vitro demonstraram que Venetoclax é predominantemente metabolizado pelo CYP3A4.O M27 foi identificado como o principal metabólito no plasma, com uma atividade inibidora da Bcl-2, de pelo menos 58 vezes menor do que Venetoclax in vitro.
Eliminação
A estimativa da população para a meia-vida de eliminação da fase terminal de Venetoclax foi de aproximadamente 26 horas. Após uma única administração oral de 200 mg de Venetoclax radiomarcado (14C) em indivíduos saudáveis, > 99,9% da dose foi recuperada nas fezes e <0,1% da dose administrada foi excretada na urina em 9 dias. O Venetoclax inalterado representou 20,8% na dose radioativa administrada e excretada nas fezes. A farmacocinética de Venetoclax não muda ao longo do tempo.
Populações especiais
Idade, Raça, Gênero e Peso
Baseando-se na análise farmacocinética populacional, idade, raça, gênero e peso não afetaram a liberação de Venetoclax.
Uso pediátrico
A farmacocinética de Venetoclax não foi avaliada em pacientes < 18 anos.
Insuficiência renal
Com base em uma análise farmacocinética da população, que incluiu 211 pacientes com insuficiência renal leve (CrCl ≥ 60 e < 90 mL/min), 83 pacientes com insuficiência renal moderada (CrCl ≥30 e <60 mL / min) e 210 pacientes com função renal normal (CrCl ≥90 mL / min), as exposições de Venetoclax em pacientes com insuficiência renal leve ou moderada foram semelhantes àqueles com função renal normal. A farmacocinética de Venetoclax não foi estudada em pacientes com insuficiência renal grave (CrCl <30 mL / min) ou indivíduos em diálise.
Insuficiência hepática
Com base em uma análise farmacocinética da população que incluiu 69 pacientes com insuficiência hepática leve, 7 pacientes com insuficiência hepática moderada e 429 pacientes com função hepática normal, as exposições de Venetoclax foram semelhantes em pacientes com insuficiência hepática leve e moderada e função hepática normal. A insuficiência hepática leve foi definida como bilirrubina total normal total e aspartato transaminase (AST) >que o limite superior normal (ULN) ou bilirrubina total > 1,0 a 1,5 vezes de ULN, insuficiência hepática moderada como bilirrubina total > 1,5 a 3,0 vezes da ULN, e insuficiência hepática grave como bilirrubina total > 3,0 ULN. A farmacocinética de Venetoclax não foi estudada em indivíduos com insuficiência hepática grave.
Interação medicamentosa
Inibidores da CYP3A
A coadministração de 400mg de cetoconazol uma vez ao dia, um forte inibidor da CYP3A, P-gp e inibidor da BCRP, por 07 dias em 11 pacientes com linfoma não-Hodgkin tratados previamente aumentou a Cmax de Venetoclax em 130 % e AUC∞ em 540%.
A coadministração de 50 mg de ritonavir uma vez ao dia, um forte inibidor da CYP3A, Pgp e inibidor da OATP1/B3B1, por 14 dias em 6 pacientes sádios aumentou a Cmax de Venetoclax em 140% e AUC∞ em 690%.
Indutores da CYP3A
A coadministração de 600 mg de rifampicina uma vez ao dia, um forte indutor da CYP3A, por 13 dias em 10 indivíduos saudáveis diminuiu a Cmax de Venetoclax em 42% e AUC∞ em 71%.
Inibidores da OATP1B1/1B3 e P-gp
A coadministração de 600 mg de rifampicina em dose única, um inibidor da OATP1B1/1B3 e P-gp, em 11 indivíduos saudáveis aumentou a Cmax de Venetoclax em 106% e AUC∞ em 78%.
Azitromicina
A co-administração de 500 mg de azitromicina, no primeiro dia seguida de 250 mg de azitromicina durante 4 dias em 12 indivíduos saudávei diminuiu a Cmax de Venetoclax em 25% e a AUC∞ em 35%.
Agentes redutores da acidez gástrica
Com base na análise farmacocinética populacional, agentes redutores da acidez gástrica (por exemplo, inibidores da bomba de prótons, antagonistas do receptor H2 e antiácidos) não afetou a biodisponibilidade de Venetoclax.
Varfarina
Em um estudo de interação medicamento-medicamento em três voluntários saudáveis, a administração de 400 mg de Venetoclax em dose única com 5 mg de varfarina resultou em um aumento de 18% para 28% na Cmax e AUC∞ da R-varfarina e S-varfarina.
Digoxina
Em um estudo de interação medicamento-mediamento em 10 voluntários saudáveis, a administração de uma dose única de 100 mg de Venetoclax com 0,5 mg de digoxina, um substrato da P-gp, resultou em um aumento de 35% na Cmax da digoxina e um aumento de 9% na AUC∞ da digoxina.
Estudos in vitro
Os estudos in vitro indicaram que Venetoclax não é um inibidor ou indutor da CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 ou CYP3A4 em concentrações clinicamente relevantes.
O Venetoclax é um inibidor fraco da UGT1A1 in vitro mas, não é previsto causar uma inibição clinicamente relevante da UGT1A1. O Venetoclax não é um inibidor da UGT1A4, UGT1A6, UGT1A9 e UGT2B7. O Venetoclax é um substrato de P-gp e BCRP, bem como um inibidor da P-gp e BCRP e fraco inibidor da OATP1B1 in vitro. Não é esperado que Venetoclax iniba OATP1B3, OCT1, OCT2, OAT1, OAT3, MATE1 ou MATE2K em concentrações clinicamente relevantes.
Dados de segurança pré-clínicos
Carcinogenicidade. Mutagênese e Alterações na Fertilidade
Não foram conduzidos estudos de carcinogenicidade com Venetoclax. Venetoclax não foi mutagênico em um ensaio in vitro de mutagenicidade bacteriana (Ames), não induziu anormalidades numéricas ou estruturais em um ensaio in vitro de anormalidade cromossômicas utilizando linfócitos periféricos de sangue humano, e não foi clastogênico em um ensaio in vivo de micronúcleos da medula óssea de ratos em doses de até 835 mg /kg. O metabolito M27 foi negativo para a atividade genotóxica nos ensaios in vitro de Ames e de alterações cromossômicas e em camundongos tiveram efeitos semelhantes ao Venetoclax (diminuição de linfócitos e massa de hemácias), mas de menor magnitude, consistente com sua baixa potência farmacológica in vitro.
Estudos de desenvolvimento embrionário precoce e de fertilidade foram realizados em camundongos machos e fêmeas. Estes estudos avaliaram o acasalamento, a fertilização e o desenvolvimento embrionário por meio de implantação. Não houve efeitos de Venetoclax nos ciclos estrais, de acasalamento, fertilidade, corpo lúteo, implantes uterinos ou embriões vivos por ninhada em doses de até 600 mg/kg/dia (em camundongos machos e fêmeas, com aproximadamente 2,8 e 3,2 vezes da exposição AUC humana na dose recomendada, respectivamente). No entanto, um risco para a fertilidade masculina humana existe com base na toxicidade testicular (perda de células germinativas) observada em cães em todas as doses examinadas (exposições de 0,5 a 18 vezes da exposição AUC humana na dose recomendada). A reversibilidade deste achado não foi demonstrada.
Toxicidade e/ou Farmacologia Animal
Além da perda de células germinativas testiculares, outras toxicidades foram observadas em estudos em animais com Venetoclax que incluíram reduções dose-dependentes de linfócitos e massa de glóbulos vermelhos. Ambos os efeitos foram reversíveis após a interrupção da administração de Venetoclax, com recuperação dos linfócitos ocorrendo em 18 semanas após o tratamento. As células-B e células-T foram afetadas, mas as perdas mais significativas ocorreram com células-B. A diminuição de linfócitos não foi associada com infecções oportunistas.
Venetoclax também causou necrose de única célula em vários tecidos, incluindo a vesícula biliar e pâncreas exócrino, sem evidência de ruptura da integridade do tecido ou disfunção dos órgãos; estes achados foram de mínimos a leves em magnitude. Após um período de dose de quatro semanas e subsequente período de recuperação de quatro semanas, a necrose mínima de única célula ainda estava presente em alguns tecidos e a reversibilidade não foi avaliada por com períodos mais longos de dosagem ou de recuperação.
Além disso, depois de aproximadamente três meses de administração diária em cães, Venetoclax causou descoloração branca e progressiva do pêlo, devido à perda de pigmento melanina no cabelo. Não foram observadas alterações na qualidade do revestimento do pêlo ou da pele, nem em outros tecidos pigmentados examinados (por exemplo, a íris e o fundo ocular do olho). A reversibilidade das alterações do pêlo não tem sido avaliada em cães.
Em ratos fêmeas grávidas, a exposição sistêmica materna (AUC) ao Venetoclax foi aproximadamente 14 vezes superior à exposição em humanos na dose de 400 mg. Níveis mensuráveis de radioatividade nos tecidos fetais (fígado, trato GI) foram > 15 vezes menores que os níveis maternos nos mesmos tecidos. A radioatividade derivada de Venetoclax não foi detectada no sangue fetal, cérebro, olhos, coração, rim, pulmão, músculo ou medula espinhal.
Venetoclax foi administrado (dose única; 150 mg / kg por via oral) em ratos lactentes 8-10 dias de parto. O Venetoclax identificado no leite foi 1,6 vezes menor do que no plasma. A droga principal (Venetoclax) representou a maior parte do total de material relacionado ao medicamento no leite, com níveis vestigiais de três metabólitos.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)