Qual a ação da substância do Torisel?
Resultados de Eficácia
A segurança e a eficácia do tensirolimo no tratamento de carcinoma de células renais avançado foram estudadas em dois estudos clínicos randomizados.
O Estudo pivotal Fase III, multicêntrico, aberto e randomizado em 3 grupos avaliou pacientes previamente não tratados com carcinoma de células renais avançado e com 3 ou mais dos 6 fatores de risco prognóstico préselecionados (menos de um ano do tempo do diagnóstico inicial de carcinoma de células renais até a randomização, Índice de Performance Karnofsky de 60 ou 70, hemoglobina abaixo do limite inferior da normalidade, cálcio corrigido de mais de 10 mg/dL, desidrogenase lática 1,5 vez acima do limite superior da normalidade, mais de 1 sítio metastático em órgão). O endpoint primário do estudo foi sobrevida global (OS). Os endpoints secundários incluíram sobrevida livre de progressão (PFS), taxa de resposta objetiva (ORR), taxa de benefício clínico, tempo para falha do tratamento (TTF) e medida da sobrevida ajustada pela qualidade. Os pacientes foram estratificados por status de nefrectomia anterior e foram randomizados (1:1:1) para receber interferona-α (IFN-α) isoladamente (n=207), tensirolimo isoladamente (25 mg semanalmente; n=209) ou a associação de IFN-α e tensirolimo (n=210).
O grupo tratado com a associação não teve uma relação risco/benefício clínico positiva em comparação ao IFNα. O tratamento com a associação de tensirolimo 15 mg e IFN-α resultou em aumento estatisticamente significativo da incidência de alguns eventos adversos de Grau 3-4 (perda de peso, anemia, neutropenia, trombocitopenia e inflamação da mucosa) em comparação aos eventos adversos observados nos grupos IFN-α ou tensirolimo 25 mg isoladamente. A associação de tensirolimo 15 mg e IFN-α não resultou em aumento significativo da sobrevida global em comparação ao IFN-α isoladamente (mediana de 8,4 vs. 7,3 meses, razão de risco = 0,96, p = 0,6965).
As informações sobre os grupos tratados com tensirolimo 25 mg isoladamente e IFN-α isoladamente estão descritas neste item. Os dados demográficos e as características da doença da população em estudo são apresentados na Tabela 1. Os dados demográficos e as características da doença na Fase Basal foram bemequilibrados entre os grupos de tratamento.
Tabela 1. Dados Demográficos e Outras Características da Fase Basal em Pacientes do Estudo Pivotal:
Característica | Tensirolimo 25 mg n (%) | IFN-α n (%) |
Total de pacientes no grupo de tratamento | 209 | 207 |
Idade | - | - |
< 65 anos | 145 (69,4) | 142 (68,6) |
> 65 ano | 64 (30,6) | 65 (31,4) |
Sexo | - | - |
Feminino | 70 (33,5) | 59 (28,5) |
Masculino | 139 (66,5) | 148 (71,5) |
Raça | - | - |
Branca | 186 (89,0) | 191 (92,3) |
Asiática | 6 (2,9) | 4 (1,9) |
Negra | 9 (4,3) | 8 (3,9) |
Outra | 8 (3,8) | 4 (1,9) |
Nefrectomia anterior | - | - |
Não | 70 (33,5) | 68 (32,9) |
Sim | 139 (66,5) | 139 (67,1) |
Estágio da doença na Fase Basal | - | - |
Estágio IV | 200 (95,7) | 201 (97,1) |
Estágio II Recidivante | 1 (0,5) | 1 (0,5) |
Estágio III Recidivante | 8 (3,8) | 5 (2,4) |
Tipo de células primárias | - | - |
Células claras | 169 (82,0) | 170 (82,5) |
Indeterminado | 24 (11,7) | 23 (11,2) |
Células não claras | 13 (6,3) | 13 (6,3) |
Desconhecido | 3 | 1 |
No Estudo pivotal, tensirolimo 25 mg foi associado a uma vantagem estatisticamente significativa em relação ao IFN-α no parâmetro final primário da sobrevida global (OS) (tempo da randomização até o óbito). O grupo tratado com tensirolimo demonstrou aumento de 49% da sobrevida global (OS) mediana em comparação ao grupo que recebeu IFN-α.
A Figura 1 é um gráfico de Kaplan-Meier da sobrevida global (OS) no Estudo pivotal. O tensirolimo também foi associado à vantagens estatisticamente significativas em relação ao IFN-α nos endpoints secundários de sobrevida livre de progressão (PFS) (tempo da randomização até a progressão da doença ou o óbito, mensurado na data da última avaliação tumoral), tempo para falha do tratamento (TTF) (tempo da randomização até progressão da doença, óbito, descontinuação do tratamento devido a um evento adverso, descontinuação do consentimento voluntário ou perda do acompanhamento) e taxa de benefício clínico (resposta completa, resposta parcial ou doença estável por > 24 semanas). As avaliações de sobrevida livre de progressão (PFS), taxa de resposta objetiva (ORR) e taxa de benefício clínico basearam-se na avaliação radiológica independente em regime cego da resposta tumoral utilizando critérios baseados no RECIST (Response Evaluation Criteria in Solid Tumors). O tempo para falha do tratamento (TTF) utilizou a avaliação de progressão feita pelo investigador. Os resultados de eficácia estão resumidos na Tabela 2.
Figura 1. Curvas de Kaplan–Meier para Sobrevida Global – Estudo pivotal:
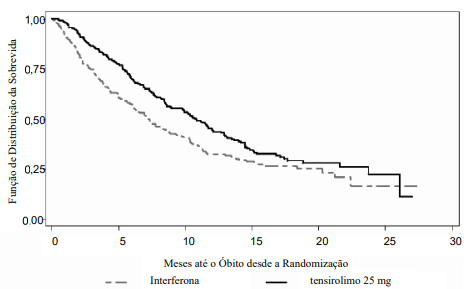
Tabela 2. Resumo dos Resultados de Eficácia do Tensirolimo Estudo Pivotal
| Parâmetro | Tensirolimo n = 209 | IFN-α n = 207 | Valor de Pa | Razão de Risco (IC de 95%)b |
| Mediana da Sobrevida Global Meses (IC de 95%) | 10,9 (8,6, 12,7) | 7,3 (6,1, 8,8) | 0,0078* | 0,73 (0,58, 0,92) |
| Mediana da Sobrevida Livre de Progressão Meses (IC de 95%) | 5,5 (3,9, 7,0) | 3,1 (2,2, 3,8) | 0,0001 | 0,66 (0,53, 0,81) |
| Taxa de Resposta Global % (IC de 95%) | 8,6 (4,8, 12,4) | 4,8 (1,9, 7,8) | 0,1232c | NA |
| Tempo Mediano para Falha de Tratamento Meses (IC de 95%) | 3,8 (3,5, 3,9) | 1,9 (1,7, 1,9) | <0,0001 | 0,61 (0,50, 0,74) |
| Taxa de Benefício Clínico % (IC de 95%) | 32,1 (25,7, 38,4) | 15,5 (10,5, 20,4) | <0,0001c | NA |
IC = intervalo de confiança; NA = não se aplica.
* Uma comparação é considerada estatisticamente significativa se o valor de p for < 0,0159 (Limite de O’BrienFleming em 446 óbitos).
a. Com base no teste de log-rank estratificado por nefrectomia anterior e região.
b. Com base no modelo de risco proporcional de Cox estratificado por nefrectomia anterior e região.
c. Com base no teste de Cochran-Mantel-Haenszel estratificado por nefrectomia anterior e região.
No Estudo pivotal, 31% dos pacientes tratados com tensirolimo tinham 65 anos ou mais. Em pacientes com menos de 65 anos, a mediana da sobrevida global foi de 12 meses (IC de 95% de 9,9 - 14,5) com taxa de risco de 0,62 (IC de 95% de 0,47 - 0,82) em comparação àqueles tratados com o IFN-α. Em pacientes com 65 anos ou mais, a sobrevida global mediana foi de 8,6 meses (IC de 95% de 6,4 - 11,5) com razão de risco de 1,08 (IC de 95% de 0,71 - 1,63) em comparação àqueles tratados com IFN-α.
Sobrevida Ajustada pela Qualidade
A sobrevida ajustada pela qualidade foi comparada entre os grupos de tratamento utilizando a abordagem QTWiST (quality-adjusted time without symptoms and toxicities). A sobrevida foi ponderada pelos pacientes por valor, com base na presença ou ausência de toxicidade ou progressão, ao preencher a escala EuroQoL 5D (EQ5D) na fase basal, Semanas 12 e 32, quando uma toxicidade de Grau 3 ou 4 foi relatada com recidiva ou progressão, ou retirada do estudo. O tensirolimo 25 mg está associado a aumento estatisticamente significativo da sobrevida ajustada pela qualidade de uma estimativa de 1,3 meses (7,0 vs. 5,7 meses, 23%) em comparação ao IFN-α.
Outro estudo foi randomizado, duplo-cego, multicêntrico e ambulatorial para avaliar a eficácia, a segurança e a farmacocinética de três níveis de dose do tensirolimo quando administrados a pacientes com carcinoma de células renais avançado tratados previamente. O endpoint primário de eficácia foi a taxa de resposta objetiva (ORR). A taxa de benefício clínico, a sobrevida livre de progressão (PFS) e a sobrevida global (OS) também foram avaliadas. A sobrevida livre de progressão (PFS) foi definida como o tempo desde a primeira dose do tensirolimo até progressão da doença ou óbito. Cento e onze (111) pacientes foram randomizados na proporção de 1:1:1 para receber 25 mg, 75 mg ou 250 mg de tensirolimo intravenoso semanalmente. No grupo 25 mg, todos os pacientes apresentavam doença metastática; 4 (11%) não haviam sido submetidos a quimioterapia ou imunoterapia prévia; 17 (47%) haviam sido submetidos a um tratamento prévio e 15 (42%) haviam sido submetidos a 2 ou mais tratamentos prévios para carcinoma de células renais. Vinte e sete (27,75%) haviam sido submetidos a uma nefrectomia. Vinte e quatro (24, 67%) apresentavam Índice de Performance (PF) de acordo com o Eastern Cooperative Oncology Group (ECOG) = 1 e 12 (33%) = 0.
Para os pacientes tratados semanalmente com 25 mg de tensirolimo intravenoso, a mediana de sobrevida global (OS) foi de 13,8 meses (IC de 95%: 9,0 - 18,7 meses); a mediana de sobrevida livre de progressão (PFS) foi de 6,3 meses (IC de 95%: 3,6 - 7,8 meses); a taxa de resposta objetiva (ORR) foi de 5,6% (IC de 95%: 0,7 - 18,7%) e a taxa de benefício clínico foi de 52,8% (IC de 95%: 35,5 - 69,6%).
Referências:
1. ZBROZEK. AS. et al. Q-TWiST analysis of patients receiving temsirolimus or interferon alpha for treatment of advanced renal cell carcinoma. Pharmacoeconomics., v. 28, n.7, p. 577-584, 2010.2. HUDES, G. et al. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. N Engl J Med., v. 356, n. 22, p. 2271- 2281, 2007.
3. ATKINS, M. B. et al. Randomized phase II study of multiple dose levels of CCI-779, a novel mammalian target of rapamycin kinase inhibitor, in patients with advanced refractory renal cell carcinoma. J Clin Oncol., v. 22, n. 5, p.909-918, 2004.
Características Farmacológicas
Propriedades Farmacodinâmicas
Classe farmacológica: O tensirolimo é um inibidor seletivo do mTOR.
Grupo farmacoterapêutico: agente anti-neoplásico.
Mecanismo de Ação
O tensirolimo é um inibidor seletivo do mTOR. O tensirolimo liga-se a uma proteína intracelular (FKBP-12) e o complexo proteína-medicamento liga-se ao mTOR inibindo a atividade de controle da divisão celular. In vitro, em altas concentrações (10 - 20 μM), o tensirolimo pode se ligar e inibir o mTOR na ausência da FKBP-12.
Observou-se uma resposta de dose bifásica de inibição de crescimento celular. Altas concentrações levaram à inibição total do crescimento celular in vitro, enquanto que a inibição mediada pelo complexo FKBP12/tensirolimo sozinho resultou numa diminuição de, aproximadamente, 50% na proliferação celular. A inibição da atividade do mTOR resulta na interrupção do crescimento na Fase G1 das células tumorais tratadas que leva ao bloqueio seletivo da tradução das proteínas reguladoras do ciclo celular, como as ciclinas do tipo D, c-myc, e a ornitina descarboxilase. Quando a atividade do mTOR é inibida, sua capacidade de fosforilar e, com isso, controlar a atividade dos fatores de tradução proteica (4E-BP1 e S6K, ambos após o mTOR na via da PI 3 quinase/AKT) que controla a divisão celular, é bloqueada.
Além de regular as proteínas do ciclo celular, o mTOR regula a tradução dos fatores induzidos por hipóxia, HIF1 e HIF-2 alfa. Esses fatores de transcrição regulam a capacidade dos tumores de se adaptar a microambientes hipóxicos e produzir o fator de crescimento endotelial vascular (VEGF). O efeito anti-tumoral do tensirolimo, portanto, também pode resultar, em parte, de sua capacidade de reduzir os níveis de HIF e VEGF no tumor ou microambiente tumoral, comprometendo com isso o desenvolvimento dos vasos.
Relação Efeito-Concentração
O efeito do tratamento com tensirolimo intravenoso sobre a inibição da fosforilação da proteína ribossômica S6 nos linfócitos circulantes foi avaliado em 30 indivíduos saudáveis. Os dados indicam que a inibição da fosforilação proteica foi rápida e dose dependente. Após uma dose única de 25 mg de tensirolimo foram observados 20% e 50% da inibição da proteína ribossômica S6 por no mínimo 8 dias e 3 dias, respectivamente.
Efeitos na Repolarização Cardíaca (Estudos QT/QTc)
Em um estudo randomizado, controlado por placebo e moxifloxacino em dois períodos, cruzado, seguido de um terceiro período, 58 voluntários sadios receberam uma dose única de 25 mg IV de tensirolimo. Nenhum efeito no intervalo QT/QTc relacionado com a concentração foi observado.
Propriedades Farmacocinéticas
Absorção
Após a administração de uma dose intravenosa única de 25 mg de tensirolimo em pacientes com câncer, a Cmáx média no sangue total foi de 585 ng/mL (coeficiente de variação, CV=14%) e a AUC média no sangue foi de 1.627 ng•h/mL (CV=26%). Para os pacientes que receberam 175 mg semanalmente por 3 semanas, seguido por 75 mg semanalmente, a Cmáx estimada no sangue total ao final da infusão foi de 2.457 ng/mL durante a Semana 1, e 2.574 ng/mL durante a Semana 3.
Distribuição
O tensirolimo apresenta uma queda poliexponencial da distribuição e das concentrações no sangue total, que é atribuída à ligação preferencial a FKBP-12 nas células sanguíneas. A constante de dissociação (Kd) média (desvio-padrão, DP) da ligação foi de 5,1 (3,0) ng/mL, que mostra a concentração em que 50% dos sítios de ligação nas células sanguíneas estavam ocupados. A distribuição do tensirolimo é dose-dependente com ligação específica máxima média (percentis 10 e 90) nas células sanguíneas de 1,4 mg (0,47 a 2,5 mg). Após uma dose intravenosa única de 25 mg, o volume de distribuição médio no estado de equilíbrio no sangue total dos pacientes com câncer foi de 172 litros.
Metabolismo
O citocromo P450 3A4 (CYP 3A4) é o principal citocromo isoforme predominantemente envolvido no metabolismo do tensirolimo no fígado humano, transformando-o em cinco metabólitos.
Observou-se que o sirolimo, um metabólito ativo do tensirolimo que apresenta a mesma potência, era o principal metabólito em humanos após o tratamento intravenoso. Nos estudos in vitro de metabolismo do tensirolimo, foram detectados sirolimo, seco-tensirolimo e seco-sirolimo; as outras vias metabólicas foram hidroxilação, redução e desmetilação. Após uma dose intravenosa única de 25 mg em pacientes com câncer, a AUC do sirolimo foi 2,7 vezes a do tensirolimo, devido principalmente à meia-vida mais prolongada do sirolimo.
Eliminação
Após uma dose intravenosa única de 25 mg de tensirolimo em pacientes com câncer, a depuração sistêmica (CV) média do sangue total do tensirolimo foi de 16,2 (22%) L/h. As meias-vidas médias do tensirolimo e do sirolimo foram de 17,3 horas e 54,6 horas, respectivamente. Após a administração do tensirolimo marcado com [14C], a excreção foi predominantemente pelas fezes (78%), sendo que a eliminação renal do medicamento e dos metabólitos representava 4,6% da dose administrada.
Farmacocinética Populacional
Idosos
Nas análises dos dados baseados na farmacocinética populacional, a idade não teve efeito significativo sobre a disposição do tensirolimo ou do metabólito sirolimo.
População pediátrica
Em pacientes pediátricos com tumores sólidos reincidentes/persistentes, o clearance do tensirolimo foi menor, e a exposição (AUC) foi maior do que nos adultos. Em contrapartida, a exposição ao sirolimo foi proporcionalmente reduzida em pacientes pediátricos, de forma que a exposição total mensurada pela soma das AUCs (AUCsum) de tensirolimo e sirolimo foi comparável a dos adultos.
Sexo
Nas análises dos dados baseados na farmacocinética populacional, o sexo não teve efeito significativo sobre a disposição do tensirolimo ou do metabólito sirolimo.
Peso Corpóreo
Nas análises dos dados baseados na farmacocinética populacional, alterações na concentração de corte do principal metabólito do tensirolimo, o sirolimo, em pacientes com aumento do peso corpóreo (peso corpóreo entre 38,6 e 158,9 kg) foram limitadas ao dobro daquela no sangue total (de 8,28 a 16,7 ng/mL).
Uso em Pacientes com insuficiência renal
A eliminação do tensirolimo pelos rins é baixa. Como as diferenças de depuração da creatinina não afetam a disposição do tensirolimo, não é necessário alterar o regime de tratamento com tensirolimo intravenoso nos pacientes com comprometimento renal
Uso em pacientes com insuficiência hepática ou comprometimento hepático
Usar com cautela no tratamento de pacientes com insuficiência hepática. A quantidade de tensirolimo aumentou em pacientes com aumento do nível de enzimas hepáticas (AST) e bilirrubina. É preciso avaliar os níveis de bilirrubina e AST antes do início de tensirolimo e no acompanhamento do tratamento.
O tensirolimo é contraindicado em pacientes com bilirrubina >1,5 x ULN.
Efeitos dos Alimentos
O efeito dos alimentos sobre a exposição após uma dose intravenosa do tensirolimo ainda não foi avaliado.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)