Qual a ação da substância do Strensiq?
Resultados de Eficácia
HPP de Início Perinatal/Infantil
O Estudo ENB-002-08/ ENB-003-08 foi um estudo clínico de 24 semanas de braço único prospectivo em 11 pacientes, 7/11 (64%) eram do sexo feminino e 10/11 (91%) eram caucasianos, com idade entre 3 semanas a 39,5 meses com HPP grave de início perinatal/infantil. HPP grave de início perinatal/infantil foi definida como bioquímica, histórico médico e evidências radiográficas de HPP, bem como a presença de qualquer das seguintes condições: deformidade raquítica torácica, convulsões dependentes de vitamina B6 ou insucesso no desenvolvimento. Dez dos 11 pacientes concluíram o estudo clínico de 24 semanas e continuaram o tratamento na fase de extensão. Nove pacientes foram tratados durante pelo menos 216 semanas (54 meses) e 4 pacientes foram tratados por mais de 240 semanas (60 meses). Os pacientes receberam Alfa-asfotase na dose de 3 mg/kg por semana durante o primeiro mês; subsequentemente, foram permitidos aumentos da dose até 9 mg/kg por semana para as variações de peso e/ou para que se tenha a resposta clínica esperada, conforme critério do médico.
Dez pacientes necessitaram de aumento da dose de até 6 mg/kg por semana ou superior; 9 pacientes tiveram a dose aumentada entre 4 e 24 semanas após o início do tratamento e 1 paciente teve a dose aumentada após 70 semanas devido à resposta clínica abaixo do ideal. A dose de um paciente foi diminuída de 9 mg/kg por semana para 6 mg/kg por semana, com base em dados de farmacocinética. O Estudo ENB-010-10 foi um estudo aberto prospectivo com 59 pacientes, 32/59 (54%) eram do sexo feminino e 46/59 (78%) eram causasianos, com idade entre 1 dia a 78 meses com HPP de início perinatal/infantil. Os pacientes receberam Alfa-asfotase na dose de 6 mg/kg por semana durante as primeiras 4 semanas.
Dez pacientes receberam aumentos da dose acima de 6 mg/kg por semana, devido à resposta clínica abaixo do ideal, com aumentos da dose que ocorreram entre 8 e 24 semanas após o início do tratamento. O regime de dosagem recomendado de Alfa-asfotase para o tratamento de HPP de início perinatal/infantil é de até 9 mg/kg por semana, administrados por via subcutânea assim como 3 mg/kg três vezes por semana. Quarenta e um pacientes foram tratados durante pelo menos 24 semanas (6 meses) e 15 pacientes foram tratados durante pelo menos 96 semanas (24 meses). Sobrevida e Sobrevida Sem Ventilação A sobrevida e sobrevida sem ventilação invasiva foram comparadas em pacientes tratados com Alfa-asfotase (Estudos ENB-002-08/ ENB-003-08, ENB-010-10) com uma coorte histórica de pacientes não tratados com características clínicas semelhantes (Tabela 1 e Figura 1).
Tabela 1: Sobrevida e Sobrevida Sem Ventilação Invasiva em Pacientes Tratados com Alfa-asfotase versus Pacientes de Controle Histórico com HPP de Início Perinatal/Infantil
| Tratados com Alfa-asfotase | Controles Históricos | |
Sobrevida | n = 68 | n = 48 |
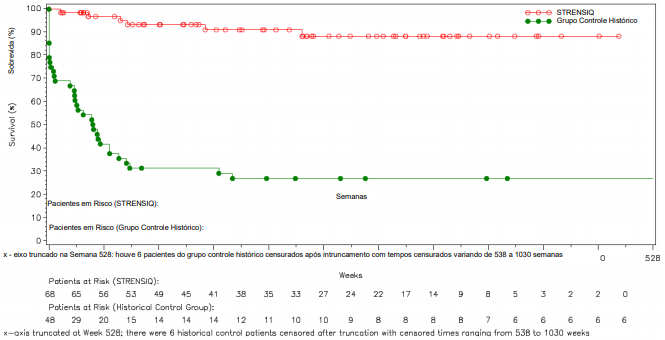
Vivos no Ponto de Último Contato (%) | 91 | 27 |
Razão de Risco (Alfa-asfotase/Controle Histórico), Intervalo de Confiança de 95%* | 0,14 | |
Estimativa de Kaplan-Meier e Vivos na Idade de 1 Ano (Semana 48) (%) | 97 | 42 |
Sobrevida Sem Ventilação Invasiva** | n = 54 | n = 48 |
Vivos e Sem Ventilação no Ponto de Último Contato (%) | 85 | 25 |
Razão de Risco (Alfa-asfotase/Controle Histórico), Intervalo de Confiança de 95%* | 0,21 | |
Estimativa de Kaplan-Meier e Vivos na Idade de 1 Ano (Semana 48) (%) | 96 | 31 |
* Ajustado para o ano de diagnóstico.
** Pacientes vivos e não iniciados em ventilação invasiva após o início do tratamento com Alfa-asfotase em ventilação invasiva no período basal foram excluídos desta análise.
Em pacientes que necessitaram de qualquer forma de suporte respiratório, 21 de 26 (81%) dos pacientes tratados sobreviveram até de sua última avaliação (média de idade na última avaliação foi de 3,2 anos de idade), versus 1 de 20 (5%) dos controles históricos.
Figura 1: Sobrevida Global em Pacientes Tratados com Alfa-asfotase versus Controles Históricos com HPP de Início Perinatal/Infantil
Controle Histórico de Sobrevida Global e Dados de Sobrevida Livre de Ventilação Invasiva extraídos do estudo ENB-011-10 (pacientes agrupados dos estudos ENB-002-08 / EN-003-08 e ENB -010-10 que preencheram os critérios de inclusão do estudo ENB-011- 10).
Fonte: Bula aprovada pelo FDA.
Manifestações Esqueléticas
Radiografias de 68 pacientes com HPP de início perinatal/infantil tratados com Alfa-asfotase, incluindo 64 pacientes nos Estudos ENB-002-08/ ENB-003-08 e ENB-010-10, e 4 pacientes no Estudo ENB-006-09/ENB-008-10c, foram examinadas para avaliar o raquitismo relacionado com a HPP usando a escala de Alteração da Impressão Radiográfica (RGI-C) de 7 pontos. Os pacientes com pontuação RGI-C mínima de + 2 foram definidos como "respondedores". Melhoras radiológicas puderam ser observadas no Mês 24; na última avaliação, 50/68 [74%] pacientes tratados foram classificados como respondedores RGI-C. Não há dados comparativos disponíveis a partir dos controles históricos. O intervalo de tempo médio entre o período basal e a última avaliação de RGI-C foi de 24 meses (variação foi de 1 mês a 67 meses). Dezoito pacientes com HPP de início perinatal/infantil apresentaram fraturas durante o curso do tratamento. Os dados para determinar o efeito de Alfa-asfotase foram insuficientes em fraturas.
Crescimento
Medições de altura e peso (medidas por pontuações z) estavam disponíveis pós-tratamento para 72 pacientes com HPP de início perinatal/infantil, incluindo 68 pacientes incluídos nos Estudos ENB-002-08/ ENB-003-08 e ENB-010-10, e 4 pacientes incluídos no Estudo ENB-006- 09/ENB-008-10c (Tabela 2).
Tabela 2: Medições de Peso e Altura de Início Perinatal/Infantil Conforme Medido Pela Pontuação Z
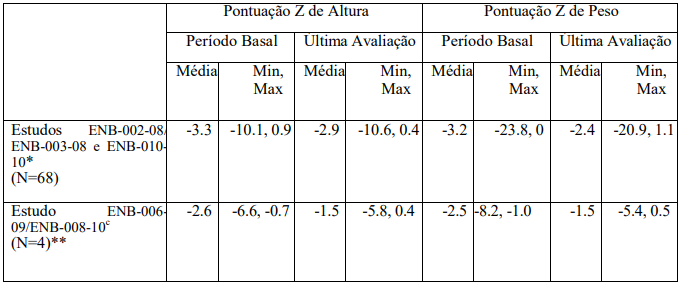
*O intervalo de tempo médio entre o período basal e a última avaliação foi de 21 meses (variação foi de 1 mês e 72 meses).
** O tempo médio entre o período basal e última avaliação foi de 56 meses (variação foi de 53 meses a 60 meses).
HPP de Início Juvenil
O Estudo ENB-006-09/ENB-008-10c foi um estudo clínico prospectivo aberto de 24 semanas que incluiu 8 pacientes com HPP de início juvenil e 5 pacientes com HPP de início perinatal/infantil, 11/13 (85%) eram do sexo masculino e 12/13 (92%) eram caucasianos; na entrada, os pacientes tinham de 6 a 12 anos de idade. Todos os 8 pacientes de início juvenil entraram no estudo de extensão e foram tratados durante pelo menos 48 meses. No início do estudo, os pacientes foram randomizados para receber Alfa-asfotase na dose de a 6 mg/kg por semana ou 9 mg/kg por semana. Dois pacientes receberam reduções da dose durante o período de tratamento primário, incluindo um paciente que apresentou uma diminuição nos níveis de vitamina B6 e um paciente que apresentou reações recorrentes no local da injeção. Durante a fase de extensão, o regime de dose para todos os pacientes foi inicialmente alterado para 3 mg/kg por semana.
A dosagem foi subsequentemente aumentada para 6 mg/kg por semana, nenhum paciente necessitou de doses maiores que 6 mg/kg por semana. O regime de dose recomendado de Alfa-asfotase para o tratamento de HPP de início juvenil é de 6 mg/kg por semana.
Crescimento
Medições de peso e altura (medidas por pontuações z) nos 8 pacientes tratados com Alfa-asfotase foram comparadas com uma coorte histórica de 32 pacientes não tratados com características clínicas semelhantes (Tabela 3). Dados de altura e peso para pacientes históricos foram coletados de registros médicos.
Tabela 3: Medições de Peso e Altura em Início Juvenil Medidas por Pontuação Z
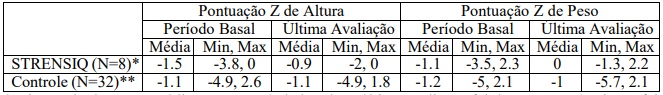
*O intervalo de tempo médio entre o período basal e a última avaliação foi de 55 meses (variação foi de 53 mês a 60 meses).
** O tempo médio entre o período basal e última avaliação foi de 61 meses (variação foi de 19 meses a 109 meses).
Manifestações Esqueléticas
Radiografias de 8 pacientes tratados com Alfa-asfotase e 32 controles históricos foram comparadas para avaliar o raquitismo relacionado com a HPP usando a escala RGI-C (Impressão de Alteração Radiográfica Global) de 7 pontos. Os pacientes que obtiveram uma pontuação RGI-C de 2 ou superior (correspondente à cura substancial do raquitismo) foram classificados como sendo respondedores ao tratamento. Todos os 8 pacientes tratados foram classificados como respondedores no Mês 54 do tratamento. O tempo médio entre o período basal e últimas avaliações de RGI-C para pacientes do grupo controle foi de 56 meses (variação foi de 8 a 95 meses). Na última avaliação, 2/32 (6%) dos pacientes do grupo controle foram classificados como respondedores. Oito dos 20 (40%) pacientes com HPP de início juvenil que apresentaram novas fraturas durante o curso do tratamento. Houve dados insuficientes para avaliar o efeito de Alfa-asfotase em fraturas.
Marcha / Mobilidade
A marcha foi avaliada usando uma Avaliação de Desempenho da Mobilidade OrientadaMarcha modificada (escala MPOMA-G) em 8 pacientes tratados com Alfa-asfotase em intervalos de 6 meses até 36 meses. A mobilidade também foi avaliada usando o Teste de Caminhada de 6 Minutos (6MWT) em 7 dos 8 pacientes. O comprimento do passo melhorou em pelo menos 1 ponto em cada pé em 6/8 pacientes em comparação com 1/6 (17%) pacientes controle. A proporção de pacientes que apresentaram valores percentuais de 6MWT previstos dentro da faixa normal para a idade, sexo e pares combinados de altura aumentou de 0/8 pacientes no período basal para 6/6 pacientes (100%) no Mês 48 e todos os 6 também foram capazes de caminhar longas distâncias neste ponto de tempo em relação ao período basal.
Características Farmacológicas
Alfa-asfotase é uma formulação de alfa-asfotase, que é uma glicoproteína solúvel composta por duas cadeias polipeptídicas idênticas. Cada cadeia contém 726 aminoácidos com uma massa teórica de 161 kDa. Cada cadeia é constituída pelo domínio catalítico de Fosfatase Alcalina de Tecido Humano Não Específico (TNSALP), o domínio de imunoglobulina humana G1 Fc e um peptídeo deca-aspartato usado como um domínio de direcionamento. As duas cadeias polipeptídicas estão covalentemente ligados por duas ligações dissulfeto.
Alfa-asfotase é uma fosfatase alcalina não específica de tecido produzida por tecnologia de DNA recombinante em uma linhagem celular de ovário de hamster chinês. TNSALP é uma metalo-enzima que catalisa a hidrólise de fosfomonoésteres com a liberação de fosfato inorgânico e álcool. A alfa-asfotase tem uma atividade específica de 620 a 1250 unidades/mg. Uma unidade de atividade é definida como a quantidade de alfa asfotase necessária para formar 1 μmol de p-nitrofenol a partir de pNPP por minuto a 37°C.
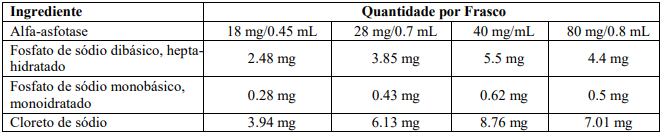
Alfa-asfotase é uma solução aquosa estéril, sem conservantes, não pirogênica, límpida, ligeiramente opalescente ou opalescente, incolor a ligeiramente amarelada, com algumas pequenas partículas translúcidas ou brancas, para administração subcutânea. Alfa-asfotase é apresentado em frascos de vidro de uso único contendo alfaasfotase; fosfato de sódio dibásico hepta-hidratado; fosfato de sódio monobásico, monoidratado; e cloreto de sódio à um pH entre 7,2 e 7,6. A Tabela 4 descreve o conteúdo das apresentações dos frascos de Alfa-asfotase.
Tabela 4: Conteúdo das Apresentações dos Frascos de Alfa-asfotase
Mecanismo de Ação
A HPP é causada por uma deficiência na atividade da enzima TNSALP (Fosfatase Alcalina de Tecido Humano Não Específico), o que resulta em elevações em vários substratos da TNSALP, incluindo pirofosfato inorgânico (PPi). Níveis extracelulares elevados de PPi bloqueiam o crescimento de cristais de hidroxiapatita que inibem a mineralização óssea e provocam uma acumulação de matriz óssea não mineralizada, que se manifesta como raquitismo e deformação óssea em bebês e crianças e como osteomalácia (amolecimento dos ossos), uma vez que as placas de crescimento se fecham, juntamente com fraqueza muscular. A reposição da enzima TNSALP após tratamento com Alfa-asfotase reduz os níveis de substrato da enzima.
Farmacodinâmica
Pacientes com HPP de início Perinatal/infantil e juvenil tratados com Alfa-asfotase tiveram reduções em substratos TNSALP (Fosfatase Alcalina de Tecido Humano Não Específico) plasmáticos, PPi e piridoxal 5'-fosfato (PLP) dentro de 6 a 12 semanas de tratamento. Reduções nos níveis plasmáticos de PPi e PLP não se correlacionam com os resultados clínicos. Dados de biópsia óssea de pacientes com HPP de início perinatal/infantil e de início juvenil tratados com Alfa-asfotase demonstraram reduções no volume de osteoide e espessura indicando uma melhor mineralização óssea.
Farmacocinética
Com base em dados de 38 pacientes com HPP, a farmacocinética da alfa-asfotase apresenta proporcionalidade à dose ao longo do intervalo de dose de 0,3 mg/kg a 3 mg/kg e parece ser independente do tempo. A exposição no estado de equilíbrio foi alcançada tão cedo quanto três semanas após a administração da primeira dose. A meia-vida de eliminação, após administração subcutânea foi de aproximadamente 5 dias. A Tabela 5 resume os parâmetros farmacocinéticos após administração de múltiplas doses em 20 pacientes com HPP após a administração subcutânea de Alfa-asfotase na dose de 2 mg/kg, três vezes por semana no Estudo 2 (média de idade menor ou igual a 5 anos) e Estudo 3 (idade superior a 5 até 12 anos), indicando que a farmacocinética foi semelhante entre os pacientes nas duas faixas etárias.
Tabela 5: Resumo dos Parâmetros Farmacocinéticos Após Múltiplas Administrações Subcutâneas de Alfa-asfotase em doses de 2 mg/kg três vezes por semana
| Estudo 2 | Estudo 3 | |
N | 14 | 6 |
Idade (anos) | 3.4 ± 2.1 (0.2, 6.2) | 8.6 ± 2.2 |
Peso no período basal (kg) | 11.2 ± 5.0 (2.9, 17.1) | 21.2 ± 7.9 |
t last (h) | 48.1 ± 0.1 (47.9, 48.3) | 48.0 ± 0.1 |
tmax (h) | 14.9 ± 10.4 (0, 32.2) | 20.8 ± 10.0 |
Cmax (ng/mL) | 1794 ± 690 (856, 3510) | 2108 ± 788 |
AUCt (h*ng/mL) | 66042 ± 25758 (27770, 119122) | 89877 ± 33248 |
Razão Acumuladaa | 1.5 | 3.9 |
a Os valores da razão refletem o aumento de vezes da AUCt a partir da Semana 1 com base nos valores médios de AUCt.
Os dados são apresentados como média ± desvio padrão (faixa). O Estudo 3 inclui pacientes com doença de início perinatal/infantil ou juvenil. tlast, tempo para a última concentração; Tmax, tempo para a concentração máxima; Cmax, concentração máxima; AUCt, área sob as curvas de concentração versus tempo durante um intervalo de dosagem de 48 horas.
A análise da farmacocinética populacional das concentrações de alfa-asfotase corrobora a dosagem baseada no peso porque o peso corporal é uma importante covariável de depuração da alfa-asfotase. A concentração da formulação teve um impacto sobre a exposição sistêmica da alfa-asfotase em pacientes com HPP. A formulação de concentração mais elevada (frasco de 80 mg/0,8 mL) alcançou uma exposição sistêmica de aproximadamente 25% inferior de alfa-asfotase (isto é, concentrações e AUC), em comparação com as formulações de concentração inferior (frascos de 18 mg/0,45 ml, 28 mg/0,7 mL ou 40 mg/mL) na mesma dose de Alfa-asfotase.
A formação de anticorpos anti-droga resultou em exposição sistêmica reduzida de alfaasfotase.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)