Qual a ação da substância do Pegasys?
Resultados de Eficácia
Hepatite B
Os estudos clínicos demonstraram que a monoterapia com Alfapeginterferona 2a é efetiva no tratamento de pacientes com hepatite crônica B, tanto em pacientes HBeAg-positivo como em pacientes que são HBeAg-negativo e anti- HBe-positivo.
Estudos clínicos confirmatórios: todos os estudos clínicos recrutaram pacientes com hepatite crônica B que apresentavam replicação viral ativa confirmada por altas concentrações de HBV-DNA, elevação da enzima ALT e atividade histológica na biópsia hepática compatível com hepatite crônica. O estudo WV16240 recrutou pacientes HBeAg positivo enquanto que o estudo WV16241 recrutou pacientes HBeAg negativo e anti-HBe positivo. Nos dois estudos, a duração do tratamento foi de 48 semanas, com 24 semanas de acompanhamento sem tratamento. Os dois estudos compararam Alfapeginterferona 2a mais placebo versus Alfapeginterferona 2a mais lamivudina versus lamivudina isolada. Nenhum paciente coinfectado com HBV ou HIV foi incluído nesses estudos clínicos.
As taxas de resposta no final do acompanhamento para os dois estudos estão apresentadas na Tabela 1. O HBV-DNA foi medido por meio do ensaio HBV COBAS AMPLICOR MONITOR (limite de detecção de 200 cópias/mL).
Tabela 1 - Respostas sorológicas, virológicas e bioquímicas na hepatite crônica B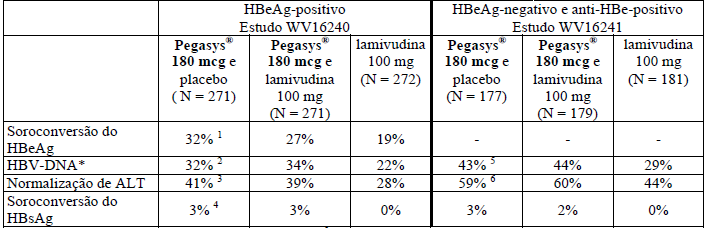
* Para pacientes HBeAg-positivo: HBV-DNA < 105 cópias/mL Para pacientes HBeAg-negativo e anti-HBe-positivo: HBV-DNA < 2 x 104 cópias/Ml.
1Odds Ratio (IC95%) versus lamivudina = 2,00 (1,34-2,97), valor p (teste estratificado de Cochran-Mantel-Haenszel) < 0,001.
2 Odds Ratio (IC95%) versus lamivudina = 1,64 (1,12-2,42), valor p (teste estratificado de Cochran-Mantel-Haenszel) = 0,012.
3 Odds Ratio (IC95%) versus lamivudina = 1,77 (1,23-2,54), valor p (teste estratificado de Cochran-Mantel-Haenszel) = 0,002.
4 Odds Ratio não definido, valor p (teste estratificado de Cochran-Mantel-Haenszel) = 0,004.
5 Odds Ratio (IC95%) versus lamivudina = 1,84 (1,17-2,89), valor p (teste estratificado de Cochran-Mantel-Haenszel) = 0,007.
6 Odds Ratio (IC95%) versus lamivudina = 1,86 (1,22-2,85), valor p (teste estratificado de Cochran-Mantel-Haenszel) = 0,004.
Hepatite C
Estudos clínicos demonstraram que Alfapeginterferona 2a isolado ou em combinação com ribavirina é efetivo no tratamento de pacientes com hepatite crônica C, incluindo pacientes cirróticos com doença hepática 2, 3, 4 compensada, bem como no tratamento de pacientes co-infectados HCV-HIV.
Estudos clínicos confirmatórios em pacientes sem tratamento prévio: os estudos clínicos inicialmente recrutaram pacientes sem tratamento prévio com alfainterferona com hepatite crônica C, confirmada pela detecção do HCV-RNA, níveis elevados de ALT e biópsia hepática compatível com hepatite crônica. O estudo NV15495 recrutou especificamente pacientes com diagnóstico histológico de cirrose (cerca de 80%) ou transição para cirrose (cerca de 20%).
Consulte as Tabelas 2 e 3 para observar os regimes de tratamento, a duração da terapia e o resultado dos estudos. A resposta virológica foi definida como HCV-RNA indetectável, medido pelo Teste HCV COBAS AMPLICOR versão 2.0 (limite de detecção de 100 cópias/mL, equivalente a 50 unidades internacionais/mL), e a resposta sustentada como uma amostra negativa aproximadamente 6 meses após o final da terapia.
Tabela 2- Resposta virológica em hepatite crônica C após tratamento durante 48 semanas
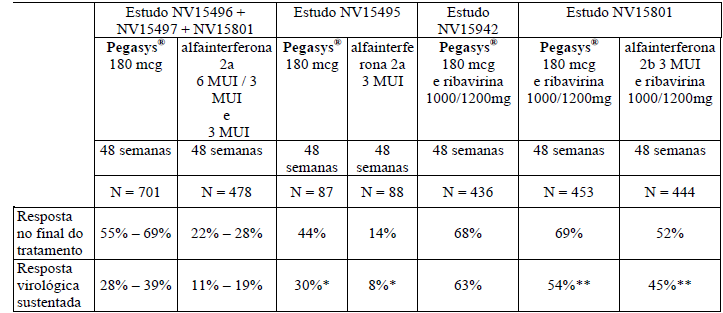
* IC de 95% quanto à diferença: 11% a 33% valor p (teste estratificado de Cochran-Mantel-Haenszel) = 0,001.
** IC de 95% quanto à diferença: 3% a 16% valor p (teste estratificado de Cochran-Mantel-Haenszel) = 0,003.
A Tabela 3 resume as respostas virológicas dos pacientes tratados com terapia combinada Alfapeginterferona 2a e ribavirina com base no genótipo e carga viral. Os resultados do estudo NV15942 fornecem fundamento para a recomendação do esquema de tratamento com base no genótipo6 (ver Tabela 3).
A diferença entre os regimes de tratamento não foi, em geral, influenciada pela carga viral ou presença ou ausência de cirrose. Portanto, as recomendações de tratamento para genótipos 1, 2 ou 3 são independentes dessas características no período basal.
Tabela 3 – Resposta virológica sustentada em pacientes com hepatite crônica C baseada no genótipo e carga viral após terapia combinada com Alfapeginterferona 2a e ribavirina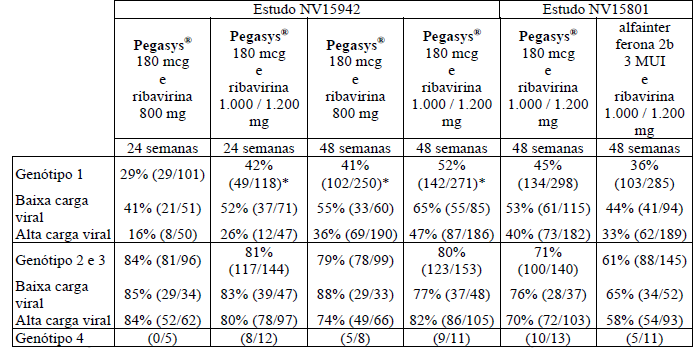
* Alfapeginterferona 2a 180 mcg e ribavirina 1.000 / 1.200 mg por 48 semanas versus Alfapeginterferona 2a 180 mcg e ribavirina 800 mg durante 48 semanas: Odds Ratio (IC95%) = 1,52 (1,07 a 2,17) valor p (teste estratificado de Cochran-Mantel-Haenszel) = 0,020.
* Alfapeginterferona 2a 180 mcg e ribavirina 1.000 / 1.200 mg por 48 semanas versus Alfapeginterferona 2a 180 mcg e ribavirina 1000/1200 mg durante 24 semanas Odds Ratio (IC95%) = 2,12 (1,30 a 3,46) valor p (teste estratificado de Cochran-Mantel-Haenszel) = 0,002.
Também foi demonstrada eficácia superior de Alfapeginterferona 2a em comparação com a alfainterferona 2a em termos de resposta histológica, incluindo pacientes com cirrose, e em pacientes coinfectados HCV-HIV.
A possibilidade de considerar redução na duração do tratamento para 24 semanas em pacientes com genótipos 1 e 4 foi baseada na análise das taxas de resposta virológica sustentada observadas em pacientes com resposta virológica na quarta semana do tratamento (resposta virológica rápida – RVR) no estudo NV 15942 (veja Tabela 4).
Tabela 4 – Resposta virológica sustentada baseada na resposta virológica rápida (RVR) para genótipo 1 e 4, após terapia combinada Alfapeginterferona 2a com ribavirina em pacientes HCV
| Estudo NV 15942 | ||
| Alfapeginterferona 2a 180 mcg e ribavirina 1.000 / 1.200 mg 24 semanas | Alfapeginterferona 2a 180 mcg e ribavirina 1.000 / 1.200 mg 48 semanas | |
Genótipo 1 com RVR | 90% (28/31) 93% (25/27) 75% (3/4) | 92% (47/51) |
Genótipo 1 sem RVR | 24% (21/87) 27% (12/44) 21% (9/43) | 43% (95/220) |
Genótipo 4 com RVR | (5/6) | (5/5) |
Genótipo 4 sem RVR | (3/6) | (4/6) |
Carga viral baixa = ≤ 800.000 UI/mL; Carga viral alta = > 800.000 UI/mL.
*RVR = resposta virológica rápida (HCV RNA indetectável) na quarta semana e HCV RNA indetectável na 24ª semana do tratamento.
A possibilidade de considerar redução na duração do tratamento para 16 semanas em pacientes com genótipos 2 ou 3 foi estudada com base na rápida resposta virológica sustentada observada em pacientes com resposta virológica na quarta semana do tratamento (resposta virológica rápida – RVR) no estudo NV17317 (vide Tabela 5).
No estudo NV17317, realizado com pacientes infectados pelo genótipo viral 2 ou 3, todos os pacientes receberam Alfapeginterferona 2a 180 mcg subcutâneo uma vez por semana e uma dose de ribavirina de 800 mg/dia e foram selecionados para receber um tratamento durante 16 ou 24 semanas. O tratamento durante 16 semanas resultou em resposta virológica sustentada mais baixa (65%) que o tratamento durante 24 semanas (76%). No entanto, análises mais detalhadas dos pacientes que eram HCV RNA negativo na semana 4 e com CVB no período basal demonstraram que a resposta virológica sustentada avaliada com 16 semanas de tratamento foi comparável àquela observada após 24 semanas de tratamento (89% e 94%, respectivamente) (vide Tabela 5).
Tabela 5 – Resposta virológica sustentada baseada na resposta virológica rápida na semana 4 para genótipos 2 e 3, após terapia combinada Alfapeginterferona 2a com ribavirina, em pacientes HCV
| Estudo NV 17317 | ||
| Alfapeginterferona 2a 180 mcg e ribavirina 800 mg 16 semanas | Alfapeginterferona 2a 180 mcg |
Genótipo 2 ou 3 | 65% (443/679) | 76% (478/630) |
Genótipo 2 ou 3 com RVR | 82% (378/461) 89% (147/166) 78% (231/295) | 90% (370/410) |
Genótipo 2 ou 3 sem RVR | 30% (65/218) 44% (22/50) 26% (43/168) | 49% (108/220) |
Genótipo 2 ou 3 sem RVR | 30% (65/218) 44% (22/50) 26% (43/168) | 49% (108/220) |
Carga viral baixa = ≤ 800.000 UI/mL no período basal; carga viral alta = > 800.000 UI/mL no período basal.
RVR = resposta virológica rápida (HCV RNA negativo) na quarta semana de tratamento.
Hepatite crônica C em pacientes não-respondedores ao tratamento prévio
No estudo MV17150, pacientes que foram não-respondedores ao tratamento prévio com a alfapeginterferona 2b mais ribavirina foram selecionados aleatoriamente em quatro grupos de tratamento diferentes:
Alfapeginterferona 2a 360 mcg/semana durante 12 semanas, seguido por 180 mcg/semana por mais 60 semanas; Alfapeginterferona 2a 360 mcg/semana durante 12 semanas, seguido por 180 mcg/semana por mais 36 semanas; Alfapeginterferona 2a 180 mcg/semana durante 72 semanas; ou Alfapeginterferona 2a 180 mcg/semana por 48 semanas.
Todos pacientes receberam ribavirina (1.000 ou 1.200 mg/dia) em combinação com Alfapeginterferona 2a. Todos os braços tiveram 24 semanas de acompanhamento sem tratamento. As respostas virológicas sustentadas de uma análise agrupada comparando a duração de terapia ou dose de indução de Alfapeginterferona 2a são resumidas na Tabela 6.
Tabela 6 – Resposta virológica sustentada em não-respondedores prévios a alfapeginterferona 2b/ ribavirina: comparação do tratamento agrupado
*95% de intervalo de confiança (IC) de 1,40 a 3,52 e um valor p de 0,00061.
A taxa da resposta virológica sustentada após 72 semanas de tratamento foi superior à do tratamento durante 48 semanas.
As diferenças na resposta virológica sustentada baseadas na duração do tratamento e nos dados demográficos do estudo MV17150 são exibidos na Tabela 7.
Tabela 7 – Resposta virológica sustentada após tratamento com terapia combinada de Alfapeginterferona 2a e ribavirina em não-respondedores ao tratamento prévio com alfapeginterferona 2b / ribavirina
| Retratamento por 48 semanas % (N) | Retratamento por 72 semanas | |
Não-respondedores (geral) | 8% (38/469) | 16% (74/473) |
Genótipo 1/4 | 7 % (33/450) | 15% (68/457) |
Genótipo 2/3 | 25% (4/16) | 33% (5/15) |
Genótipo | ||
1 | 7% (31/426) | 14% (60/430) |
| 2 | 0 (0/4) | 33% (1/3) |
| 3 | 33% (4/12) | 33% (4/12) |
| 4 | 8% (2/24) | 30% (8/27) |
Carga viral basal | ||
CVA maior que 800.000 | 7% (25/363) | 12% (46/372) |
CVB menor ou igual a | 13% (11/84) | 31% (27/86) |
No estudo HALT-C pacientes com hepatite crônica C e fibrose avançada ou cirrose que não tinham respondido anteriormente ao tratamento com alfainterferona ou alfapeginterferona em monoterapia ou em terapia combinada com ribavirina foram tratados com Alfapeginterferona 2a 180 mcg/semana e ribavirina 1000/1200 mg diariamente. Pacientes que atingiram níveis indetectáveis de HCV RNA após 20 semanas de tratamento com a terapia combinada de Alfapeginterferona 2a mais ribavirina continuaram o tratamento até 48 semanas e foram então acompanhados por 24 semanas após o final do tratamento. A resposta virológica sustentada variou dependendo do regime de tratamento prévio, ou seja, a taxa de resposta ao retratamento foi mais baixa entre pacientes não respondedores à alfapeginterferona em combinação com ribavirina, identificando maior dificuldade para tratar essa subpopulação de pacientes não-respondedores, cujas taxas de resposta foram comparáveis com a taxa de resposta virológica sustentada observada no braço de 48 semanas de tratamento do estudo MV17150.
Apesar da resposta virológica sustentada ter sido maior em não-respondedores à interferona ou a peginterferona em monoterapia, a eficácia nesses casos menos difíceis para o tratamento de não-respondedores é substancialmente menor que o alcançável em pacientes sem tratamento prévio (vide Tabela 8).
Tabela 8 – Taxa de RVS por duração do tratamento e população não respondedora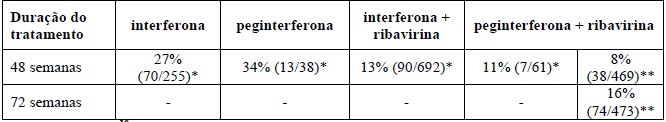
*Dados de HALT-C.10.
**Dados de MV17150.9.
Hepatite crônica C em pacientes com recidiva ao tratamento prévio
Em um estudo de pacientes com hepatite crônica C predominantemente genótipo 1, recidivantes após 48 semanas do tratamento combinado com alfapeginterferona mais ribavirina e que foram retratados por 72 semanas com a combinação de Alfapeginterferona 2a 180 mcg/semana mais ribavirina diária com base no peso ou interferona de consenso (9 mcg) por dia mais ribavirina diária com base no peso, a resposta virológica sustentada foi 42% no grupo de pacientes tratados com Alfapeginterferona 2a mais ribavirina por 72 semanas.
Em outro estudo aberto, pacientes com hepatite crônica C genótipo 2 e 3 que recidivaram após tratamento por 24 semanas com Alfapeginterferona 2a e ribavirina foram retratados com Alfapeginterferona 2a 180 mcg/semana e ribavirina 1000 ou 1200 mg (diária e por peso) por 48 semanas e apresentaram taxa de resposta virológica sustentada de 64%.
Coinfecção HCV-HIV
No estudo NR 15961, 860 pacientes coinfectados HCV-HIV foram randomizados e tratados com Alfapeginterferona 2a 180 mcg/semana e placebo, Alfapeginterferona 2a 180 mcg/semana e ribavirina 800 mg/dia ou alfainterferona 2a 3 MUI três vezes por semana e ribavirina 800 mg/dia por 48 semanas seguidos por um acompanhamento de 24 semanas sem tratamento. As respostas virológicas sustentadas para os três grupos de tratamento estão resumidas por pacientes e por genótipo na Tabela 9.
Tabela 9 – Resposta virológica sustentada em pacientes coinfectados com HCV-HIV (48 semanas)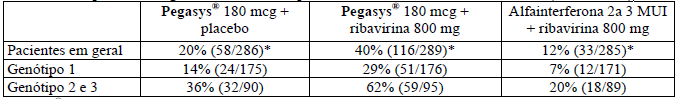
*Alfapeginterferona 2a [alfapeginterferona 2a (40 KD)] 180 mcg mais ribavirina 800 mg versus alfainterferona 2a 3 MUI mais ribavirina 800 mg: IC95% para a diferença: 22% a 35%, valor p (teste estratificado de Cochran-Mantel- Haenszel) £ 0,0001.
*Alfapeginterferona 2a [alfapeginterferona 2a (40 KD)] 180 mcg mais ribavirina 800 mg versus Alfapeginterferona 2a [alfapeginterferona 2a (40 KD)] 180 mcg: IC95% para a diferença: 13% a 27%, valor p (teste estratificado de Cochran-Mantel-Haenszel) £ 0,0001.
Características Farmacológicas
Propriedades farmacodinâmicas
A conjugação do reagente PEG (bis-monometoxipolietilenoglicol) com alfainterferona 2a forma a alfapeginterferona 2a. A alfainterferona 2a é produzida biossinteticamente usando-se a tecnologia de DNA recombinante sendo produto de um gene de interferon leucocitário humano clonado inserido e expresso em Escherichia coli. A estrutura da porção PEG afeta diretamente a farmacologia clínica de Alfapeginterferona 2a.
Especificamente, o tamanho e a ramificação da porção PEG de 40 KD definem as características de absorção, distribuição e eliminação de Alfapeginterferona 2a. Favor consultar as informações de bula de ribavirina para as propriedades farmacodinâmicas da ribavirina.
Mecanismo de ação
Alfapeginterferona 2a possui atividades antivirais e antiproliferativas in vitro da alfainterferona 2a. A interferona se conjuga aos receptores específicos na superfície da célula, iniciando um caminho complexo de sinalização intracelular e rápida iniciação da transcrição gênica. Os genes estimulados pela interferona modulam vários efeitos biológicos, incluindo a inibição da replicação viral em células infectadas, inibição da proliferação celular e imunomodulação.
Os níveis de HCV RNA declinam de maneira bifásica em pacientes respondedores com hepatite C que receberam Alfapeginterferona 2a. A primeira fase do declínio ocorre dentro de 24 a 36 horas após a primeira dose de Alfapeginterferona 2a e a segunda fase do declínio ocorre durante as próximas 4 a 16 semanas em pacientes que alcançam a resposta sustentada. Alfapeginterferona 2a na dose de 180 mcg por semana intensifica o processo de eliminação do vírus e melhora as respostas virológicas no final de tratamento, em comparação ao tratamento com alfainterferonas convencionais.
Alfapeginterferona 2a estimula a produção de proteínas efetoras como a neopterina sérica e 2’5’-oligoadenilato sintetase de maneira dose-dependente. A estimulação da 2’5’-oligoadenilato sintetase é máxima após doses únicas de 135 mcg até 180 mcg de Alfapeginterferona 2a e permanece sendo máxima durante o intervalo de dose de uma semana. A magnitude e a duração da atividade da 2’5’-oligoadenilato sintetase induzida por Alfapeginterferona 2a foi reduzida em indivíduos com mais de 62 anos de idade e em indivíduos com insuficiência renal significativa (depuração da creatinina de 20 a 40 mL/min). A relevância clínica desses resultados é desconhecida.
Propriedades farmacocinéticas
A farmacocinética de Alfapeginterferona 2a foi estudada em voluntários saudáveis e em pacientes infectados com o vírus da hepatite C. Os resultados em pacientes com hepatite crônica B foram semelhantes aos dos pacientes com hepatite crônica C.
Absorção
A absorção de Alfapeginterferona 2a é sustentada com picos de concentração sérica atingidos 72 a 96 horas após sua aplicação subcutânea. As concentrações séricas são mensuráveis dentro de 3 a 6 horas após uma única injeção subcutânea de Alfapeginterferona 2a 180 mcg. Dentro de 24 horas, cerca de 80% do pico de concentração sérica é atingido.
A biodisponibilidade absoluta de Alfapeginterferona 2a é de 84% e é semelhante à observada com a alfainterferona 2a.
A exposição a Alfapeginterferona 2a foi reduzida nos estudos que avaliaram a administração de Alfapeginterferona 2a no braço em comparação com a administração no abdome e na coxa.
Distribuição
Alfapeginterferona 2a é encontrado predominantemente na corrente sanguínea e no fluido extracelular, tal como visto pelo volume de distribuição em estado de equilíbrio dinâmico (VSS) de 6 a 14 litros após dose intravenosa em seres humanos. Com base nos estudos em ratos, o fármaco é distribuído para fígado, rins e medula óssea, assim como em altas concentrações para o sangue.
Metabolismo
O metabolismo constitui o principal mecanismo de depuração de Alfapeginterferona 2a. O perfil metabólico de Alfapeginterferona 2a não está totalmente caracterizado. Em seres humanos, a depuração sistêmica de Alfapeginterferona 2a é cerca de 100 mL/h, que é 100 vezes mais baixa que a depuração da alfainterferona 2a convencional.
Estudos em ratos indicam que os metabólitos de Alfapeginterferona 2a são excretados na urina e, em menor grau, na bile. Os rins eliminam menos de 10% da dose como alfapeginterferona 2a (40KD) inalterada. Embora a porção PEG permaneça acoplada à alfainterferona 2a, tanto o PEG quanto a alfainterferona 2a são metabolizados.
Eliminação
Após a administração intravenosa, a meia-vida de Alfapeginterferona 2a em indivíduos sadios é de aproximadamente 60 horas, em comparação a 3 a 4 horas para a alfainterferona convencional. A meia-vida terminal após administração subcutânea em pacientes é mais prolongada, com valor médio de 160 horas (84 a 353 horas). A meia-vida terminal determinada após a administração subcutânea pode refletir não apenas a fase de eliminação do composto, mas também a absorção prolongada de Alfapeginterferona 2a.
Foram observados aumentos proporcionais à dose na área sob a curva (ASC) e na concentração sérica máxima (Cmáx) em indivíduos saudáveis e em pacientes com hepatite crônica C após a dosagem de Alfapeginterferona 2a administrada uma vez por semana. Os parâmetros farmacocinéticos de Alfapeginterferona 2a para indivíduos saudáveis que receberam uma única injeção subcutânea de Alfapeginterferona 2a 180 mcg e para pacientes com hepatite crônica C que receberam 48 semanas de Alfapeginterferona 2a 180 mcg, uma vez por semana, encontram-se na Tabela 10.
Tabela 10 – Parâmetros farmacocinéticos de Alfapeginterferona 2a após dose única e doses múltiplas de 180 mcg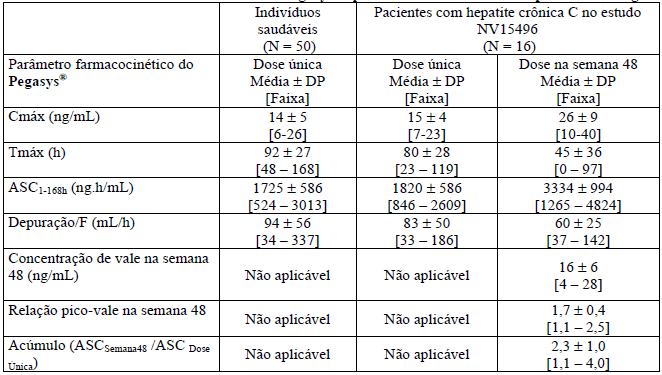
Em pacientes com hepatite crônica C, as concentrações séricas em estado de equilíbrio dinâmico aumentam de 2 a 3 vezes em comparação com valores de dose única e atingem estado de equilíbrio dinâmico dentro de 5 a 8 semanas de administração semanal. Uma vez atingido estado de equilíbrio dinâmico, não há acúmulo de alfapeginterferona 2a (40 KD). A relação pico-vale após 48 semanas de tratamento é cerca de 1,5 a 2,0. As concentrações séricas de alfapeginterferona 2a (40 KD) mantém-se durante 1 semana inteira (168 horas) (ver Figura 1).
Figura 1 – Médias das concentrações em estado de equilíbrio dinâmico da alfapeginterferona 2a (40 KD) em pacientes com hepatite crônica C após monoterapia com Alfapeginterferona 2a 180 mcg (NV15496) e em combinação com ribavirina (NV15801)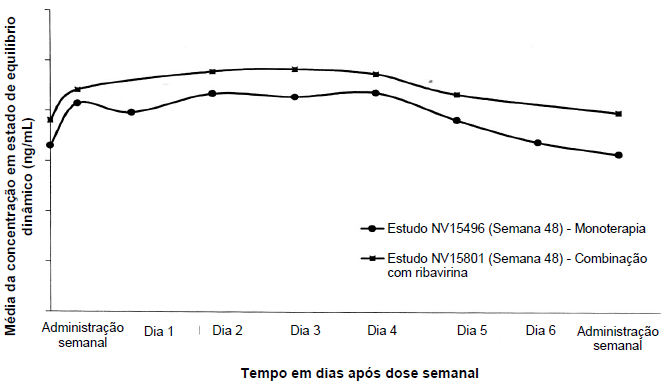
Farmacocinética em situações clínicas especiais:
Pacientes com insuficiência renal
Um estudo clínico avaliou 50 pacientes com hepatite crônica C com insuficiência renal moderada (depuração de creatinina de 30 a 50 mL / min) ou grave (depuração da creatinina inferior a 30 mL / min) ou com doença renal terminal necessitando de hemodiálise crônica. Os pacientes com insuficiência renal moderada que receberam Alfapeginterferona 2a 180 mcg uma vez por semana apresentaram exposição plasmática de alfapeginterferona 2a semelhante à exposição verificada em pacientes com função renal normal. Os pacientes com insuficiência renal grave que receberam Alfapeginterferona 2a 180 mcg uma vez por semana apresentaram uma exposição 60% maior de alfapeginterferona 2a do que os pacientes com função renal normal, portanto, uma dose reduzida de Alfapeginterferona 2a 135 mcg uma vez por semana é recomendada em pacientes com insuficiência renal grave. Em 18 pacientes com doença renal terminal que requerem hemodiálise crônica, a administração de Alfapeginterferona 2a 135 mcg uma vez por semana resultou em uma exposição 34% menor de alfapeginterferona 2a do que em pacientes com função renal normal. Apesar da exposição menor de alfapeginterferona 2a no plasma, os pacientes com insuficiência renal terminal apresentaram a maior frequência de reações adversas graves entre os outros grupos no estudo, provavelmente devido à gravidade e complexidadede comorbidades nesta população de pacientes.
Sexo
A farmacocinética de Alfapeginterferona 2a foi comparável entre indivíduos saudáveis dos sexos masculino e feminino.
Idosos
A ASC ficou discretamente aumentada em indivíduos com mais de 62 anos, mas as concentrações máximas (Cmáx) foram semelhantes naqueles com mais ou menos de 62 anos de idade. Com base na exposição ao fármaco, resposta farmacodinâmica e tolerabilidade, não é necessária a redução na dose inicial de Alfapeginterferona 2a para pacientes geriátricos.
Pacientes não-cirróticos e cirróticos
A farmacocinética de Alfapeginterferona 2a foi semelhante entre indivíduos saudáveis e pacientes com hepatite crônica B ou C. Foram observados perfis farmacocinéticos e de exposição comparáveis em pacientes com cirrose apresentando doença hepática compensada e pacientes sem cirrose.
Segurança pré-clínica
Os estudos de toxicidade pré-clínica conduzidos com Alfapeginterferona 2a foram limitados, por causa da especificidade dos tipos de alfainterferonas. Estudos de toxicidade aguda e crônica foram realizados em macacos Cynomolgus e os achados observados em animais que receberam alfapeginterferona 2a (40 KD) foram semelhantes em sua natureza aos produzidos pela alfainterferona 2a.
Estudos de toxicidade reprodutiva não foram realizados com Alfapeginterferona 2a. Como no caso de outras alfainterferonas, observou-se prolongamento do ciclo menstrual após a administração de alfapeginterferona 2a (40 KD) em macacas. O tratamento com alfainterferona 2a resultou em aumento estatisticamente significativo na atividade abortiva em macacas rhesus. Embora não tenham sido observados efeitos teratogênicos nos descendentes nascidos a termo, não podem ser excluídos efeitos adversos em seres humanos.
Alfapeginterferona 2a mais ribavirina
Quando usado em combinação com ribavirina, Alfapeginterferona 2a não causou nenhum efeito em macacos não observado anteriormente com qualquer das substâncias ativas isoladas. A principal alteração relacionada ao tratamento foi anemia leve a moderada reversível, cuja gravidade foi maior que a produzida por qualquer das substâncias ativas isoladas.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)