Qual a ação da substância do Padcev?
Resultados de Eficácia
Carcinoma urotelial localmente avançado ou metastático previamente tratado
Estudo clínico EV-3011
A eficácia de Enfortumabe Vedotina foi avaliada no estudo EV-301, um estudo aberto, randomizado e multicêntrico que incluiu 608 pacientes com carcinoma urotelial localmente avançado ou metastático que receberam tratamento prévio com um inibidor de PD-1 ou PD-L1 e uma quimioterapia baseada em platina. Os pacientes foram randomizados em 1:1 para receber Enfortumabe Vedotina na dose de 1,25 mg/kg nos Dias 1, 8 e 15 de um ciclo de 28 dias ou a quimioterapia de escolha do investigador. A randomização foi estratificada por Eastern Cooperative Oncology Group (ECOG OS) (0 vs 1), região do mundo (Europa Ocidental vs EUA vs Resto do Mundo) e presença de metástase hepática.
Os pacientes foram excluídos do estudo se apresentassem metástases ativas ao sistema nervoso central (SNC), neuropatia sensorial ou motora em andamento Grau ≥2 ou diabetes não controlado definido como hemoglobina A1C (HbA1c) ≥8 ou HbA1c ≥7 com sintomas de diabetes associados.
A idade mediana foi de 68 anos (variação: 30 a 88 anos) e 77% eram do sexo masculino. Os dados demográficos raciais foram relatados como caucasianos (52%), asiáticos (83%), negros (0,7%), nativos do Havai ou de outra ilha do Pacífico (0,2%) ou raça não relatada (15%). Nove por cento dos pacientes eram hispânicos ou latinos. Todos os pacientes apresentaram um estado de desempenho ECOXG de 0 (40%) ou (60%). Trinta e quatro por cento dos pacientes tinham tumores localizados no irato superior, que incluíam a pelve renal e ureter. Oitenta por cento dos pacientes apresentaram metástases viscerais incluindo 31% com metástases hepáticas. Setenta e seis por cento (dos pacientes apresentava histologia de carcinoma de células transicionais (TCC) puro; 14% apresentavam TCC com outras variantes histológicas; e 10% apresentavam (outras histologias tumorais, incluindo adenocarcinoma e carcinoma de células escamosas. O número mediano de terapias prévias foi 2 (intervalo 1 4 =3). Sessenta e três por cento dos pacientes receberam esquemas anteriores à base de cisplatina, 26% receberam esquemas anteriores à base de carboplatina, e outros 11% receberam esquemas à base de cisplatina e carboplatina. Os pacientes no braço de controle receberam docetaxel (38%), paclitavel (36%) ou vinflunina (25%).
As principais medidas de resultados de eficácia foram a sobrevida global (SG), a sobrevida livre de progressão (SLP) e a taxa de resposta global (ORR) avaliadas pelo investigador usando RECIST v1.1. Os resultados de eficácia foram consistentes em todos os subgrupos estratificados de pacientes.
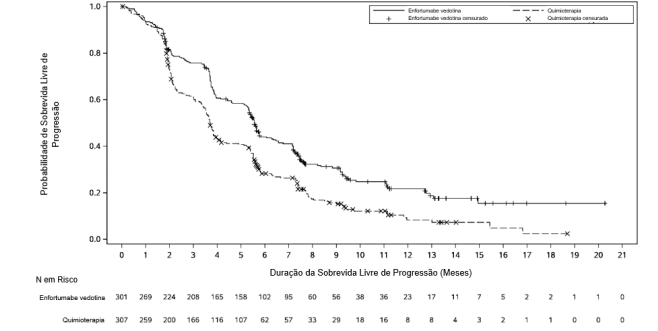
A tabela 1 e as figuras 1 e 2 resumem os resultados de eficácia para EV-301.
Tabela 1. Resultados de eficácia no estudo EV-301
| Desfecho | Enfortumabe Vedotina N = 301 | Quimioterapia N = 307 |
| Sobrevida Global1 | ||
| Número (%) de pacientes que apresentam evento | 134 (44,5) | 167 (54,4) |
| Mediana em meses (IC 95%) | 12,9 (10,6, 15,2) | 9,0 (8,1, 10,7) |
| Razão de risco (IC de 95%) | 0,70 (0,56, 0,89) | |
| Valor de p | 0,0014 | |
| Sobrevida Livre Progressão1 | ||
| Número (%) de pacientes que apresentam evento | 201 (66,8) | 231 (75,2) |
| Mediana em meses (IC 95%) | 5,6 (2,3, 5,8) | 3,7 (3,5, 3,9) |
| Razão de risco (IC de 95%) | 0,62 (0,51, 0,75) | |
| Valor de p | <0,0001 | |
| Taxa de Resposta Global (CR + PR)2 | ||
| ORR (%) (IC de 95%) | 40,6 (34,9, 46,5) | 17,9 (13,7, 22,8) |
| Valor de p | <0,0001 | |
| Taxa de resposta completa (%) | 4,9 | 2,7 |
| Taxa de resposta parcial (%) | 35,8 | 15,2 |
1 Com base no teste de log-rank. Os fatores de estratificação foram ECOG PS, região e metástase hepática.
2 Com base no teste de Cochran-Mantel-Haenszel. Os fatores de estratificação foram ECOG PS, região e metástase hepática.
Figura 1. Representação gráfica de Kaplan Meier de sobrevida global
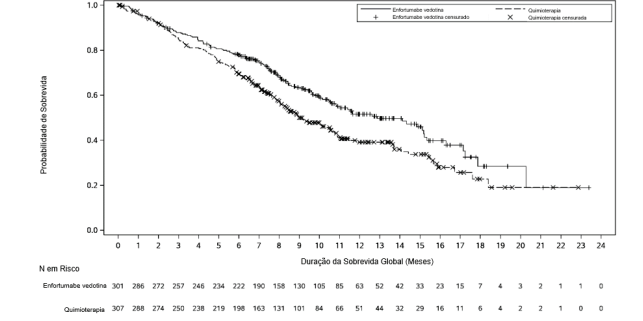
Figura 2. Representação gráfica de Kaplan Meier de sobrevida livre progressão
Estudo clínico EV-201, Coorte 12
A eficácia de Enfortumabe Vedotina também foi investigada na Coorte 1 do estudo EV-201, um estudo de braço único, de coortes múltiplas e multicêntrico que incluiu 125 pacientes com carcinoma urotelial localmente avançado ou metastático que receberam tratamento prévio com um inibidor de PD-1 ou PD-L1 e uma quimioterapia baseada em platina. Os pacientes foram excluídos do estudo se apresentassem metástases ativas ao sistema nervoso central (SNC), neuropatia sensorial ou motora em andamento Grau ≥2, insuficiência cardíaca ou diabetes não controlado definido como hemoglobina A1C (HbA1c) ≥8 ou HbA1c ≥7 com sintomas de diabetes associados.
Enfortumabe Vedotina foi administrado na dose de 1,25 mg/kg, como uma infusão via intravenosa (IV) nos dias 1, 8, e 15 de cada ciclo de 28 dias.
A idade mediana foi de 69 anos (variação: 40 a 84 anos) e 70% eram do sexo masculino. Os dados demográficos raciais foram relatados como caucasianos (85%), asiáticos 9%), negros (2%), outro (0,8) ou raça não relatada (4%). Quatro por cento dos pacientes eram hispânicos ou latinos. Todos os pacientes apresentaram um estado de desempenho do Easter Cooperatíve Oncology Group (ECOG) de 0 (32%) ou 1 (68%). Noventa por cento dos pacientes apresentaram metástases viscerais incluindo 40% com metástases hepáticas. Aproximadamente dois terços (67%) dos pacientes apresentaram histologia de carcinoma de células transicionais (TCC) puro; 33% apresentaram TCC com outras variantes histológicas. O número mediano de terapias sistêmicas prévias foi 3 (variação: 1 a 6). Sessenta e seis por cento dos pacientes receberam esquemas prévios à base de cisplatina, 26% receberam esquemas anteriores à base de carboplatina, e outros 8% receberam esquemas à base de cisplatina e carboplatina.
As principais medidas de desfecho de eficácia foram a taxa de resposta objetiva confirmada (ORR) e a duração da resposta (DOR) avaliadas por revisão central independente em caráter cego (blinded independent central review: BICR) utilizando RECIST v1.1.
Os resultados de eficácia são apresentados na Tabela 2.
Tabela 2. Resultados de eficácia na coorte 1 do estudo EV-201 (Avaliação BICR)
| Desfecho | Enfortumabe Vedotina n=125 |
| ORR confirmada (IC de 95%) | 44% (35,1, 53,2) |
| Taxa de Resposta Completa (CR) | 12% |
| Taxa de Resposta Parcial (PR) | 32% |
| Mediana de Duração da Resposta1, em meses (IC de 95%) | 7,6 (6,3, NE) |
NE = não estimável.
1 Com base em pacientes (N=55) com uma resposta pela BICR.
Pacientes inelegíveis à cisplatina com carcinoma urotelial localmente avançado ou metastático
A eficácia de Enfortumabe Vedotina também foi avaliada na Coorte 2 do EV-201, um estudo de braço único, de coortes múltiplas e multicêntrico, em 89 pacientes com carcinoma urotelial localmente avançado ou metastático que receberam tratamento prévio com um inibidor de PD-1 ou PD-L1, inelegíveis para cisplatina e que não receberam platina no cenário localmente avançado ou metastático. Os pacientes foram excluídos do estudo se apresentassem metástases ativas ao SNC, neuropatia sensorial ou motora em andamento Grau ≥2, insuficiência cardíaca ou diabetes não controlado definido como hemoglobina A1C (HbA1c) ≥8 ou HbA1c ≥7 com sintomas de diabetes associados.
Enfortumabe Vedotina foi administrado na dose de 1,25 mg/kg, como uma infusão via intravenosa (IV) nos dias 1, 8 e 15 de cada ciclo de 28 dias.
A idade mediana foi de 75 anos (variação: 49 a 90 anos) e 74% eram do sexo masculino. Os dados demográficos raciais foram relatados como caucasianos (10%), asiáticos (22%) ou raça não relatada (8%). Um por cento dos pacientes eram hispânicos ou latinos. Os pacientes tiveram um status de desempenho do ECOG basal de 0 (42%), 1 (46%) e 2 (12%). Quarenta e três por cento dos pacientes apresentavam tumores localizados no trato superior, que incluíam a pelve renal e ureter. Setenta e nove por cento dos pacientes apresentaram metástases viscerais e 24% apresentaram metástases hepáticas. As razões para inelegibilidade para cisplatina incluíam: 66% com depuração de creatinina basal 30 a 59 mL/min, 7% com ECOG PS de 2, 15% com perda de audição de grau 2 ou superior e 12% com mais de um critério de inelegibilidade para cisplatina. Setenta por cento dos pacientes apresentaram histologia de TCC; 13% apresentaram TCC com diferenciação escamosa e 17% apresentaram TCC com outras variantes histológicas.. O número mediano de terapias sistêmicas prévias foi 1 (variação: 1 a 4).
Os resultados de eficácia são apresentados na Tabela 3 abaixo.
Tabela 3. Resultados de Eficácia na Coorte 2 do Estudo EV-201 (Avaliação da BICR)
| Desfecho | Enfortumabe Vedotina N = 89 |
| ORR confirmada (IC de 95%) | 51% (39,8, 61,3) |
| Taxa de Resposta Completa (CR) | 22% |
| Taxa de Resposta Parcial (PR) | 28% |
| Mediana de Duração da Resposta1, em meses (IC de 95%) | 13,8 (6,4, NE) |
NE = não estimável.
1 Com base em pacientes (N=45) com uma resposta pela BICR.
Referências Bibliográficas
1 - Estudo clínico EV-301.
2 - Estudo clínico SGN22E-001 (EV-201).
Características Farmacológicas
Propriedades farmacodinâmicas
Mecanismo de ação
O Enfortumabe Vedotina é um anticorpo conjugado com droga (ADC). O anticorpo é um IgG1 humano direcionado contra a nectina-4, uma proteína de adesão localizada na superfície das células. A molécula sintética, MMAE, é um agente de ruptura de microtúbulos, ligado ao anticorpo por meio de um ligante clivável por protease. Dados não clínicos sugerem que a atividade anticâncer de Enfortumabe Vedotina ocorre devido à ligação do ADC às células que expressam nectina-4, seguida pela internalização do complexo ADC-nectina-4 e a liberação do MMAE por meio de clivagem proteolítica. A liberação de MMAE interrompe a rede de microtúbulos dentro da célula, subsequentemente induzindo a parada do ciclo celular e a morte celular por apoptose.
Efeitos farmacodinâmicos
Em uma análise de resposta à exposição, uma exposição mais elevada ao Enfortumabe Vedotina foi associada à maior incidência de algumas reações adversas (por exemplo, neuropatia periférica de grau ≥2, hiperglicemia de grau ≥3). A relação de exposição-resposta para a eficácia não foi totalmente caracterizada.
Eletrofisiologia Cardíaca
Na dose recomendada, Enfortumabe Vedotina não causou grande prolongamento de intervalo QTc (>20 ms).
Propriedades farmacocinéticas
A análise de farmacocinética da população incluiu os dados de 748 pacientes com base em cinco estudos. A farmacocinética de Enfortumabe Vedotina foi caracterizada após doses únicas e múltiplas em pacientes com carcinoma urotelial localmente avançado ou metastático e outros tumores sólidos.
Os parâmetros de exposição do ADC e MMAE não conjugado (o componente citotóxico de Enfortumabe Vedotina) estão resumidos na tabela 4 abaixo. As concentrações máximas do ADC foram observadas próximo do final da infusão e as concentrações máximas de MMAE foram observadas aproximadamente 2 dias após a administração de Enfortumabe Vedotina. Um acúmulo mínimo de ADC e MMAE foi observado após administrações repetidas de Enfortumabe Vedotina nos pacientes. As concentrações em estado estacionário (steady-state) de ADC e MMAE foram alcançadas após 1 ciclo de tratamento.
Tabela 4. Parâmetros de exposição de ADC e MMAE não conjugado após primeiro ciclo de tratamento de 1,25 mg/kg de dose de Enfortumabe Vedotina nos dias 1, 8 e 15
| - | ADC (anticorpo conjugado com droga) Média (± DP) | MMAE não conjugada Média (± DP) |
| Cmax | 28 (6,1) µg/mL | 5,5 (3,0) ng/mL |
| AUC0-28d | 110 (26) µg•d/mL | 85 (50) ng•d/mL |
| Cmin0-28d | 0,31 (0,18) µg/mL | 0,81 (0,88) ng/mL |
Cmáx = concentração máxima, AUC0-28d = área sob a curva de concentração-tempo desde o tempo zero até 28 dias, Cmín,0-28d = concentração pré-dose no dia 28, DP = desvio padrão.
Distribuição
O volume de distribuição estimado em estado estacionário de ADC foi de 12,8 litros após a administração de Enfortumabe Vedotina. A ligação de MMAE à proteína plasmática variou entre 68 a 82%, in vitro.
Eliminação
ADC e MMAE exibiram declínios multiexponenciais com meia-vida de eliminação de 3,6 dias e 2,6 dias, respectivamente. A depuração (CL=clearance) médio de Enfortumabe Vedotina e MMAE não conjugado em pacientes foi 0,11 L/h e 2,11 L/h, respectivamente. A eliminação de MMAE pareceu ser limitada por sua taxa de liberação a partir de Enfortumabe Vedotina.
Metabolismo
O catabolismo de Enfortumabe Vedotina não foi estudado em humanos; no entanto, é esperado que sofra catabolismo para pequenos peptídeos, aminoácidos, MMAE não conjugado e catabólitos relacionados ao MMAE não conjugado. O Enfortumabe Vedotina libera MMAE via clivagem proteolítica, e o MMAE é metabolizado principalmente pela CYP3A4 in vitro.
Excreção
A excreção de Enfortumabe Vedotina não está totalmente caracterizada. Após uma dose única de outro ADC que contém MMAE, 17% do MMAE total administrado foram recuperados nas fezes e 6% na urina em um período de 1 semana, principalmente como droga inalterada. É esperado um perfil de excreção semelhante para MMAE após a administração de Enfortumabe Vedotina.
Farmacocinética em populações especiais
Com base na análise farmacocinética populacional, não foram observadas diferenças clinicamente significativas na farmacocinética do Enfortumabe Vedotina com base na idade (24 a 90 anos), sexo ou raça/etnia (caucasianos, asiáticos, negros ou outros).
Insuficiência hepática
Com base na análise de farmacocinética populacional, houve um aumento de 37% da AUC0-28d na exposição do MMAE não conjugado observado em pacientes com insuficiência hepática leve (bilirrubina total de 1 a 1,5 × LSN e AST qualquer, ou bilirrubina total ≤LSN e AST >LSN, n=65) em comparação a pacientes com função hepática normal. O Enfortumabe Vedotina foi estudado apenas em um número limitado de pacientes com insuficiência hepática moderada e não foi avaliado em pacientes com insuficiência hepática severo. O efeito da insuficiência hepática moderada ou grave (bilirrubina total > 1,5 x LSN e AST qualquer) ou de transplante de fígado na farmacocinética de ADC ou MMAE não conjugado é desconhecido.
Insuficiência renal
A farmacocinética do Enfortumabe Vedotina e MMAE não conjugado foi avaliada após a administração de 1,25 mg/kg de Enfortumabe Vedotina a pacientes com insuficiência renal leve (depuração/clearance de creatinina: CrCL >60-90 mL/min; n= 272), moderada (CrCL 30–60 mL/min; n=315) e severa (CrCL <30 mL/min; n=25). Não foram observadas diferenças significativas na exposição (AUC) de ADC ou MMAE em pacientes com insuficiência renal leve, moderada ou grave em comparação a pacientes com função renal normal. O efeito da doença renal em estágio terminal com ou sem necessidade de diálise na farmacocinética do ADC ou MMAE não conjugado é desconhecido.
Uso geriátrico
Dos 680 pacientes tratados com Enfortumabe Vedotina em estudos clínicos, 440 (65%) tinham 65 anos ou mais e 168 (25%) tinham 75 ou mais. Não foram observadas diferenças gerais na segurança ou eficácia entre estes pacientes e os pacientes mais jovens.
Dados de segurança não-clínica
Carcinogênese, mutagênese, comprometimento da fertilidade
Não foram realizados estudos de carcinogenicidade com Enfortumabe Vedotina ou com o agente citotóxico sintético (MMAE).
O MMAE foi genotóxico no estudo do micronúcleo da medula óssea de ratos por meio de um mecanismo aneugênico. Este efeito é compatível com o efeito farmacológico do MMAE como agente de ruptura dos microtúbulos. O MMAE não foi mutagênico no ensaio de mutação reversa bacteriana (teste de Ames) ou no ensaio de mutação direta de linfoma de camundongo L5178Y.
Não foram realizados estudos de fertilidade com Enfortumabe Vedotina ou MMAE. No entanto, os resultados dos estudos de toxicidade de doses repetidas realizados em ratos indicam o potencial de Enfortumabe Vedotina em comprometer a função reprodutiva e a fertilidade masculinas.
Em estudos de toxicologia de dose repetida realizados em ratos por até 13 semanas, as doses ≥2 mg/kg de Enfortumabe Vedotina (em exposições semelhantes às exposições na dose humana recomendada) resultaram em diminuições nos pesos dos testículos e do epidídimo, degeneração do túbulo seminífero, depleção de espermátides/espermatócitos nos testículos e detritos celulares, granuloma de esperma e hipospermia/espermátides anormais no epidídimo. Os achados nos testículos e epidídimo não foram revertidos até o final do período de recuperação.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)