Qual a ação da substância do Opsumit?
Resultados de Eficácia
Eficácia e segurança clínicas
Eficácia em pacientes com hipertensão arterial pulmonar
Um estudo multicêntrico, duplo-cego, controlado por placebo, de grupo paralelo, orientado por eventos, de resultado Fase 3 (AC-055-302/SERAPHIN1) foi conduzido em 742 pacientes com HAP sintomática, que foram randomizados para três grupos de tratamento (placebo [N=250], 3 mg [N=250] ou 10 mg [N=242] de macitentana a uma vez por dia), para avaliar o efeito a longo prazo sobre a morbidade ou mortalidade.
No início do estudo, a maioria dos pacientes inscritos (64%) foi tratada com uma dose estável de terapia específica para a HAP, inibidores da fosfodiesterase orais (61%) e/ou prostanoides inalatórios/orais (6%). Não foi recomendado ajuste de dose para terapia concomitante para a HAP ao se iniciar o medicamento em estudo. Se uma terapia adicional específica para HAP tivesse sido iniciada, o medicamento em estudo não deveria ser descontinuado (a menos que a terapia adicional fosse um antagonista do receptor da endotelina [ARE]).
O desfecho primário (endpoint) do estudo foi o tempo para a primeira ocorrência de um evento de morbidade ou mortalidade, até ao final do tratamento (FT), definida como a morte, ou atriosseptostomia, ou transplante de pulmão, ou introdução de prostanoides intravenosos (iv) ou subcutâneos (s.c.), ou outro agravamento da HAP. Outro agravamento da HAP foi definido como a presença de todos os três dos seguintes componentes: uma diminuição sustentada na distância de caminhada de 6 minutos (DTC6) de pelo menos 15% do valor basal, agravamento dos sintomas de HAP (piora de classe funcional [CF] da OMS ou insuficiência cardíaca direita), e necessidade de novo tratamento para HAP. Todos os eventos foram confirmados por uma comissão de adjudicação independente, cega para alocação do tratamento.
A duração mediana do tratamento foi de 101, 116 e 118 semanas nos grupos placebo, este medicamento (macitentana) 3 mg e 10 mg, respectivamente, até um máximo de 188 semanas neste medicamento (macitentana).
A eficácia foi avaliada até o final do tratamento (FT) duplo-cego. O fim do tratamento coincidiu com o final do estudo (FE), para os pacientes que completaram o estudo conforme programado, ou ocorreu mais cedo em caso de interrupção prematura do medicamento em estudo. Para aqueles pacientes que pararam o tratamento antes do fim do estudo, a terapia de HAP, incluindo este medicamento (macitentana), pode ter sido iniciada. Todos os pacientes foram acompanhados até o fim do estudo para o estado vital. A taxa de verificação para o estado vital no fim do estudo foi superior a 95%.
A idade média dos pacientes era de 46 anos (intervalo de 12-85 anos de idade), com a maioria dos indivíduos sendo Caucasianos (55%) e do sexo feminino (77%). Cerca de 52%, 46% e 2% dos pacientes estavam na Classe funcional II, III, e IV da OMS, respectivamente.
HAP idiopática ou hereditária foi a etiologia mais comum na população estudada (57%), seguido por HAP devido a doenças do tecido conectivo (31%), HAP associada à cardiopatia congênita com shunts (comunicação) (8%), e HAP associada a outras etiologias ( medicamentos e toxinas [3%] e HIV [1%]).
Resultados
O tratamento com 10 mg deste medicamento (macitentana) resultou em uma redução de 45% no risco (razão de risco [RR] 0,55; 97,5% CI: 0,39 a 0,76; logrank p<0,0001) de ocorrência de eventos de morbidade ou mortalidade até o fim do tratamento, comparado com o placebo [Figura 1 e Tabela 1]. O efeito do tratamento foi estabelecido no início e foi sustentado por uma duração mediana de 2 anos.
Eficácia deste medicamento (macitentana) de 10 mg no desfecho primário foi consistente em todos os subgrupos de idade, sexo, origem étnica, região geográfica, etiologia, por monoterapia ou em combinação com outra terapia para HAP e pela classe funcional da OMS (I/II e III/IV).
Figura1 Estimativas de Kaplan-Meier do primeiro evento de morbi-mortalidade no estudo SERAPHIN
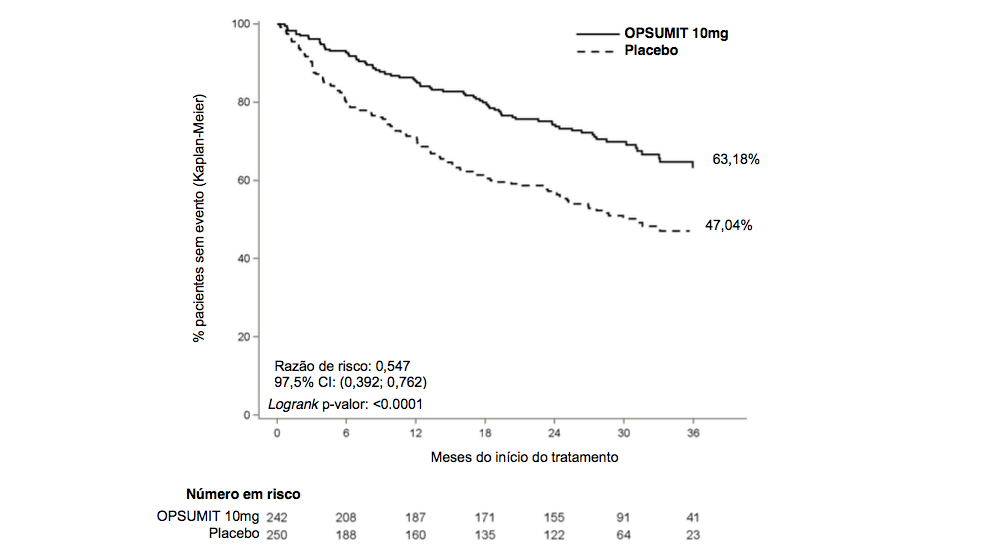
Tabela 1 Resumo de eventos de desfecho
Desfechos & Estatística | Pacientes com eventos | Comparação do Tratamento: este medicamento (macitentana) 10 mg vs placebo | ||||
Placebo (N=250) | Este medicamento (macitentana) 10 mg (N=242) | Redução do Risco Absoluto | Redução do risco relativo (Cl 97,5%) | RRa | Logrank p-valor | |
Evento de Morbi- mortalidade b | 53% | 37% | 16% | 45% | 0.55 | < 0.0001 |
Morte c n (%) | 19 (7.6%) | 14 (5.8%) | 2% | 36% −42%, 71% | 0.64 | 0.20 |
Agravamento da HAP | 93 (37.2%) | 59 (24.4%) | 13% | 49% | 0.51 | < 0.0001 |
iv/sc Introdução de Prostanoide n (5%) | 6 (2.4%) | 1 (0.4%) | 2% | |||
| a = baseado no Modelo de Riscos Proporcionais de Cox b = % dos pacientes com um evento em 36 meses = 100 × (1 - estimativa KM) c = toda causa de morte até FT, independentemente do agravamento anterior | ||||||
O número de mortes por todas as causas até o FT com este medicamento (macitentana) de 10 mg foi de 35 versus 44 no grupo placebo (RR 0,77; IC 97,5%: 0.46 a 1.28).
O risco de morte relacionada com HAP ou hospitalização por HAP até o FT foi reduzido em 50% (RR 0,50; IC 97,5%: 0,34 para 0,75; logrank p<0,0001) em pacientes que receberam este medicamento (macitentana) 10 mg (50 eventos) em comparação com o placebo (84 eventos). Aos 36 meses, 44,6% dos pacientes tratados com placebo e 29,4% dos pacientes tratados com este medicamento (macitentana) 10 mg (redução do risco absoluto = 15,2%) haviam sido hospitalizados por HAP ou morreram de uma causa relacionada com HAP. Estes últimos dados permitem concluir que este medicamento (macitentana) reduz a frequência de hospitalização por HAP..
Desfechos sintomáticos
A capacidade de exercício foi avaliada como desfecho secundário. O tratamento com este medicamento (macitentana) 10 mg no mês 6 resultou em um aumento médio corrigido com placebo em DTC6 de 22 metros (CI 97,5%: 3 a 41; p=0,0078). A avaliação da DTC6 por classe funcional resultou em um aumento médio corrigido pelo placebo do valor basal para o mês 6 em pacientes CF III/IV de 37 metros (CI 97,5%: 5a69, p=0,0088) e na CF I/II de 12 metros (CI 97,5%: -8 a 33, p=0,1762). O aumento da DTC6 obtido com este medicamento (macitentana) foi mantido durante a duração do estudo.
O tratamento com este medicamento (macitentana) de 10 mg levou a uma chance 74% maior de melhora relativa da CF OMS em relação ao placebo (razão de risco 1,74; IC 97,5%: 1,10-2,74; p = 0,0063). O tratamento com este medicamento (macitentana) de 10 mg levou a uma melhoria de pelo menos uma CF OMS no mês 6 em 22% dos pacientes em comparação com 13% dos pacientes tratados com placebo.
Este medicamento (macitentana) de 10 mg melhorou a qualidade de vida avaliada pelo questionário SF-36. Melhorias em comparação com placebo foram observadas em 7 dos 8 domínios em 6 meses, incluindo o funcionamento físico, função física, dor corporal, vitalidade, aspectos sociais, emocionais e domínios da saúde mental do questionário SF-36.
Desfechos hemodinâmicos
Parâmetros hemodinâmicos foram avaliados em um subconjunto de pacientes (placebo [N=67], este medicamento (macitentana) 10 mg [N=57]) após 6 meses de tratamento. Pacientes tratados com este medicamento (macitentana) de 10 mg alcançaram uma redução mediana de 36,5% (IC: 21,7 a 49,2%) na resistência vascular pulmonar e um aumento de 0,58 L/min/m2 (CI: 0,28 a 0,93 l/min/m2) no índice cardíaco em comparação com o placebo.
Referências bibliográficas
- 1 –Pulido T., Adzerikho I., Channick R. et al - Macitentan and morbidity and mortality in Pulmonary Arterial Hypertension – N Engl J Med. 2013; 369:809-818.
Dados Pré-Clínicos de Segurança
Nenhum efeito adverso foi observado em estudos de toxicidade de dose repetida em camundongos, ratos e cães até 39 semanas de tratamento com exposições de 2 a 6 vezes a exposição humana a 10 mg/dia.
Em cães, este medicamento (macitentana) diminuiu a pressão arterial em níveis de exposição semelhantes à exposição terapêutica humana. Em uma exposição 17 vezes superior a observada em humanos, verificou-se um espessamento da camada íntima das artérias coronárias, após 4 a 39 semanas de tratamento. Devido à sensibilidade específica da espécie e à margem de segurança, este achado é considerado não relevante para os seres humanos.
Aumento do peso do fígado e hipertrofia hepatocelular foram observados em camundongos, ratos e cães após tratamento com este medicamento (macitentana). Essas alterações foram amplamente reversíveis e consideradas adaptações não adversas do fígado em função do aumento de demanda metabólica. Não houve achados hepáticos adversos em estudos de longo prazo realizados em camundongos, ratos e cães em exposições 12 a 116 vezes a exposição humana.
Este medicamento (macitentana) não foi genotóxico em uma bateria padrão de testes in vitro e in vivo. Este medicamento (macitentana) não foi fototóxico in vivo.
Os estudos de carcinogenicidade de 2 anos de duração não revelaram um potencial carcinogênico em exposições 18 vezes e 116 vezes a exposição humana em ratos e camundongos, respectivamente. Este medicamento (macitentana) induziu hiperplasia da mucosa e infiltração inflamatória mínima a leve, na submucosa da cavidade nasal, em todas as doses no estudo de carcinogenicidade em camundongo. Nenhum achado na cavidade nasal foi percebido no estudo de toxicidade de 3 meses em camundongo ou nos estudos em ratos e cachorros.
Dilatação tubular testicular reversível foi observada em estudos de toxicidade crónica em exposições superiores a 7 vezes e 23 vezes a exposição humana em ratos e cães, respectivamente. Após 2 anos de tratamento, foi observada atrofia tubular em ratos a 4 vezes a exposição humana. Este medicamento (macitentana) não afetou a fertilidade masculina ou feminina em exposições que variaram de 18 a 44 vezes a exposição humana, respectivamente, e não teve efeito sobre a contagem, motilidade e morfologia dos espermatozoides em ratos machos. Hipoespermatogênese foi observada no estudo de carcinogenicidade de longo prazo em ratos, e nos estudos de dose repetida em cachorros em exposições que proporcionaram margens de segurança de 9,7 em ratos e 23 em cachorros. Não houve achados testiculares em camundongos após tratamento de até 2 anos. Este medicamento (macitentana) foi teratogênico em coelhos e ratos em todas as doses testadas. Em ambas as espécies, houve anormalidades cardiovasculares e do arco de fusão mandibular.
A administração deste medicamento (macitentana) em ratos fêmea desde o final da gravidez até o aleitamento com uma exposição materna 5 vezes a exposição humana, causou reduzida sobrevivência das crias e comprometimento da capacidade reprodutiva da prole.
O tratamento de ratos jovens do pós-natal do dia 4 ao dia 114 provocou uma diminuição no ganho de peso e atrofia testicular tubular em exposição 7 vezes a exposição humana. O índice de fertilidade não foi afetado. Foram registrados mínimos efeitos nos parâmetros reprodutivos secundários no desenvolvimento.
Características Farmacológicas
Propriedades Farmacodinâmicas
Grupo farmacoterapêutico: outros anti-hipertensivos, código ATC: C02KX04
Mecanismo de ação
A endotelina-1 (ET) e seus receptores (ETA e ETB) mediam uma variedade de efeitos deletérios, tais como a vasoconstrição, fibrose, proliferação, hipertrofia e inflamação. Em condições de doença, tais como HAP, o sistema ET local é regulado positivamente e está envolvido em hipertrofia vascular e em danos aos órgãos.
Este medicamento (macitentana) é um antagonista dos receptores ETA e ETB que evita a ligação de ET-1 aos seus receptores. Este medicamento (macitentana) exibe alta afinidade e ocupação prolongada dos receptores de ET nas células musculares lisas arteriais pulmonares humanas e possui propriedades físico-químicas que favorecem a penetração no tecido pulmonar, particularmente em condições de doença.
Propriedades Farmacocinéticas
As propriedades farmacocinéticas deste medicamento (macitentana) e de seu metabólito ativo foram estudadas principalmente em indivíduos saudáveis. A exposição a este medicamento (macitentana) em pacientes com HAP foi aproximadamente 1,2 vezes superior à observada em indivíduos saudáveis. A exposição ao seu metabólito ativo, que é aproximadamente 5 vezes menos potente que este medicamento(macitentana), foi aproximadamente 1,3 vezes superior à observada em indivíduos saudáveis. A farmacocinética deste medicamento (macitentana) em pacientes com HAP não foi influenciada pela gravidade da doença. Após a administração repetida, a farmacocinética deste medicamento (macitentana) é proporcional à dose até 30 mg, inclusive.
Absorção
As concentrações plasmáticas máximas deste medicamento (macitentana) são atingidas cerca de 8 horas após a administração. Depois disso, as concentrações plasmáticas deste medicamento (macitentana) e seu metabólito ativo diminuem lentamente, com uma meia-vida de eliminação aparente de aproximadamente 16 horas e 48 horas, respectivamente.
Em indivíduos saudáveis, as exposições à este medicamento (macitentana) e seu metabólito ativo são inalteradas na presença de alimentos e, por conseguinte, este medicamento (macitentana) pode ser tomado com ou sem alimentos.
Após múltiplas doses, foram obtidas as condições de estado de equilíbrio deste medicamento (macitentana) e seu metabólito ativo (ACT-132577) após 3 dias e 7 dias, respectivamente. Como previsto, a partir do t1/2 observado, a acumulação deste medicamento (macitentana) foi mínima (cerca de 1,5 vezes), enquanto que ACT- 132577 foi cerca de 8,5 vezes. No estado de equilíbrio, os metabólitos ACT-132577 e ACT-373898 contribuíram em cerca de 74% e 3% da exposição total ao medicamento, respectivamente.
Distribuição
Este medicamento (macitentana) e seu metabólito ativo ACT -132577 são bem distribuídos nos tecidos como indicado por um volume aparente de distribuição (Vss/F) de cerca de 50 L e 40 L, respectivamente. Este medicamento (macitentana) e seu metabólito ativo são altamente ligados às proteínas plasmáticas (> 99%), principalmente à albumina e em menor extensão à glicoproteína ácida alfa-1.
Biotransformação
Este medicamento (macitentana) tem quatro vias metabólicas primárias. Outras vias metabólicas fornecem produtos sem atividade farmacológica. Vários membros da família CYP2C, conhecidos como CYP2C8, CYP2C9 e CYP2C19, bem como a CYP3A4, estão envolvidos na formação destes metabólitos. Depropilação oxidativa da sulfamida produz um metabólito farmacologicamente ativo. Esta reação é dependente do sistema do citocromo P450, principalmente CYP3A4, (cerca de 99%) com menores contribuições de CYP2C8, CYP2C9 e CYP2C19. O metabólito ativo circula no plasma humano e pode contribuir para o efeito farmacológico.
Eliminação
Este medicamento (macitentana) só é excretado após metabolização extensa. A principal via de excreção é através da urina, correspondendo a cerca de 50% da dose.
Populações especiais
Não há efeito clinicamente relevante da idade, sexo ou origem étnica na farmacocinética deste medicamento (macitentana) e seu metabólito ativo.
Insuficiência renal
A exposição à este medicamento (macitentana) e seu metabólito ativo foi aumentada em 1,3 e 1,6 vezes, respectivamente, em pacientes com insuficiência renal grave. Este aumento não é considerado clinicamente relevante, mas algumas precauções devem ser tomadas em pacientes com insuficiência renal (ver seções "8 - Posologia e modo de usar" e "5 – Advertências e Precauções").
Insuficiência hepática
A exposição à este medicamento (macitentana) foi reduzida em 21%, 34% e 6% e, para o metabólito ativo em 20%, 25% e 25%, em indivíduos com insuficiência hepática leve, moderada ou grave, respectivamente. Esta diminuição não é considerada clinicamente relevante, mas algumas precauções devem ser tomadas em pacientes com insuficiência hepática (ver seções "8 - Posologia e modo de usar" e "5 – Advertências e Precauções").

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)