Qual a ação da substância do Kadcyla?
Resultados de eficácia
Câncer de mama metastático
Um estudo clínico fase III, randomizado, multicêntrico, internacional, aberto (TDM4370g/BO21977) foi conduzido com pacientes com câncer de mama HER2-positivo metastático ou localmente avançado não ressecável que receberam terapia prévia à base de taxano e trastuzumabe, incluindo pacientes que receberam terapia prévia com trastuzumabe e um taxano como adjuvantes e que apresentaram recidiva dentro de seis meses após completarem a terapia adjuvante. Antes da inclusão, era necessário que amostras de tumor de mama fossem confirmadas como doença HER2-positivo, definida pelo escore de 3+ por IHQ (imuno-histoquímica) ou amplificação genética por ISH (hibridização in situ). Características basais dos pacientes e do tumor foram bem equilibradas entre os grupos de tratamento. Para pacientes randomizados para Trastuzumabe entansina, a idade mediana foi de 53 anos, a maioria dos pacientes era mulheres (99,8%), a maioria era branca (72%) e 57% apresentavam doença positiva para receptor de estrógeno e/ou progesterona. O estudo comparou a segurança e a eficácia de Trastuzumabe entansina com a de lapatinibe mais capecitabina. No total, 991 pacientes foram randomizados para Trastuzumabe entansina ou lapatinibe mais capecitabina como vemos a seguir:
- Braço Trastuzumabe entansina: 3,6 mg/kg via intravenosa (IV), em 30 a 90 minutos no Dia 1, de um ciclo de 21 dias,
- Braço controle (lapatinibe mais capecitabina): lapatinibe 1250 mg/dia via oral, uma vez por dia, de um ciclo de 21 dias, mais capecitabina 1000 mg/m2 via oral, duas vezes por dia, nos Dias 1 a 14 de um ciclo de 21 dias.
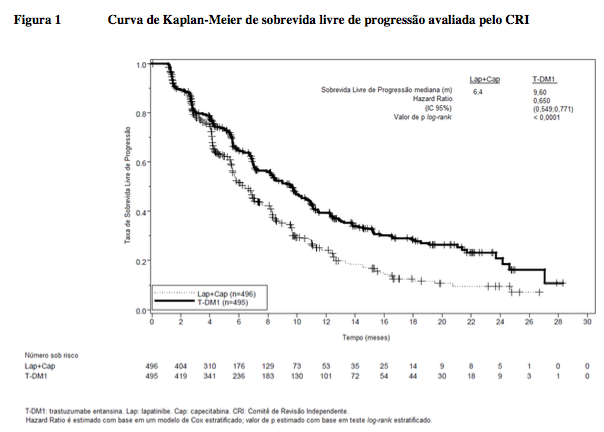
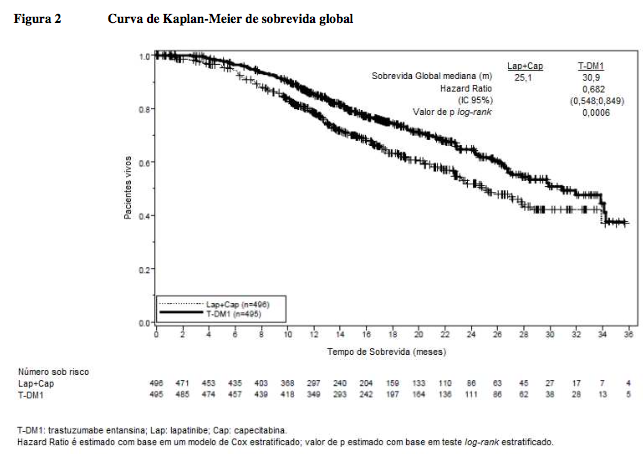
Os desfechos coprimários de eficácia do estudo foram sobrevida livre de progressão (SLP) avaliada por um comitê de revisão independente (CRI) e sobrevida global (SG) e porcentagens de sobrevida de referência (1 ano e 2 anos).
O tempo até progressão dos sintomas, definido por uma redução de 5 pontos no escore derivado do índice de evolução dos estudos – subescala mama (TOI-B) do questionário de Avaliação Funcional de Terapia de Câncer de Mama – Qualidade de Vida (FACT-B QoL) também foi avaliado durante o estudo clínico. Uma alteração de 5 pontos em TOI-B é considerada clinicamente significativa.
Tabela 1. Resumo de eficácia do estudo TDM4370g/BO21977 (EMILIA)
| Lapatinibe + capecitabina N = 496 | Trastuzumabe entansina | |
Desfechos primários | ||
SLP avaliada pelo CRI | ||
Número (%) de pacientes com evento | 304 (61,3%) | 265 (53,5%) |
Duração mediana de SLP (meses) | 6,4 | 9,6 |
Hazard ratio (estratificado*) | 0,650 | |
IC 95% para hazard ratio | (0,549, 0,771) | |
Valor de p (teste log-rank, estratificado*) | < 0,0001 | |
Sobrevida global (SG)** | ||
Número (%) de pacientes que foram a óbito | 182 (36,7%) | 149 (30,1%) |
Duração mediana de sobrevida (meses) | 25,1 | 30,9 |
Hazard ratio (estratificado*) | 0,682 | |
IC 95% para hazard ratio | (0,548, 0,849) | |
Valor de p (teste log-rank*) | 0,0006 | |
Taxa de sobrevida em 1 ano (IC 95%) | 78,4% (74,62, 82,26) | 85,2% |
Taxa de sobrevida em 2 anos (IC 95%) | 51,8% (45,92, 57,73) | 64,7% |
Desfechos-chave secundários | ||
SLP avaliada pelo investigador | ||
Número (%) de pacientes com evento | 335 (67,5%) | 287 (58,0%) |
Duração mediana de SLP (meses) | 5,8 | 9,4 |
HR (IC 95%) | 0,658 (0,560, 0,774) | |
Valor de p (teste log-rank*) | < 0,0001 | |
Taxa de resposta objetiva | ||
Pacientes com doença mensurável | 389 | 397 |
Número de pacientes com TRO (%) | 120 (30,8%) | 173 (43,6%) |
Diff, (IC 95%) | 12,7% (6,0%, 19,4%) | |
Valor de p (teste qui-quadrado Mantel-Haenszel*) | 0,0002 | |
Duração da resposta objetiva (meses) | ||
Número de pacientes com TRO | 120 | 173 |
IC 95% da mediana | 6,5 (5,45, 7,16) | 12,6 (8,38, 20,76) |
Tempo até a progressão do sintoma | ||
Número de pacientes passíveis de avaliação | 445 | 450 |
Número (%) de pacientes com evento | 257 (57,8%) | 246 (54,7%) |
Tempo mediano até o evento (meses) | 4,6 | 7,1 |
HR, IC 95% | 0,796 (0,667, 0,951) | |
Valor de p (teste log-rank*) | 0,0121 | |
SLP = sobrevida livre de progressão; TRO = taxa de resposta objetiva.
*Estratificado por região do mundo (Estados Unidos, Europa Ocidental, outra), número de esquemas quimioterápicos prévios para doença localmente avançada ou metastática (0-1 vs. > 1) e doença visceral vs. não visceral.
**A primeira análise interina de sobrevida global (SG) foi realizada durante a análise primária de SLP. Efeito terapêutico foi observado, mas o limite de eficácia pré-especificado ainda não havia sido ultrapassado. A segunda análise interina para SG foi conduzida quando 331 eventos de SG foram observados. Os resultados são apresentados nessa tabela.
O benefício do tratamento observado no subgrupo de pacientes que não haviam recebido, anteriormente, nenhuma terapia antineoplásica sistêmica no contexto metastático (n = 118), com hazard ratio para SLP de 0,51 (IC 95%: 0,30, 0,85) e para SG 0,61 (IC 95%: 0,32, 1,16). A mediana de SLP foi de 10,8 meses e de SG ainda não foi atingida para o grupo Trastuzumabe entansina, quando comparadas com os 5,7 e 27,9 meses, respectivamente, para o grupo lapatinibe e capecitabina.
Um estudo randomizado, multicêntrico, aberto, fase II (TDM4450g/BO21976) avaliou os efeitos de Trastuzumabe entansina versus trastuzumabe mais docetaxel em pacientes com câncer de mama HER2-positivo metastático que não receberam quimioterapia prévia para doença metastática. Os pacientes foram randomizados para receber Trastuzumabe entansina 3,6 mg/kg IV a cada 3 semanas (n = 67) ou trastuzumabe 8 mg/kg IV em dose de ataque seguida por 6 mg/kg IV a cada 3 semanas mais docetaxel 75-100 mg/m2 IV a cada 3 semanas (n = 70).
O desfecho primário foi SLP avaliada pelo investigador. A SLP mediana foi de 9,2 meses no braço trastuzumabe mais docetaxel e 14,2 meses no braço Trastuzumabe entansina (hazard ratio, 0,59; p = 0,035), com acompanhamento mediano de, aproximadamente, 14 meses nos dois braços. A TRO (taxa de resposta objetiva) foi de 58,0%, com trastuzumabe mais docetaxel e 64,2% com Trastuzumabe entansina. A duração mediana de resposta no braço controle foi de 9,5 meses e ainda não foi atingida com trastuzumaabe entansina.
A queda dos escores FACT-B TOI foi menor no braço com Trastuzumabe entansina em comparação com o braço controle (tempo mediano até a progressão dos sintomas foi de 7,5 meses no braço com Trastuzumabe entansina e 3,5 meses no braço controle; hazard ratio, 0,58; p = 0,022).
Um estudo fase II, aberto, de braço único (TDM4374g) avaliou os efeitos de Trastuzumabe entansina em pacientes com câncer de mama HER2-positivo localmente avançado não ressecável ou metastático. Todos os pacientes foram previamente tratados com terapias específicas para HER2 (trastuzumabe ou lapatinibe) e quimioterapia (antraciclina, taxano ou capecitabina) no contexto neoadjuvante, adjuvante, localmente avançado ou metastático. O número mediano de agentes antineoplásicos que os pacientes tinham recebido em qualquer contexto foi de 8,5 (intervalo de 5 a 19) e no contexto metastático foi de 7,0 (intervalo de 3 a 17), incluindo todos os agentes destinados ao tratamento do câncer de mama.
Os pacientes (n = 110) receberam 3,6 mg/kg de Trastuzumabe entansina via intravenosa a cada 3 semanas até a progressão da doença ou toxicidade inaceitável.
As análises-chave de eficácia foram TRO baseada na revisão radiológica independente e duração de resposta objetiva. A TRO foi de 32,7% (IC 95%: 24,1, 42,1), n = 36 respondedores, de acordo com revisão do CRI e do investigador. A duração mediana de resposta de acordo com o CRI ainda não foi atingida (IC 95%, 4,6 meses até não estimável).
Imunogenicidade
Assim como em todas as proteínas para fins terapêuticos, existe o potencial para uma resposta imune ao Trastuzumabe entansina. Dos 836 pacientes de seis estudos clínicos testados em diversos momentos para a resposta de anticorpos antiterapêuticos (ATAs) para Trastuzumabe entansina, 44 pacientes (5,3%) apresentaram teste positivo para anticorpos anti-Trastuzumabe entansina em um ou mais momentos após a infusão, sendo que 28 desses tiveram amostras de referência negativas. A significância clínica de anticorpos contra o Trastuzumabe entansina é ainda desconhecida.
Os resultados dos ensaios de imunogenicidade são altamente dependentes de diversos fatores, incluindo a sensibilidade, especificidade e metodologia dos ensaios, o manuseio das amostras, o tempo de coleta das amostras, o uso concomitante de medicamentos e a doença subjacente. Por essas razões, a comparação da incidência de anticorpos contra Trastuzumabe entansina com a de anticorpos contra outros produtos pode ser equivocada.
Características Farmacológicas
Propriedades farmacodinâmicas
Mecanismo de ação
Trastuzumabe entansina, é um conjugado de anticorpo-medicamento que tem HER2 como alvo e contém a IgG1 anti-HER2 humanizada, trastuzumabe, ligada de forma covalente com a droga inibitória de microtúbulo DM1 (um derivado de maitansina) por meio do ligante tioéter estável MCC (4-[N-maleimidometil] ciclohexano-1-carboxilato). Entansina diz respeito ao complexo MCC-DM1. Em média, 3,5 moléculas de DM1 são conjugadas a cada molécula de trastuzumabe.
A conjugação de DM1 a trastuzumabe confere seletividade do agente citotóxico para células tumorais que superexpressam HER2, aumentando assim a veiculação intracelular de DM1 diretamente às células malignas. Com a ligação ao HER2, Trastuzumabe entansina sofre internalização mediada por receptor e subsequente degradação lisossomal, resultando na liberação de catabólitos citotóxicos contendo DM1 (principalmente lisina-MCC-DM1).
Trastuzumabe entansina tem os mecanismos de ação de trastuzumabe e DM1.
- Trastuzumabe entansina, como o trastuzumabe, liga-se ao subdomínio IV do domínio extracelular HER2 (DEC), bem como a receptores Fcγ e complemento C1q. Além disso, Trastuzumabe entansina, como trastuzumabe, inibe a dispersão do DEC de HER2, inibe a sinalização por meio da via da fosfatidilinositol 3-quinase (PI3-K) e faz a mediação de citotoxicidade celular por meio de anticorpos (ADCC) em células de câncer de mama humano que superexpressam HER2.
- DM1, o componente citotóxico de Trastuzumabe entansina, liga-se à tubulina. Pela inibição da polimerização da tubulina, tanto DM1 quanto Trastuzumabe entansina fazem com que as células parem na fase G2/M do ciclo celular, finalmente levando à apoptose da célula. Os resultados de ensaios de citotoxicidade in vitro mostram que DM1 é de 20 a 200 vezes mais potente que os taxanos e alcaloides da vinca.
- O ligante MCC é projetado para limitar a liberação sistêmica e aumentar e direcionar a veiculação de DM1, como demonstrado pela detecção de níveis muito baixos de DM1 livre no plasma.
Propriedades farmacocinéticas
Absorção
Trastuzumabe entansina é administrado por via intravenosa. Não foram feitos estudos com outras vias de administração.
Distribuição
Trastuzumabe entansina, quando administrado por via intravenosa a cada 3 semanas, apresentou farmacocinética linear entre doses, variando de 2,4 a 4,8 mg/kg. Pacientes que receberam doses menores ou iguais a 1,2 mg/kg apresentaram uma depuração plasmática mais rápida.
Pacientes no estudo TDM4370g/BO21977 que receberam 3,6 mg/kg do medicamento via intravenosa a cada 3 semanas apresentaram concentração sérica máxima (Cmáx) de Trastuzumabe entansina de 83,4 (+ 16,5) μg/mL. Com base em análise de farmacocinética populacional, depois da administração intravenosa, o volume central de distribuição de Trastuzumabe entansina foi de 3,13 L e se aproximou do volume plasmático.
Metabolismo
Espera-se que Trastuzumabe entansina sofra catabolismo por meio de proteólise em lisossomos celulares, sem nenhum envolvimento significativo de isoenzimas do citocromo P450. Catabólitos, incluindo Lys-MCC-DM1, MCC-DM1 e DM1, são detectados em baixos níveis em plasma humano. No Estudo TDM4370g/BO21977, a média dos níveis máximos de DM1 no Ciclo 1, depois da administração de Trastuzumabe entansina, foi constantemente baixa e foi em média 4,61 + 1,61 ng/mL.
Estudos de metabolismo in vitro em microssomos hepáticos humanos sugerem que DM1, um componente de Trastuzumabe entansina, seja metabolizado principalmente por CYP3A4 e, em menor extensão, por CYP3A5.
Eliminação
Com base na análise farmacocinética (PK) populacional, depois da administração intravenosa de Trastuzumabe entansina em pacientes com câncer de mama HER2-positivo metastático, a eliminação de Trastuzumabe entansina foi de 0,68 L/dia e a meia-vida de eliminação (t1/2) foi de, aproximadamente, 4 dias. Nenhum acúmulo de Trastuzumabe entansina foi observado depois de administração repetida de infusão intravenosa a cada 3 semanas.
Com base em análise de PK populacional (n = 671), peso corpóreo, albumina, soma de maior diâmetro de lesões-alvo por Critérios de Avaliação de Resposta em Tumores Sólidos (RECIST), domínio extracelular de dispersão HER2 (DEC), concentrações basais de trastuzumabe e AST foram identificados como covariáveis estatisticamente significativas para parâmetros farmacocinéticos de Trastuzumabe entansina. No entanto, a magnitude do efeito dessas covariáveis sobre exposição a Trastuzumabe entansina sugere que, com exceção do peso corpóreo, é improvável que essas covariáveis tenham algum efeito clinicamente significativo sobre a exposição a Trastuzumabe entansina. Portanto, o peso corpóreo, baseado na dose de 3,6 mg/kg a cada 3 semanas sem a correção para as outras covariáveis, é considerado apropriado. Em estudos não clínicos, catabólitos de Trastuzumabe entansina, incluindo DM1, Lys-MCC-DM1 e MCC- DM1, são principalmente excretados na bile com eliminação mínima na urina.
Farmacocinética em populações especiais
A análise farmacocinética populacional de Trastuzumabe entansina mostrou que a etnia não parece influenciar a farmacocinética de Trastuzumabe entansina. Como a maioria dos pacientes nos estudos clínicos de Trastuzumabe entansina era mulheres, o efeito do sexo sobre a farmacocinética de Trastuzumabe entansina não foi avaliado formalmente.
Uso em idosos
A análise farmacocinética populacional de Trastuzumabe entansina mostrou que a idade não afetou a farmacocinética do medicamento. Nenhuma diferença significativa foi observada na farmacocinética de Trastuzumabe entansina entre pacientes < 65 anos (n = 577), pacientes entre 65 e 75 anos (n = 78) e pacientes > 75 anos (n = 16).
Insuficiência renal
A análise farmacocinética populacional de Trastuzumabe entansina mostrou que a depuração plasmática de creatinina não afeta a farmacocinética de Trastuzumabe entansina. A farmacocinética de Trastuzumabe entansina em pacientes com insuficiência renal leve [depuração plasmática de creatinina (CLcr) 60 – 89 mL/min, n = 254] ou moderada (CLcr 30 a 59 mL/min, n = 53) foi similar à de pacientes com função renal normal (CLcr > 90 mL/min, n = 361). Dados farmacocinéticos em pacientes com insuficiência renal grave (CLcr 15 a 29 mL/min) são limitados (n = 1); portanto, nenhuma recomendação de dose pode ser feita.
Insuficiência hepática
Nenhum estudo farmacocinético formal foi conduzido em pacientes com insuficiência hepática.
Segurança pré-clínica
Carcinogenicidade
O Trastuzumabe entansina não foi testado para carcinogenicidade.
Mutagenicidade
Não se observou nenhuma evidência de atividade mutagênica em um ensaio de mutação bacteriana reversa in vitro de DM1. Em um ensaio de micronúcleo in vivo de Trastuzumabe entansina em macacos cynomolgus, não foi observada nenhuma evidência de dano cromossômico em células de medula óssea. No entanto, em ensaio de micronúcleo em medula óssea de rato, DM1 foi positivo para formação de micronúcleos depois de uma dose única baixa na faixa de concentração de DM1 medida em seres humanos que recebiam Trastuzumabe entansina, confirmando que Trastuzumabe entansina é um aneugênio e/ou clastogênio.
Comprometimento da fertilidade
Estudos dedicados a fertilidade não foram conduzidos com Trastuzumabe entansina. No entanto, com base nos resultados de estudos de toxicidade geral em animais, podem ser esperados efeitos adversos sobre a fertilidade.
Teratogenicidade
Estudos dedicados ao desenvolvimento embriofetal não foram conduzidos com Trastuzumabe entansina em animais. Toxicidade de trastuzumabe para o desenvolvimento foi identificada no contexto clínico, embora não fosse prevista no programa não clínico. Além disso, a toxicidade de maitansina para o desenvolvimento foi identificada em estudos não clínicos, o que sugere que DM1, o componente maitansinoide citotóxico de Trastuzumabe entansina, inibidor de microtúbulos, será também teratogênico e potencialmente embriotóxico.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)