Qual a ação da substância do IVB Insulina Humana R?
Resultados de Eficácia
Visão geral dos estudos clínicos de Insulina Humana para diabetes mellitus
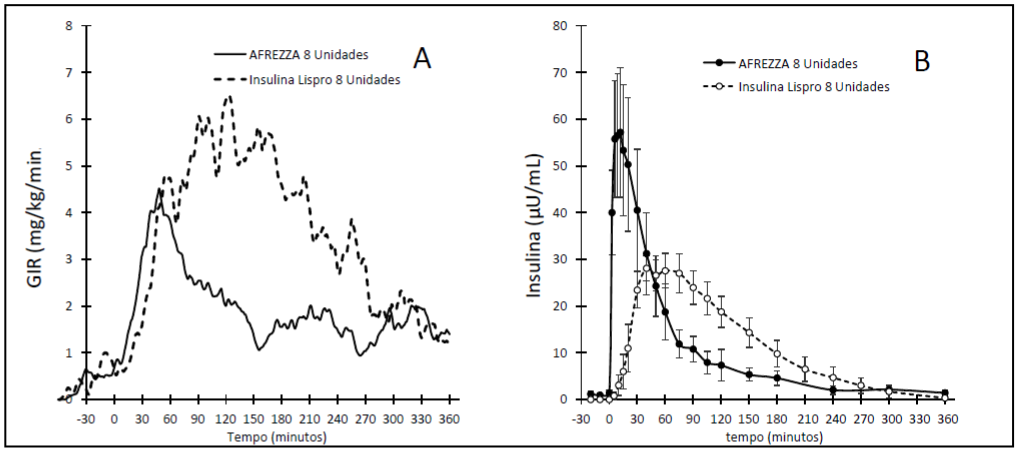
Insulina Humana foi estudado em adultos com diabetes tipo 1 em combinação com insulina basal. A eficácia de Insulina Humana em pacientes com diabetes tipo 1 foi comparada com a de insulina asparte em combinação com insulina basal. Insulina Humana foi estudado em pacientes adultos com diabetes tipo 2 em combinação com antidiabéticos orais. A eficácia de Insulina Humana em pacientes com diabetes tipo 2 foi comparada com inalação de placebo.
Diabetes tipo 1
Pacientes com diabetes tipo 1 inadequadamente controlada participaram em um estudo de 24 semanas, aberto, controlado ativamente para avaliar o efeito redutor da glicemia prandial de Insulina Humana usado em combinação com insulina basal. Seguindo um período de 4 semanas de otimização da insulina basal, 344 pacientes foram randomizados para Insulina Humana (n=174) ou insulina asparte (n=170) administrados em cada refeição do dia.
Doses de insulina prandial foram tituladas para as metas glicêmicas nas primeiras 12 semanas e mantidas estáveis nas últimas 12 semanas do estudo. Na semana 24, o tratamento com insulina basal e Insulina Humana prandial demonstrou uma redução média da HbA1c que atingiu a margem de não inferioridade pré-especificada de 0,4%.
Insulina Humana proporcionou redução de HbA1c menor que a da insulina asparte e a diferença foi estatisticamente significativa. Mais voluntários no grupo insulina asparte alcançaram a meta de HbA1c ≤7% (Tabela 1).
Tabela 1. Resultados na Semana 24 do estudo controlado ativamente de Insulina Humana prandial mais insulina basal em adultos com diabetes tipo 1
Parâmetro de eficácia | Insulina Humana + insulina basal (N=174) | Insulina Asparte + insulina basal |
HbA1c (%) | ||
Linha basal (média ajustadaa) | 7,94 | 7,92 |
Mudança em relação à linha basal (média ajustadaa,b) | -0,21 | -0,40 |
Diferença em relação à insulina asparte (média ajustadaa,b) | 0,19 | |
Percentual de pacientes alcançando HbA1c ≤ 7%c | 13,8 | 27,1 |
Glicemia plasmática em jejum (mg/dL) | ||
Linha basal (média ajustadaa) | 153,9 | 151,6 |
Mudança em relação à linha basal (média ajustadaa, b) | -25,3 | 10,2 |
Diferença em relação à insulina asparte (média ajustadaa, b) | -35,4 | |
a Média ajustada foi obtida usando uma abordagem de Medições Repetidas de Modelo Misto (MRMM) com HbA1c ou glicose plasmática em jejum como a variável dependente e tratamento, visita, região, estrato de insulina basal, e interação do tratamento por visita como fatores fixos e linha basal correspondente como covariável. Uma estrutura de covariância de autorregressão (1) [AR(1)] foi usada.
b Dados de 24 semanas estavam disponíveis para 131 (75%) e 150 (88%) dos voluntários randomizados dos grupos de Insulina Humana e insulina asparte, respectivamente.
c O percentual foi calculado com base no número de pacientes randomizados no estudo.
Referência Bibliográfica:
Bode BW et al. Inhaled Technosphere Insulin Compared With Injected Prandial Insulin in Type 1 Diabetes: A Randomized 24-Week Trial. Diabetes Care. 2015 Dec; 38(12):2266-73. doi: 10.2337/dc15-0075. Epub 2015 Jul 15. TRIAL REGISTRATION: ClinicalTrials.gov NCT01445951.
Diabetes tipo 2
Um total de 479 pacientes adultos com diabetes tipo 2 inadequadamente controlados com doses ótimas/máximas toleradas de metformina apenas, ou 2 ou mais agentes antidiabéticos orais (OAD) participaram em um estudo de 24 semanas, duplo cego, controlado com placebo. Após um período introdutório de 6 semanas, 353 pacientes foram randomizados para Insulina Humana (n=177) ou pó inalável placebo sem insulina (n=176). Doses de insulina foram tituladas durante as primeiras 12 semanas e mantidas estáveis nas últimas 12 semanas do estudo. Doses de antidiabéticos orais foram mantidas estáveis. Na semana 24, o tratamento com Insulina Humana mais antidiabéticos orais proporcionou uma redução média da HbA1c que foi estatisticamente significante maior quando comparada com a redução de HbA1c observada no grupo placebo (Tabela 2).
Tabela 2. Resultados na Semana 24 em um estudo controlado por placebo de Insulina Humana em adultos com diabetes tipo 2 inadequadamente controlados com agentes antidiabéticos orais
Parâmetro de eficácia | Insulina Humana + Agentes antidiabéticos orais (N=177) | Placebo + Agentes antidiabéticos orais |
HbA1c (%) | ||
Linha basal (média ajustadaa) | 8,25 | 8,27 |
Mudança em relação à linha basal (média ajustadaa,b) | -0,82 | -0,42 |
Diferença em relação ao placebo (média ajustadaa,b) | -0,40 | |
Percentual (%) de pacientes alcançando HbA1C ≤7%c | 32,2 | 15,3 |
Glicemia plasmática em jejum (mg/dL) | ||
Linha basal (média ajustadaa) | 175,9 | 175,2 |
Mudança da linha basal (média ajustadaa,b) | -11,2 | -3,8 |
Diferença em relação ao placebo (média ajustadaa,b) | -7,4 | |
a Média ajustada foi obtida usando uma abordagem de Medições Repetidas de Modelo Misto (MRMM) com HbA1c ou glicose plasmática em jejum como a variável dependente e tratamento, visita, região e interação do tratamento por visita como fatores fixos, e linha basal correspondente como covariável. Uma estrutura de covariância de autorregressão (1) [AR(1)] foi usada.
b Dados de 24 semanas sem terapia de resgate estavam disponíveis para 139 (79%) e 129 (73%) dos voluntários randomizados dos grupos de Insulina Humana e placebo, respectivamente.
c O percentual foi calculado com base no número de pacientes randomizados no estudo.
Referência bibliográfica:
Rosenstock J et al. Inhaled Technosphere Insulin Versus Inhaled Technosphere Placebo in Insulin-Naïve Subjects With Type 2 Diabetes Inadequately Controlled on Oral Antidiabetes Agents. Diabetes Care. 2015 Dec;38(12):2274-81. doi: 10.2337/dc15-0629. Epub 2015 Aug 7. TRIAL REGISTRATION: ClinicalTrials.gov NCT01451398.
Características Farmacológicas
Mecanismo de ação
A insulina diminui os níveis da glicose sanguínea ao estimular a captação de glicose periférica pelos músculos esqueléticos e gorduras, e ao inibir a produção hepática de glicose. A insulina inibe a lipólise nos adipócitos, inibe a proteólise e aumenta a síntese de proteína.
Farmacodinâmica
O curso do tempo da ação da insulina (ou seja, redução da glicose) pode variar consideravelmente em indivíduos diferentes ou no mesmo indivíduo. O perfil farmacodinâmico médio [isto é, o efeito de redução da glicose medido pela taxa de infusão de glicose (GIR) ao longo do tempo em um estudo de clamp euglicemico] para uma única dose de 4, 12 e 48 unidades de Insulina Humana em 30 pacientes com diabetes tipo 1 é mostrado na Figura 1 (A), e as principais características em torno do tempo dos efeitos estão descritas na Tabela 3.
Tabela 3. Tempo de efeito de insulina (ou seja, efeito farmacodinâmico médio) após administração de uma dose única de 4, 12 e 48 unidades de Insulina Humana em pacientes (N = 30) com T1DM e correspondente aos dados mostrados na Figura 1 (A)
Parâmetros do efeito da insulina | Insulina Humana 4 unidades | Insulina Humana 12 unidades | Insulina Humana 48 unidades |
Tempo para o primeiro efeito mensurável | ~ 12 minutos | ~ 12 minutos | ~ 12 minutos |
Tempo para atingir o pico | ~ 35 minutos | ~ 45 minutos | ~ 55 minutos |
Tempo para o efeito retornar a linha de base | ~ 90 minutos | ~ 180 minutos | ~ 270 minutos |
Figura 1. Efeito médio da insulina (taxa de infusão de glicose corrigida pela linha de base, A) e perfil farmacocinético (concentrações de insulina no soro corrigidas pela linha de base, B) após administração de Insulina Humana 4, 12 e 48 unidades em pacientes com diabetes tipo 1 (N = 30)
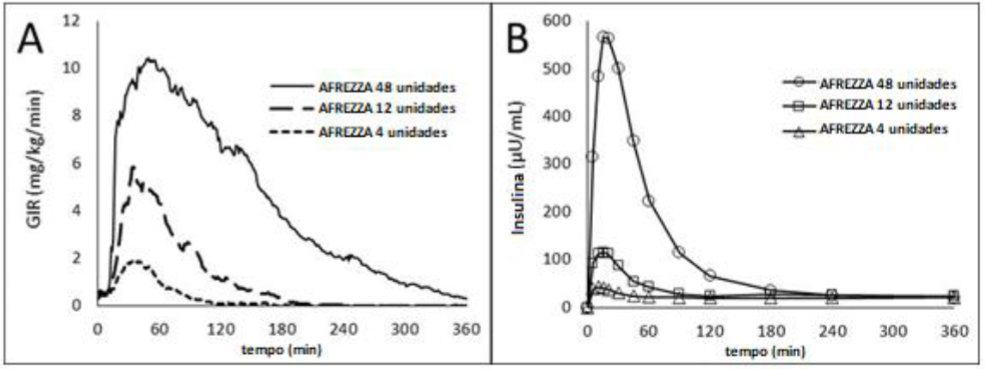
Em média, o efeito farmacodinâmico de Insulina Humana, medido como área sob a curva de infusão de glicose - curva de tempo (ASC-GIR) aumentou linearmente com doses de até 48 unidades (106, 387 e 1581 mg / kg para doses de 4, 12 e 48 unidades, respectivamente).
A variabilidade intra-paciente na ASC GIR e GIRmax é de aproximadamente 28% (95% IC 21-42%) e 27% (95% IC 20-40%), respectivamente.
Farmacocinética
Absorção
Os perfis farmacocinéticos de Insulina Humana 4, 12 e 48 unidades de um estudo em 30 pacientes com diabetes tipo 1 são mostrados na Figura 3 (B). O tempo até a concentração máxima de insulina sérica varia de 10 a 20 minutos após a inalação oral de 4 a 48 unidades de Insulina Humana. As concentrações séricas de insulina diminuíram para a linha de base em aproximadamente 60 a 240 minutos para esses níveis de dose.
Disposição
Disposição sistêmica de insulina (meia-vida terminal aparente) após inalação oral de 4 a 48 unidades de Insulina Humana foi de 120-206 minutos.
Proporcionalidade da dose
A exposição à insulina (ASC) demonstrou ser proporcional à dose ao usar doses de até 48 unidades de Insulina Humana.
Variabilidade
A variabilidade intra-paciente na exposição à insulina medida pela ASC e Cmax é de aproximadamente 16% (95% IC 12-23%) e 21% (95% IC 16-30%), respectivamente.
Metabolismo e eliminação
O metabolismo e a eliminação de Insulina Humana são comparáveis à insulina humana regular.
Partículas carreadoras
Estudos de farmacologia clínica mostraram que partículas carreadoras não são metabolizadas e são eliminadas inalteradas na urina após absorção pelo pulmão. Após a inalação oral de Insulina Humana, uma média de 39% de dose inalada das partículas carreadoras foi distribuída para os pulmões e uma média de 7% da dose foi engolida. A fração engolida não foi absorvida pelo trato gastrointestinal e foi eliminada inalterada nas fezes.
Dados de Segurança Pré-Clínicos
Carcinogênese, Mutagênese e Distúrbios de Fertilidade
Em um estudo de carcinogenicidade de 104 semanas, ratos receberam doses até 46 mg/kg/ dia da partícula carreadora e de até 1,23 mg/kg/ dia de insulina, por via inalatória apenas. Não foi observada incidência aumentada de tumores com exposições sistêmicas equivalentes à insulina, numa dose diária máxima de Insulina Humana de 99 mg, com base numa comparação das áreas de superfície corporal relativas entre as espécies.
Nenhum aumento na incidência de tumores foi observado em um estudo de carcinogenicidade de 26 semanas, em camundongos transgênicos (Tg-ras-H2) que receberam doses de até 75 mg/kg/dia da partícula carreadora e até 5 mg/ kg/ dia de Insulina Humana. Nenhum aumento da incidência de tumores foi observado. Insulina Humana não foi genotóxico no ensaio de mutagenicidade bacteriana de Ames e no ensaio de aberração cromossômica, utilizando linfócitos periféricos humanos com ou sem ativação metabólica. A partícula transportadora sozinha não foi genotóxica no ensaio de micronúcleos de camundongos in vivo.
Em ratas fêmeas que receberam doses subcutâneas de 10, 30 e 100 mg/kg/dia de partícula carreadora (veículo sem insulina) começando duas semanas antes do acasalamento até o dia 7 da gestação, não houve efeitos adversos na fertilidade masculina em doses até 100 mg/kg/dia (uma exposição sistêmica 14-21 vezes maior que a dose máxima diária de Insulina Humana de 99 mg com base na AUC). Em ratas fêmeas houve um aumento da perda pré e pós-implantação a 100 mg/kg/dia, mas não a 30 mg/kg/dia (exposição sistémica 14-21 vezes superior à dose diária máxima de Insulina Humana de 99 mg com base na AUC).

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)