Qual a ação da substância do Hemcibra?
Resultados de Eficácia
A eficácia de Emicizumabe para profilaxia de rotina em pacientes com hemofilia A com inibidores de FVIII foi avaliada em dois ensaios clínicos: um estudo em pacientes adultos e adolescentes (HAVEN 1) e um estudo pediátrico (HAVEN 2).
HAVEN 11,6
O estudo HAVEN 1, estudo clínico randomizado, multicêntrico, aberto que incluiu 109 adolescentes e adultos do sexo masculino (idade ≥12 anos e > 40kg) com hemofilia A com inibidores do fator VIII que tinham recebido previamente tratamento episódico ou profilático com agentes de bypass. No estudo, os pacientes receberam profilaxia semanal com Emicizumabe (braços A, C e D) – doses de 3 mg/kg, uma vez por semana durante quatro semanas, seguido por doses de 1,5 mg/kg, uma vez por semana subsequentemente – ou nenhuma profilaxia (braço B). Os pacientes randomizados para o braço B puderam trocar para profilaxia com Emicizumabe após completarem pelo menos 24 semanas sem profilaxia.
Foi permitido aumento de dosagem para 3 mg/kg, uma vez por semana, depois de 24 semanas sob profilaxia com Emicizumabe para pacientes que apresentaram dois ou mais sangramentos qualificados, em caso de eficácia abaixo da ideal (isto é, ≥ dois sangramentos espontâneos e clinicamente significativos que ocorreram no estado de equilíbrio). Durante o estudo, cinco pacientes foram submetidos ao aumento de sua dose de manutenção para 3 mg/kg, uma vez por semana.
Cinquenta e três pacientes previamente tratados com agentes de bypass de forma episódica foram randomizados em uma razão de 2:1 para receberem profilaxia com Emicizumabe (braço A) ou nenhuma profilaxia, (braço B), com estratificação pela taxa de sangramento nas últimas 24 semanas (< 9 ou ≥ 9).
Quarenta e nove pacientes previamente tratados com agentes de bypass profiláticos foram incluídos no braço C para receberem profilaxia com Emicizumabe. Sete pacientes previamente tratados de forma episódica com agentes de bypass que tinham participado de estudo não intervencional (ENI) antes do recrutamento, mas não puderam ser incluídos no estudo HAVEN 1 antes do fechamento dos braços A e B, foram incluídos no braço D, para receberem profilaxia com Emicizumabe.
O objetivo primário do estudo foi avaliar, entre pacientes previamente tratados de forma episódica com agentes de bypass, o efeito do tratamento profilático semanal com Emicizumabe, em comparação com ausência de profilaxia (braço A versus braço B) sobre o número de sangramentos com necessidade de tratamento com fatores de coagulação ao longo do tempo (mínimo de 24 semanas ou data de descontinuação). Outros objetivos secundários da comparação randomizada dos braços A e B foram a eficácia da profilaxia com Emicizumabe semanal na redução do número de todos os sangramentos, dos sangramentos espontâneos, sangramentos articulares e sangramentos em articulações-alvo, bem como avaliar a qualidade de vida relacionada à saúde dos pacientes (QVRS) e seu estado de saúde.
A eficácia da profilaxia com Emicizumabe semanal, em comparação com agentes de bypass profiláticos prévios também foi avaliado em pacientes que tinham participado do ENI antes da inclusão (braço C). Apenas pacientes do ENI foram incluídos nessa comparação, porque os dados de sangramento e tratamento foram coletados com o mesmo grau de granularidade que o usado no estudo HAVEN 1.
Resultados de eficácia do estudo HAVEN 11,6
Os resultados de eficácia da profilaxia com Emicizumabe comparados com nenhuma terapia profilática, relacionados à taxa de sangramentos tratados, todos os sangramentos, sangramentos espontâneos tratados, sangramento articular tratado e sangramento das articulações alvo tratadas são mostrados na Tabela 1.
Tabela 1 – HAVEN 1: Taxa de sangramento anualizada com braço de profilaxia com Emicizumabe versus braço com ausência de profilaxia em pacientes ≥ 12 anos de idade com inibidores ao fator VIII
Endpoint | Braço B - Sem profilaxia | Braço A - Emicizumabe 1,5 mg/kg semanal |
| - | n = 18 | n = 35 |
Sangramentos tratados | ||
TSA (IC de 95%) | 23,3 (12,33; 43,89) | 2,9 (1,69; 5,02) |
% de redução (IC de 95%), valor de p | 87% (72,3%, 94,3%), < 0,0001 | |
% de pacientes com 0 sangramento (IC de 95%) | 5,6 (0,1; 27,3) | 62,9 (44,9; 78,5) |
TSA mediana (IQR) | 18,8 (12,97; 35,08) | 0 (0; 3,73) |
Todos os sangramentos | ||
TSA (IC de 95%) | 28,3 (16,79; 47,76) | 5,5 (3,58; 8,60) |
% de redução (IC de 95%), valor de p | 80% (62,5%, 89, 8%), < 0,0001 | |
% de pacientes com 0 sangramento (IC de 95%) | 5,6 (0,1; 27,3) | 37,1 (21,5; 55,1) |
Mediana de TSA (IQR) | 30,2 (18,3; 39,4) | 2 (0; 9,9) |
Sangramentos espontâneos tratados | ||
TSA (IC de 95%) | 16,8 (9,94; 28,30) | 1,3 (0,73; 2,19) |
% de redução (IC de 95%), valor de p | 92% (84,6%; 96,3%), < 0,0001 | |
% de pacientes com 0 sangramento (IC de 95%) | 11,1 (1,4; 34,7) | 68,6 (50,7; 83,1) |
Mediana de TSA (IQR) | 15,2 (6,6; 30,4) | 0 (0; 3,3) |
Sangramentos articulares tratados | ||
TSA (IC de 95%) | 6,7 (1,99; 22,42) | 0,8 (0,26; 2,20) |
% de redução (IC de 95%), valor de p | 89% (48%; 97,5%), 0,0050 | |
% de pacientes com 0 sangramento (IC de 95%) | 50,0 (26,0; 74,0) | 85,7 (69,7; 95,2) |
Mediana de TSA (IQR) | 1 (0; 14,4) | 0 (0;0) |
Sangramentos de articulações-alvo tratados | ||
TSA (IC de 95%) | 3,0 (0,96; 9,13) | 0,1 (0,03; 0,58) |
% de redução (IC de 95%), valor de p | 95% (77,3%; 99,1%), 0,0002 | |
% de pacientes com 0 sangramento (IC de 95%) | 50,0 (26,0; 74,0) | 94,3 (80,8; 99,3) |
Mediana de TSA (IQR) | 1 (0;6,5) | 0 (0;0) |
Intervalo de confiança derivam do modelo de regressão binomial negativa (NBR) e o valor de p do teste estratificado de Wald, comparando a taxa de sangramento entre os braços especificados.
Braço B: inclui apenas período sem profilaxia.
Definições de sangramento adaptadas com base nos critérios ISTH.
Sangramentos tratados = sangramentos tratados com agentes de bypass.
Todos os sangramentos = sangramentos tratados e não tratados com agentes de bypass.
Inclui apenas dados antes do aumento da dose para os pacientes cuja dose foi aumentada por titulação.
Pacientes expostos a Emicizumabe começaram com uma dose de ataque de 3 mg/kg/semana, durante quatro semanas TSA = taxa de sangramento anualizada; IC = intervalo de confiança; IQR = intervalo interquartis, percentil 25º até percentil 75º.
Análises adicionais foram realizadas para o estudo HAVEN 1 a fim de avaliar o controle a longo prazo dos sangramentos em pacientes tratados profilaticamente com o Emicizumabe usando o intervalo de tratamento de 12 semanas até a semana 72. Quando a TSA para hemorragias tratadas foi avaliada em intervalos de 12 semanas, as TSAs médias diminuíram ao longo do tempo e a melhoria durou até a semana 72, enquanto a mediana permaneceu consistentemente em zero (ver Tabela 2). Estes dados demonstram a eficácia a longo prazo da profilaxia com o Emicizumabe. As médias e medianas de TSA foram calculadas para hemorragias tratadas, conforme mostrado na Tabela 2.
Tabela 2 – HAVEN 1: Taxa de sangramento anualizada de profilaxia com Emicizumabe por intervalo de 12 semanas em pacientes ≥ 12 anos de idade com inibidores de fator VIII

Na análise intrapaciente do estudo clínico HAVEN 1, a profilaxia com Emicizumabe resultou em uma redução estatisticamente significativa (p = 0,0003) (79%) na taxa de sangramento para sangramentos tratados em comparação com a profilaxia do agente de bypass anteriormente coletada no ENI antes do recrutamento (Tabela 3).
Tabela 3 – HAVEN 1: Comparação intrapaciente da taxa de sangramento anualizada (sangramentos tratados) para profilaxia com Emicizumabe, versus profilaxia prévia com agente de bypass
Endpoint | Braço CENI - Profilaxia prévia com agente de bypass | Braço C - Emicizumabe 1,5 mg/kg semanal |
| - | n = 24 | n = 24 |
Mediana do período de eficácia (semanas) | 32,1 | 30,1 |
Sangramentos Tratados | ||
TSA (IC de 95%) | 15,7 (11,08; 22,29) | 3,3 (1,33; 8,08) |
% redução (IC de 95%), valor de p | 79% (51,4%; 91,1%), 0,0003 | |
% pacientes com zero sangramento (95% IC) | 12,5 (2,7; 32,4) | 70,8 (48,9; 87,4) |
Mediana de TSA (IQR) | 12,0 (5,73; 24,22) | 0,0 (0,00; 2,23) |
Intervalo de confiança derivam do modelo de regressão binomial negativa (NBR) e o valor de p do teste estratificado de Wald, comparando a taxa de sangramento entre os braços especificados.
Dados comparativos intrapaciente a partir do estudo não intervencional (ENI) BH29768.
Apenas pacientes que participaram do ENI BH29768 e do estudo BH29884 foram incluídos.
Inclui apenas dados antes do aumento da dose para os pacientes cuja dose foi aumentada por titulação.
Sangramentos tratados: sangramentos tratados com agentes de bypass.
Definições de sangramento adaptadas com base nos critérios ISTH.
TSA = taxa de sangramento anualizada; IC = intervalo de confiança; IQR = intervalo interquartis, percentil 25º até percentil 75º.
Resultados relacionados à saúde no estudo HAVEN 11
No estudo HAVEN 1, a qualidade de vida relacionada à saúde (QVRS) em pacientes com 18 anos de idade ou mais foi avaliada na semana 25, com base no questionário para adultos Haemophilia-specific Quality of Life (Haem-A-QoL) (consulte a Tabela 4).
Tabela 4 – HAVEN 1: Mudança nos escores de saúde física Haem-A-QoL para profilaxia com Emicizumabe versus sem profilaxia na semana 25 em pacientes (> 18 anos) com inibidores ao Fator VIII
Escores Haem-A-QoL na semana 25 | Braço B - Sem profilaxia | Braço A - Emicizumabe 1,5 mg/kg semanal |
(n = 16) | (n = 31) | |
Pontuação total (faixa 0 – 100) | ||
N | 14a | 25a |
Média ajustada | 43,21 | 43,21 |
Diferença nas médias ajustadas (IC de 95%) | 43,21 | |
Valor de p | 0,0019 | |
Saúde física | ||
N | 14a | 25a |
Média ajustada | 54,17 | 32,61 |
Diferença nas médias ajustadas (IC de 95%) | 21,55 (7,89; 35,22) | |
Valor de p | 0,0029 | |
Braço B: inclui apenas período sem profilaxia.
Inclui apenas dados antes do aumento da dose para os pacientes cuja dose foi aumentada por titulação.
Pacientes expostos a Emicizumabe começaram com uma dose de ataque de 3 mg/kg/semana, durante quatro semanas.
Os escores menores refletem melhor HRQoL.
Diferença clinicamente significativa: pontuação total: 7 pontos; saúde física: 10 pontos.
a Apenas pacientes ≥ 18 anos completaram o questionário Haem-A-QoL.
Resultados sobre estado de saúde do estudo HAVEN 11
No estudo HAVEN 1, o estado de saúde dos pacientes foi avaliado de acordo com o EuroQoL Five-Dimension-Five Levels Questionnaire (EQ-5D-5L), que é uma medida válida e confiável de estado de saúde (consulte a Tabela 5).
Tabela 5 – HAVEN 1: escores EQ-5D-5L na semana 25
Escores EQ-5D-5L na semana 5 | Braço B - Sem profilaxia | Braço A - Emicizumabe 1,5 mg/kg semanal |
(n = 18) | (n = 35) | |
Escala de analogia visual (EAV) | ||
N | 16 | 29 |
Média ajustada | 74,36 | 84,08 |
Diferença nas médias ajustadas (IC de 95%) - | -9,72 (-17,62; -1,82) | |
Valor de p | 0,0171 | |
Pontuação de utilidade do índice | ||
N | 16 | 29 |
Média ajustada | 0,65 | 0,81 |
Diferença nas médias ajustadas (IC de 95%) | -0,16 (-0,25; -0,07) | |
Valor de p | 0,0014 | |
Braço B: inclui apenas período sem profilaxia.
Inclui apenas dados antes do aumento da dose para os pacientes cuja dose foi aumentada por titulação.
Pacientes expostos a Emicizumabe começaram com uma dose de ataque de 3 mg/kg/semana, durante quatro semanas.
As pontuações mais altas indicam melhor qualidade de vida.
Diferença clinicamente significativa: EAV: 7 pontos; pontuação de utilidade do índice: 0,07 ponto.
Estudos Clínicos em Pacientes Pediátricos
HAVEN 2 (análise interina)2,4,5
A profilaxia semanal com Emicizumabe foi avaliada em um estudo clínico aberto, de braço único, multicêntrico que incluía pacientes pediátricos (idade < 12 anos ou de 12 a 17 anos com peso < 40 kg) com hemofilia A com inibidores do fator VIII. Os pacientes receberam profilaxia com Emicizumabe na dose de 3 mg/kg, uma vez por semana, durante as primeiras quatro semanas, seguidos por 1,5 mg/kg, uma vez por semana subsequentemente.
O estudo avaliou a farmacocinética, a segurança e a eficácia, que incluía a eficácia da profilaxia semanal com Emicizumabe, em comparação com o tratamento episódico e o tratamento profilático com agentes de bypass em pacientes que tinham participado do ENI antes do recrutamento (comparação intrapaciente).
Estudo HAVEN 2: resultados de eficácia (análise interina)2,4,5
No momento da análise interina, a eficácia foi avaliada em 59 pacientes pediátricos com idade <12 anos e recebendo profilaxia semanal com o Emicizumabe por pelo menos 12 semanas, incluindo 38 pacientes com idade entre 6 e <12 anos; 17 pacientes com idade entre 2 e <6 anos e quatro pacientes <2 anos de idade.
A taxa de sangramento anualizada e a porcentagem de pacientes sem sangramentos foram calculadas para 59 pacientes. A mediana do período de observação para estes pacientes foi de 29,6 semanas (intervalo: 18,4 - 63).
Tabela 6 – HAVEN 2: Taxa de sangramento anualizada de profilaxia com Emicizumabe em pacientes pediátricos <12 anos de idade (análise interina)
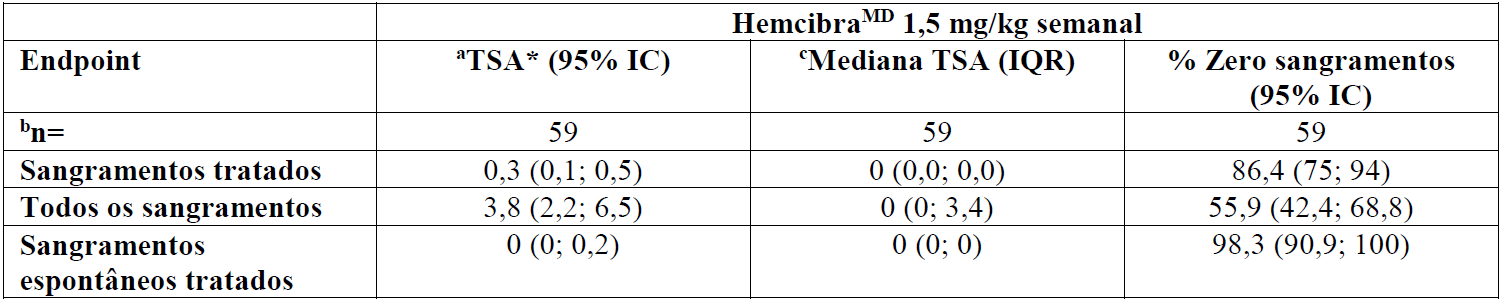

a Calculado com modelo de regressão binomial negativa (NBR).
b Resultados de eficácia de pacientes tratados com < 12 anos, que estiveram no estudo HAVEN 2 por pelo menos 12 semanas (n = 59), considerando que o estudo visou investigar primariamente o efeito do tratamento com base na idade.
cTSA calculada.
Definições de sangramento adaptadas com baseadas nos critérios ISTH.
Sangramentos tratados: sangramentos tratados com agentes de bypass.
Todos os sangramentos: sangramentos tratados e não tratados com agentes de bypass.
Pacientes expostos a Emicizumabe iniciaram com dose de ataque de 3 mg/kg/semana por 4 semanas.
TSA = taxa de sangramento anualizada; IC = intervalo de confiança; IQR = intervalo interquartis, percentil 25º até percentil 75º.
Na análise interina intrapaciente, a profilaxia semanal com Emicizumabe resultou em redução clinicamente significativa (98%) na taxa de sangramentos tratados em dezoito pacientes pediátricos que tiveram, pelo menos, 12 semanas de tratamento profilático com Emicizumabe, em comparação com sua taxa de sangramento coletada no ENI antes do recrutamento.
Tabela 7 – HAVEN 2: Comparação intrapaciente da taxa de sangramento anualizada (sangramentos tratados) para profilaxia com Emicizumabe versus profilaxia prévia com agente de bypass
Endpoint | Tratamento prévio com agente de bypass | Emicizumabe 1,5 mg/kg semanal |
| - | n = 18 | n = 18 |
Sangramentos Tratados | ||
TSA (IC de 95%) | 19,8 (15,3; 25,7) | 0,4 (0,15; 0,88) |
% redução (IC de 95%) | 98% (95,7%; 99,2%) | |
% pacientes com zero sangramento (IC de 95%) | 5,6 (0,1; 27,3) | 77,8 (52,4; 93,6) |
Mediana de TSA (IQR) | 16,2 (11,49; 25,78) | 0,0 (0,00; 0,00) |
Intervalos de confiança derivam do modelo de regressão binomial negativa (NBR).
Dados comparativos intrapaciente a partir do estudo não intervencional (ENI).
Apenas pacientes < 12 anos que participaram do ENI e do estudo HAVEN por pelo menos 12 semanas são incluídos.
Sangramentos tratados: sangramentos tratados com agentes de bypass.
Definições de sangramento adaptadas com base nos critérios ISTH.
TSA = taxa de sangramento anualizada; IC = intervalo de confiança; IR = índice de redução.
Nota: 15 dos 18 pacientes receberam profilaticamente o agente de bypass profilático previamente; 3 pacientes receberam o agente de bypass antes dos episódios.
Resultados em Pediatria
Resultados relacionados à saúde no estudo HAVEN 25
No HAVEN 2, o QVRS para pacientes entre ≥ 8 a < 12 anos foi avaliado na semana 25, com base no Haemo-QoL-SF questionnaire para crianças. O Haemo-QoL-SF é uma medida confiável e válida do QVRS.
Tabela 8 – HAVEN 2: Mudança da linha basal do escore de saúde física Haemo-QoL-SF de pacientes (≥ 8 a < 12 anos) após o tratamento de profilaxia com Emicizumabe
| - | Haemo-QoL-SF |
Escore de saúde física (intervalo: 0 a 100)a | - |
Escore médio da linha basal (IC de 95%) (n=18) | 29,51 (16,38-42,65) |
Mudança média da linha basal (IC de 95%) (n= 15) | -21,67 (- 37,08 - -6,25) |
a Escores baixos (escore com mudança negativa) refletem o melhor do funcionamento.
No HAVEN 2, o QVRS para pacientes < 12 anos também foi avaliado na semana 25, com base no questionário Adapted InhibQoL, completados pelos cuidadores, com aspectos relacionados a carga do cuidador. O Adapted InhibQoL é uma medida confiável e válida para avaliação da QVRS.
Tabela 9 - HAVEN 2: Mudança da linha basal no escore de saúde física relatada pelo cuidador dos pacientes (<12 anos de idade) após o tratamento de profilaxia com Emicizumabe
| - | Adapted InhibQoL com aspectos de carga do cuidador |
Escore de saúde física (intervalo: 0 a 100)a | |
Escore médio da linha basal (IC de 95%) (n=54) | 37,2 (31,5 - 42,8) |
Mudança média da linha basal (IC de 95%) (n= 43) | -32,4 (- 38,6 - -26,2) |
Escore lidando com inibidores (intervalo: 0 a 100)a | |
Escore médio da linha basal (95% IC) (n=54) | 57,7 (53,3 -62,1 |
Mudança média da linha basal (n= 43) | - 24,6 (-30,1 - -19,1) |
Escore de persistência de tratamento (intervalo: 0 a 100)a | |
Escore médio da linha basal (95% IC) (n=54) | 44,5 (40,4 - 48,6) |
Mudança média da linha basal (n= 43) | - 16,9 (-23,1 - -10,6) |
Referências bibliográficas:
1. Clinical Study Report - BH29884 (HAVEN 1) – A multicenter, open-label phase III study to evaluate the efficacy, safety, and pharmacokinetics of prophylactic emicizumab versus no prophylaxis in hemophilia A patients with inhibitors to factor VIII. Report No. 1070071. May 2017.
2. Interim Clinical Study Report – BH29992 (HAVEN 2) – A single arm, multicenter, open-label, phase III study to evaluate the efficacy, safety and pharmacokinetics of once weekly subcutaneous administration of emicizumab in hemophilia A pediatric patients with inhibitors to factor VIII. Report No.1074617. May 2017.
3. 90 Day Safety Update Report (CDS version 2.0).
4. Supplemental Results Report (BH29992) (CDS version 2.0).
5. Update Interim Clinical Study Report - BH29992 (HAVEN 2) - A single arm, multicenter, open-label, phase III study to evaluate the efficacy, safety and pharmacokinetics of once weekly subcutaneous administration of emicizumab in hemophilia A pediatric patients with inhibitors to factor VIII. Report No. 1083442. March 2018. (CDS version 3.0).
6. Update Clinical Study Report - BH29884 (HAVEN 1) - A multicenter, open-label phase III study to evaluate the efficacy, safety, and pharmacokinetics of prophylactic emicizumab versus no prophylaxis in hemophilia A patients with inhibitors to factor VIII. Report No. 1082758. March 2018. (CDS version 3.0).
Características Farmacológicas
Emicizumabe é um anticorpo tipo imunoglobulina G4 (IgG4) monoclonal humanizado com estrutura de anticorpo específica dupla, que liga o fator IXa ao fator X, produzido por tecnologia de DNA recombinante em células de ovário de hamster chinês (CHO).
Propriedades farmacodinâmicas
Mecanismo de ação
O Emicizumabe liga o fator IX ativado ao fator X, restaurando a função faltante do fator VIII ativado, necessária para a hemostasia efetiva.
O Emicizumabe não tem relação estrutural nem homologia sequencial com o fator VIII e, como tal, não induz nem reforça o desenvolvimento de inibidores diretos para o fator VIII.
Farmacodinâmica
A hemofilia A é um distúrbio hereditário da coagulação sanguínea ligado ao cromossomo X, decorrente de uma deficiência da função do fator VIII, que resulta em sangramento nas articulações, músculos ou órgãos internos, espontaneamente ou como resultado de trauma acidental ou cirúrgico. A terapia profilática com Emicizumabe encurta o tempo de tromboplastina parcial ativada (TTPA) e aumenta a atividade de fator VIII avaliada (usando um ensaio cromogênico com fatores de coagulação humanos). Esses dois marcadores farmacodinâmicos não refletem o verdadeiro efeito hemostático de Emicizumabe in vivo (o TTPA é excessivamente encurtado, e a atividade de fator VIII pode ser superestimada), mas fornecem uma indicação relativa do efeito pró-coagulante de Emicizumabe.
Propriedades farmacocinéticas
A farmacocinética do Emicizumabe foi determinada através de uma análise não compartimental em indivíduos saudáveis e usando uma análise farmacocinética populacional em um banco de dados composto de 141 pacientes com hemofilia A. Dados descritivos adicionais da concentração plasmática mínima em pacientes pediátricos com hemofilia A no estudo BH29992 (HAVEN 2) foram coletados após a análise farmacocinética da população.
Absorção
Depois da administração subcutânea em pacientes com hemofilia A, a meia-vida de absorção foi de 1,7 dia.
Depois de múltiplas administrações subcutâneas de 3 mg/kg, uma vez por semana, durante as primeiras quatro semanas, em pacientes com hemofilia A, a média (± DP) de concentrações plasmáticas mínimas de Emicizumabe aumentou até atingir 54,6 ± 14,3 μg/mL na semana 5. Concentrações plasmáticas mínimas de aproximadamente 50 μg/mL foram mantidas a partir de então com a administração semanal de 1,5 mg/kg (consulte a Figura 1).
Figura 1 – HAVEN 1 (Estudo em adultos e adolescentes) e HAVEN 2 (Estudo pediátrico): média das concentrações plasmáticas mínimas de Emicizumabe (μg/mL
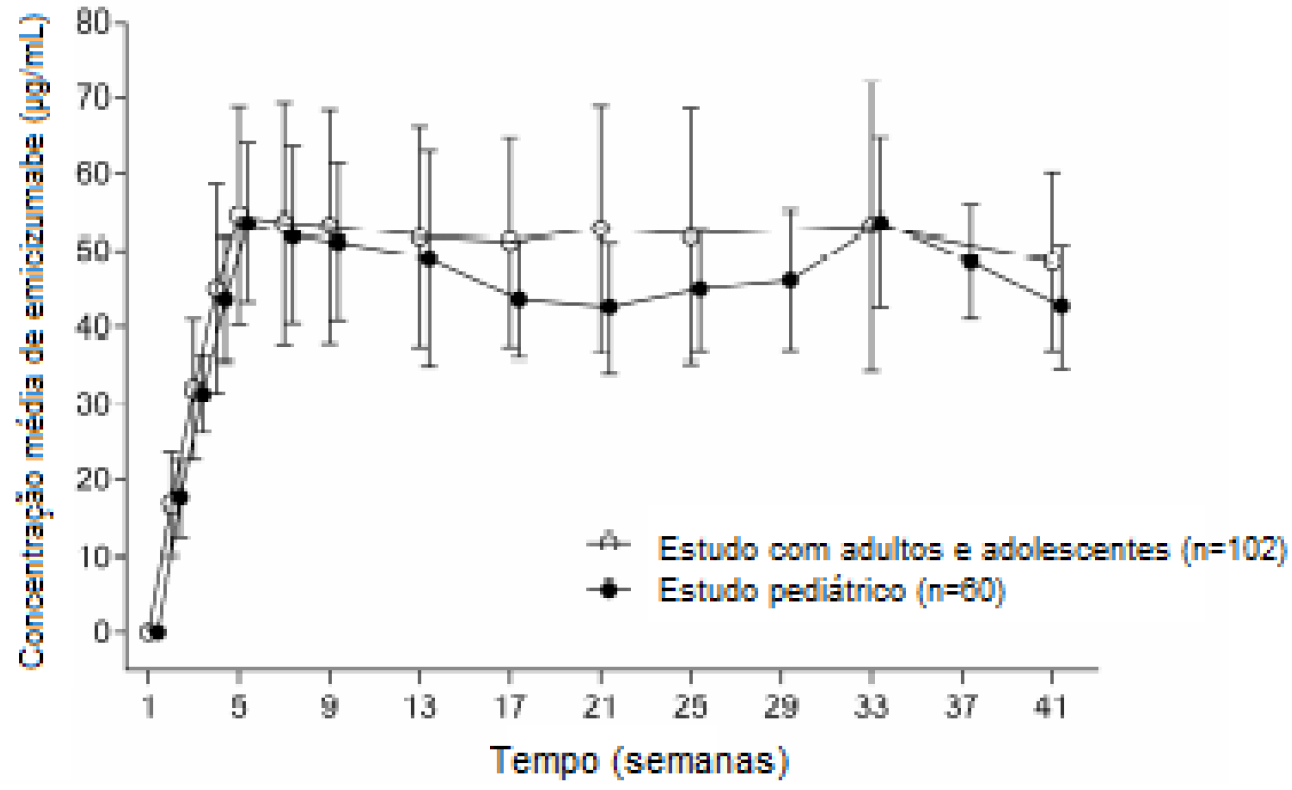
As médias previstas (± DP) da Cmín e da Cmax em estado de equilíbrio estável foram 52,2 ± 13,5 μg/mL e 56,5 ± 13,5 μg/mL, respectivamente. A razão das médias (± DP) de Cmax/Cmín em estado de equilíbrio foi de 1,07 ± 0,03.
Em indivíduos saudáveis, a biodisponibilidade absoluta depois de administração subcutânea de 1 mg/kg foi entre 80,4% e 93,1%, dependendo do local da injeção. Perfis farmacocinéticos semelhantes foram observados depois da administração subcutânea no abdome, parte superior do braço e coxa. Emicizumabe pode ser administrado de forma intercambiável nessas regiões anatômicas.
Distribuição
Depois de dose intravenosa única de 0,25 mg/kg de Emicizumabe em indivíduos saudáveis, o volume de distribuição no estado de equilíbrio foi 106 mL/kg (isto é, 7,4 L para um adulto de 70 kg). Emicizumabe não se destina a uso intravenoso.
O volume de distribuição aparente (V/F), estimado a partir da análise de farmacocinética populacional, em pacientes com hemofilia A, depois de múltiplas doses subcutâneas de Emicizumabe, foi de 11,4 L.
Metabolismo
O metabolismo de Emicizumabe não foi estudado. Os anticorpos IgG são catabolizados principalmente por proteólise lisossomal e depois eliminados ou reutilizados pelo organismo.
Eliminação
Depois da administração intravenosa de 0,25 mg/kg em indivíduos saudáveis, a depuração total de Emicizumabe foi de 3,26 mL/kg/dia (isto é, 0,228 L/dia para um adulto de 70 kg), e a meia-vida terminal média foi de 26,7 dias.
Depois de injeção subcutânea única em indivíduos saudáveis, a meia-vida de eliminação foi de, aproximadamente, quatro a cinco semanas.
Depois de múltiplas injeções subcutâneas em pacientes com hemofilia A, a depuração aparente foi de 0,244 L/dia, e a meia-vida aparente de eliminação foi de 27,8 dias.
Linearidade da dose
Emicizumabe apresentou farmacocinética proporcional à dose em pacientes com hemofilia A em um intervalo de dose de 0,3 a 3 mg/kg, uma vez por semana, depois de administração subcutânea.
Farmacocinética em populações especiais
Insuficiência renal
Nenhum estudo dedicado ao efeito da insuficiência renal sobre a farmacocinética de Emicizumabe foi conduzido.
Nenhum paciente apresentava insuficiência renal grave.
Insuficiência hepática
Nenhum estudo dedicado ao efeito da insuficiência hepática sobre a farmacocinética de Emicizumabe foi conduzido. A maioria dos pacientes com hemofilia A na análise de farmacocinética populacional tinha função hepática normal (bilirrubina e AST ≤ LSN, n = 114) ou insuficiência hepática leve (bilirrubina ≤ LSN e AST > LSN ou bilirrubina < 1,0 a 1,5 x LSN e qualquer AST, n = 17). Insuficiência hepática leve não afetou a farmacocinética de Emicizumabe. O comprometimento hepático foi definido pelos critérios do Instituto Nacional do Câncer (NCI) de disfunção hepática.
Pediatria
O efeito da idade sobre a farmacocinética de Emicizumabe foi avaliado em uma análise de farmacocinética populacional que incluiu 19 crianças (< 12 anos) e 36 adolescentes (12 a 17 anos) com hemofilia A. Uma análise descritiva adicional de dados farmacocinéticos coletados do estudo BH29992 foi realizada em 55 crianças (≥ 2 anos a ≤ 12 anos de idade) e 2 lactentes (1 mês a ≤ 2 anos de idade). A idade não afetou a farmacocinética de Emicizumabe em pacientes pediátricos.
Não há dados em crianças <1 ano de idade. O desenvolvimento do sistema hemostático em neonatos e lactentes é dinâmico e evolutivo, e as concentrações relativas de proteínas pró e anticoagulantes nesses pacientes devem ser levadas em consideração ao se fazer uma avaliação risco-benefício, incluindo risco potencial de trombose (por exemplo, trombose relacionada a cateter venoso central).
Geriatria
O efeito da idade sobre a farmacocinética de Emicizumabe foi avaliado em uma análise de farmacocinética populacional que incluiu três indivíduos com 65 anos e mais de 65 anos (nenhum dos indivíduos tinha mais que 75 anos de idade). A depuração foi ampliada com o aumento da idade, mas não foram observadas diferenças clinicamente importantes na farmacocinética de Emicizumabe entre indivíduos < 65 anos e indivíduos > 65 anos.
Raça
As análises de farmacocinética populacional em pacientes com hemofilia A mostraram que a raça não afetou a farmacocinética de Emicizumabe. Não é necessário nenhum ajuste de dose para esse fator demográfico.
Segurança pré-clínica
Dados pré-clínicos não revelaram nenhum risco especial para humanos com base nos estudos de toxicidade com dose aguda e doses repetidas, que incluíam desfechos de segurança farmacológica e desfechos de toxicidade reprodutiva.
Carcinogenicidade
Não foram realizados estudos de carcinogenicidade para estabelecer o potencial de carcinogenicidade de Emicizumabe.
Genotoxicidade
Não foram realizados estudos para estabelecer o potencial de mutagenicidade de Emicizumabe.
Comprometimento da fertilidade
Emicizumabe não causou nenhuma alteração toxicológica nos órgãos reprodutivos de macacos cynomolgus machos ou fêmeas em doses de até 30 mg/kg/semana nos estudos de toxicidade geral subcutânea de até 26 semanas de duração e em doses de até 100 mg/kg/semana em um estudo de toxicidade geral intravenosa de quatro semanas.
Toxicidade reprodutiva
Não há dados disponíveis em relação aos possíveis efeitos colaterais de Emicizumabe no desenvolvimento embriofetal.
Outros
Em um estudo in vitro de liberação de citocinas que utilizou sangue total de adultos saudáveis, os níveis de citocinas induzidos por Emicizumabe foram comparáveis aos induzidos por anticorpos de referência de baixo risco.
Imunogenicidade
Os dados refletem o número de pacientes cujos resultados de exames foram considerados positivos para anticorpos contra Emicizumabe ao ser utilizado o ensaio enzimático por imunoabsorbância (ELISA). Os resultados de ensaios de imunogenicidade podem ser influenciados por diversos fatores, e isso inclui sensibilidade e especificidade do ensaio, manipulação da amostra, momento da coleta da amostra, medicamentos concomitantes e doença subjacente.
Por essas razões, a comparação da incidência de anticorpos contra Emicizumabe com a incidência de anticorpos contra outros produtos pode induzir a equívocos. A imunogenicidade do Emicizumabe foi avaliada utilizando um ensaio imunoenzimático (ELISA) ou um ensaio de eletroquimioluminescência (ECL). Quatro pacientes foram positivos para anticorpos anti-Emicizumabe no estudo de determinação da dose (n = 18).
Apesar de nenhum paciente testado ter apresentado anticorpos anti-Emicizumabe nos estudos HAVEN1 e HAVEN 2 (n = 171), quatro pacientes no Estudo HAVEN 1 apresentaram perfis farmacocinéticos potencialmente indicativos da geração de anticorpos anti-Emicizumabe, com declínios consideráveis e consistentes nas concentrações plasmáticas de Emicizumabe. Desta forma, a taxa positiva de anticorpos anti-Emicizumabe pode ter sido subrelatada devido à limitação do ensaio. Em caso de sinais clínicos de perda de eficácia, uma mudança de tratamento deve ser considerada.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)