Qual a ação da substância do Genryzon?
Resultados de Eficácia
Dados dos estudos clínicos sobre a eficácia
A segurança e eficácia de Somatrogona para o tratamento de pacientes pediátricos com deficiência de hormônio do crescimento (DGH) foram avaliadas em dois estudos clínicos abertos controlados randomizados. Ambos os estudos incluíram um período principal de estudo de 12 meses que comparou Somatrogona uma vez por semana com Genotropin® administrado uma vez ao dia seguido de um período de extensão aberta (OLE) de braço único, durante o qual todos os pacientes receberam Somatrogona uma vez por semana. O endpoint primário de eficácia para ambos os estudos foi velocidade de crescimento (VC) anualizada após 12 meses de tratamento. Outros endpoints que refletem recuperação de crescimento, como alteração no valor do desvio padrão (SDS) de altura em relação à avaliação inicial e SDS de altura também foram avaliados em ambos os estudos.
Em um estudo inicial de determinação de dose e de segurança, 53 pacientes pediátricos com DGH foram randomizados e tratados com uma de três doses de Somatrogona uma vez por semana [0,25 mg/kg/semana (N=13), 0,48 mg/kg/semana (N=15), 0,66 mg/kg/semana (N=14)] ou com Genotropin® administrado uma vez ao dia [(0,034 mg/kg/dia (N=11)]. A VC anual de 0,66 mg/kg/semana de Somatrogona foi comparável ao Genotropin® administrado uma vez ao dia após 12 meses de tratamento (11,4 cm/ano [intervalo de confiança (IC) de 95%: 9,2, 13,7]); (12,5 cm/ano [IC de 95%: 11,0, 13,9]), respectivamente. Durante a OLE, 37 pacientes receberam 0,66 mg/kg/semana de Somatrogona por, no mínimo, cinco anos. Foi observado um ganho progressivo no SDS de altura desde a avaliação inicial em cinco anos (alteração cumulativa na média do SDS de altura (SD)=3,11 (1,18), mediana=2,86).
A dose de 0,66 mg/kg/semana de Somatrogona foi novamente avaliada em um estudo definitivo de segurança e eficácia em 224 pacientes pediátricos pré-púberes com DGH. Os pacientes foram randomizados e tratados com Somatrogona uma vez por semana (N=109) ou Genotropin® administrado uma vez ao dia (N=115) a uma dose de 0,034 mg/kg/dia. Somatrogona uma vez por semana resultou em uma VC não inferior em 12 meses na comparação com o Genotropin® administrado uma vez ao dia. O crescimento de recuperação, conforme refletido por uma alteração no SDS de altura desde a avaliação inicial foi numericamente superior para Somatrogona (vide Tabela 1). Somatrogona uma vez por semana também produziu um aumento nos valores do SDS do fator de crescimento semelhante à insulina (IGF-1), de uma média de -1,95 na avaliação inicial para uma média de 0,65 em 12 meses.
Tabela 1. Eficácia de Somatrogona comparado ao Genotropin® em pacientes pediátricos com DGH no mês 12
| Parâmetro do tratamento | Grupo de tratamento | Diferença do MMQ (IC de 95%) | |
Somatrogona | Genotropin® (N=115) | ||
| Estimativa MMQ | Estimativa MMQ | ||
| Velocidade de crescimento (cm/ano) | 10,10 | 9,78 | 0,33 (-0,24, 0,89) |
| Valor do desvio padrão da altura | -1,94 | -1,99 | 0,05 (-0,06, 0,16) |
| Alteração no valor do desvio padrão da altura desde a avaliação inicial | 0,92 | 0,87 | 0,05 (-0,06, 0,16) |
Abreviações: IC=intervalo de confiança; DGH=deficiência de hormônio do crescimento; MMQ=método dos mínimos quadrados; N=número de pacientes randomizados e tratados.
No estudo definitivo de segurança e eficácia, a idade média em todos os grupos de tratamento foi de 7,7 anos (mín. 3,01, máx. 11,96), 40,2% dos pacientes tinham >3 anos a ≤7 anos, 59,8% tinham >7 anos. 71.9% dos pacientes eram do sexo masculino e 28,1% do sexo feminino. Nesse estudo, 74,6% dos pacientes eram brancos, 20,1% eram asiáticos e 0,9% eram negros. As características da doença basal foram equilibradas entre ambos os grupos de tratamento. Aproximadamente 68% dos pacientes tinham níveis plasmáticos de pico de hormônio do crescimento (GH) de ≤7 ng/mL, sendo que a altura média estava abaixo do SDS de -2.
Os eventos adversos por todas as causalidades relatados com maior frequência que ocorreram em ≥5% dos participantes em qualquer grupo de tratamento foram dor no local da injeção, nasofaringite, cefaleia, pirexia, tosse, eritema no local da injeção, vômito, bronquite, artralgia, aumento da fosfoquinase creatinina no sangue, anemia, faringite, hipotireoidismo, otite média, dor de ouvido, dor orofaríngea, rinite, mordedura artrópode, prurido no local da injeção, dor abdominal superior e amigdalite.
Carga do tratamento
O impacto do Somatrogona administrado uma vez por semana (0,66 mg/kg/semana) na carga do tratamento foi comparado com Genotropin® diário em um estudo randomizado, aberto e cruzado em 87 pacientes pediátricos com DGH. Somatrogona administrado uma vez por semana demonstrou uma carga do tratamento significativamente melhor, avaliada como a diferença no escore total de Interferência na Vida geral média, em comparação com Genotropin® administrado uma vez por dia.
A experiência de tratamento com Somatrogona resultou em carga do tratamento melhorada para o cuidador, maior conveniência para os pacientes, maior intenção de cumprir e preferência dos pacientes por um regime de administração de uma vez por semana em comparação com Genotropin® administrado uma vez por dia.
Características Farmacológicas
Propriedades farmacodinâmicas
Mecanismo de ação
A somatrogona é uma glicoproteína produzida nas células do ovário de hamster chinês (CHO) pela tecnologia do DNA recombinante. Ela é composta pela sequência de aminoácidos do hormônio do crescimento humano (hGH) com uma cópia do peptídeo C-terminal (CTP) da cadeia beta da gonadotrofina coriônica humana (hCG) na região N-terminal e duas cópias de CTP (em tandem) na região C-terminal. Os domínios CTP e de glicosilação são responsáveis pela meia-vida da somatrogona, o que permite uma dosagem semanal.
A somatrogona se liga ao receptor do GH e inicia uma cascata de transdução de sinal que culmina em alterações no crescimento e no metabolismo. Consistente com a sinalização do GH, a ligação da somatrogona leva à ativação da via de sinalização STAT5b e aumenta a concentração sérica do fator de crescimento semelhante à insulina (IGF1). Foi descoberto que o IGF-1 aumenta de forma dependente de dose durante o tratamento com somatrogona mediando parcialmente o efeito clínico. Como resultado, o GH e o IGF-1 estimulam alterações metabólicas, o crescimento linear e aumentam a velocidade do crescimento em pacientes pediátricos com DGH.
Efeitos farmacodinâmicos
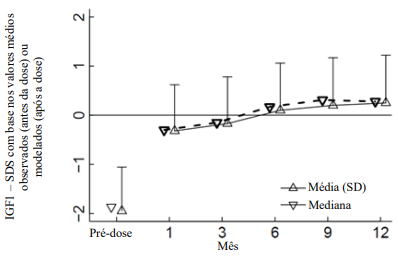
A somatrogona aumenta o IGF-1. Foram realizadas avaliações farmacodinâmicas aproximadamente 96 horas após a administração da dose a fim de avaliar o valor médio do desvio padrão (SDS) do IGF-1 no intervalo entre as doses (vide Figura 1).
Figura 1. Perfis do SDS modelado do IGF-1 em pacientes pediátricos com DGH durante 12 meses de tratamento com somatrogona
Propriedades Farmacocinéticas
A farmacocinética da somatrogona foi avaliada utilizando uma abordagem farmacocinética populacional para Somatrogona em 42 pacientes pediátricos com DGH.
Absorção
Após a injeção subcutânea (SC), as concentrações séricas aumentaram lentamente, com pico entre 6 e 18 horas após a administração.
Em pacientes pediátricos com DGH, a exposição à somatrogona aumenta de maneira proporcional à dose para doses de 0,25 mg/kg/semana, 0,48 mg/kg/semana e 0,66 mg/kg/semana. Não há acúmulo de somatrogona após administração uma vez por semana. Em pacientes pediátricos com DGH, as concentrações de pico em estado estável estimadas por farmacocinética populacional média após 0,66 mg/kg/semana foram de 690 ng/mL.
Distribuição
Em pacientes pediátricos com DGH, o volume de distribuição principal aparente estimado da farmacocinética populacional média foi de 0,812 L/kg e o volume periférico aparente de distribuição foi de 0,169 L/kg.
Metabolismo
Acredita-se que o destino metabólico da somatrogona seja o catabolismo clássico de proteína, com recuperação subsequente dos aminoácidos e retorno à circulação sistêmica.
Eliminação
Em pacientes pediátricos com DGH, a depuração aparente estimada da farmacocinética populacional média foi de 0,0336 L/h/kg. Com uma meia vida efetiva estimada da farmacocinética populacional média de 28,3 horas, a somatrogona estará presente na circulação por cerca de 6 dias após a última dose.
Excreção
A excreção não foi avaliada em estudos clínicos.
Populações especiais
Idade, raça, sexo, peso corporal
Com base em análises de farmacocinética populacional, idade, sexo, raça e etnia não têm um efeito de significância clínica sobre a farmacocinética da somatrogona em pacientes pediátricos com DGH. A exposição da somatrogona diminui com um aumento no peso corporal. No entanto, o regime de dosagem de somatrogona de 0,66 mg/kg/semana oferece uma exposição sistêmica adequada na faixa de variação de peso corporal de 10 a 54 kg avaliada nos estudos clínicos. Os efeitos de fatores individuais intrínsecos sobre a farmacocinética da somatrogona são mostrados na Figura 2.
Figura 2. Impacto do fator individual intrínseco sobre a exposição da somatrogona

Abreviações: ADAS=status de ADA, 0=negativo, 1=positivo.
ADA=anticorpo antimedicamento.
Idosos
A segurança e eficácia da somatrogona em pacientes com idade superior a 65 anos não foram estabelecidas. Não há dados disponíveis.
Uso em pacientes com comprometimento renal
Somatrogona não foi estudado em pacientes com insuficiência renal. Nenhuma recomendação de dose pode ser feita.
Uso em pacientes com comprometimento hepático
Somatrogona não foi estudado em pacientes portadores de insuficiência hepática. Nenhuma recomendação de dose pode ser feita.
População pediátrica
A segurança e eficácia da somatrogona em recém-nascidos, lactentes e crianças com menos de 3 anos de idade ainda não foram estabelecidas. Não há dados disponíveis.
Imunogenicidade
Consistente com as propriedades potencialmente imunogênicas de medicamentos de proteínas e peptídeos, pacientes tratados com Somatrogona podem desenvolver anticorpos contra a somatrogona.
A detecção da formação de anticorpos é altamente dependente da sensibilidade e especificidade do ensaio. Além disso, a incidência observada de positividade de anticorpos (incluindo anticorpos neutralizantes) em um ensaio pode ser influenciada por diversos fatores, inclusive a metodologia do ensaio, manipulação das amostras, momento da coleta das amostras, medicação concomitante e doença subjacente. Por essas razões, a comparação entre a incidência de anticorpos à somatrogona nos estudos descritos abaixo com a incidência de anticorpos em outros estudos ou para outros produtos pode ser enganosa.
No estudo definitivo de segurança e eficácia, entre 109 participantes tratados com somatrogona, 84 (77,1%) testaram positivo para anticorpos antimedicamento (ADAs). Não houve relatos de reações adversas graves ao medicamento ou toxicidades graves relacionadas à imunologia em pacientes com ou sem ADAs. Além disso, a velocidade de crescimento anual, a alteração no SDS de altura, o SDS de altura e a resposta ao IGF-1 foram similares em pacientes com ou sem ADAs emergentes do tratamento.
Dados de segurança pré-clínicos
A somatrogona foi avaliada em estudos de toxicidade de doses repetidas e de dose única em ratos e macacos rhesus. Com base nos estudos não clínicos realizados, os achados relativos ao local da injeção foram identificados como único órgão/efeito alvo. Um aumento previsto no peso corporal foi observado em ratos por ser um efeito farmacodinâmico primário do hormônio do crescimento e relacionado aos efeitos secundários de um maior IGF-1. Ocorreram outros achados relacionados à atividade farmacológica da somatrogona nas glândulas mamárias, fígado, rim e baço de ratos.
Comprometimento de fertilidade
A possibilidade da somatrogona ter efeitos sobre a fertilidade e desenvolvimento embrionário inicial foi avaliada em ratos do sexo masculino e feminino. Em um estudo de desenvolvimento embriofetal em ratos que receberam somatrogona via injeção SC a cada 2 dias do dia de gestação (GD) 6 ao 18 em doses de até 30 mg/kg (45 vezes a dose máxima recomendada para humanos com base na exposição), não houve efeitos adversos maternos ou embriofetais. A somatrogona elicitou um aumento na duração do ciclo estral, no intervalo de cópula e no número de corpos lúteos, porém não houve qualquer impacto nos índices de acasalamento, fertilidade, número de embriões viáveis/desenvolvimento embrionário prematuro.
Toxicidade de desenvolvimento
A possibilidade da somatrogona ter efeitos sobre o desenvolvimento embriofetal também foi avaliada em ratos. A somatrogona elicitou aumentos não adversos mediados farmacologicamente nos pesos corporais maternais e no ganho de peso corporal, porém não houve qualquer efeito embriofetal correspondente.
A possibilidade de efeitos da somatrogona sobre o desenvolvimento pré-natal e pós-natal foi avaliada em ratos.
Em um estudo de desenvolvimento pré-natal e pós-natal em ratos, a somatrogona foi administrada via injeção SC para ratas grávidas a cada 2 dias do GD 6 ao dia de lactação 20 em doses de até 30 mg/kg. Não houve qualquer evidência de toxicidade materna e de qualquer efeito adverso na prole da primeira geração (F1). A somatrogona levou a um aumento na média do peso corporal de F1 (ambos os sexos), bem como um aumento no intervalo médio de cópula em fêmeas F1 na dose mais alta (30 mg/kg), o que era consistente com uma maior duração do ciclo estral. No entanto, não houve qualquer efeito relacionado sobre os índices de acasalamento.
Genotoxicidade e carcinogenicidade
Não foram realizados estudos de genotoxicidade e carcinogenicidade. O potencial de atividade mitogênica da somatrogona foi avaliado no estudo de toxicidade de doses repetidas de 26 semanas em macacos rhesus. Nenhuma mitogenicidade foi evidenciada a partir de avaliações macroscópicas e microscópicas do tecido ou da avaliação dos pesos dos órgãos nesse estudo.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)