Qual a ação da substância do Gazyva?
Resultados de Eficácia
Estudo clínico fase III, internacional, multicêntrico, aberto, randomizado, realizado em dois estágios, com três braços (BO21004/CLL11) para investigar o perfil de segurança e eficácia de Obinutuzumabe mais clorambucil (G-Clb) em comparação com rituximabe mais clorambucil ou clorambucil (Clb) isolado foi conduzido incluindo pacientes com leucemia linfocítica crônica não tratados previamente com comorbidades.
Antes da inclusão, os pacientes precisavam apresentar LLC, CD20 positivo e uma ou ambas das seguintes medidas de condições clínicas coexistentes: escore de comorbidade (escala CIRS) maior que 6 ou função renal reduzida mensurada pela depuração de creatinina (CrCl) < 70 mL/min. Pacientes com função hepática [NCICTC Grau 3 para testes de função hepática (AST, ALT > 5 x ULN por mais de 2 semanas; bilirrubina > 3 x ULN)] e função renal (CrCl < 30 mL/min) não adequadas foram excluídos.
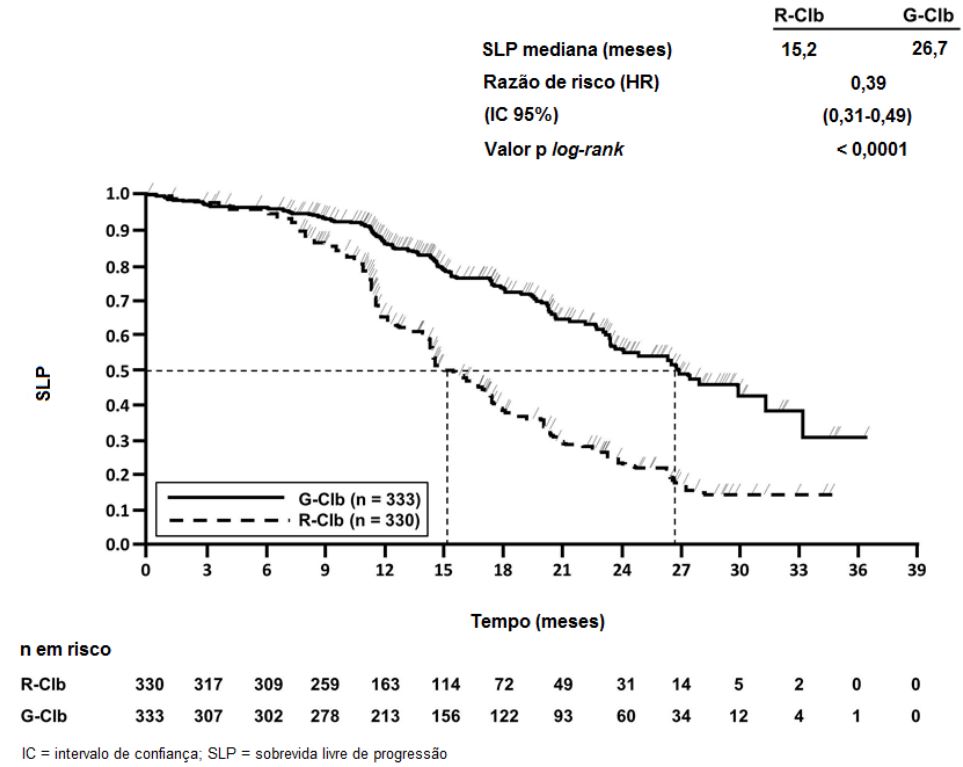
Um total de 781 pacientes foi randomizado na proporção de 2:2:1 para receber Obinutuzumabe mais clorambucil, rituximabe mais clorambucil ou clorambucil isolado. O Estágio 1 comparou Obinutuzumabe mais clorambucil com clorambucil isolado em 356 pacientes e o Estágio 2 comparou Obinutuzumabe mais clorambucil com rituximabe mais clorambucil em 663 pacientes. Os resultados de eficácia estão resumidos na Tabela 1 e nas Figuras 1-3.
Na maioria dos pacientes, Obinutuzumabe foi administrado por via intravenosa na dose inicial de 1000 mg nos Dias 1, 8 e 15 do primeiro ciclo de tratamento. Para reduzir a porcentagem de reações infusionais nos pacientes, 140 deles receberam a primeira dose de Obinutuzumabe administrada em dois dias [Dia 1 (100 mg) e o Dia 2 (900 mg)]. Para cada ciclo de tratamento subsequente (Ciclos 2 a 6), os pacientes receberam 1000 mg de Obinutuzumabe no Dia 1 apenas. O clorambucil foi administrado oralmente na dose de 0,5 mg/kg de peso corporal nos dias 1 e 15 de todos os ciclos de tratamento (1 a 6).
Os dados demográficos e as características basais foram bem equilibrados entre os grupos de tratamento. A maioria dos pacientes incluídos era caucasiana (95%) e do sexo masculino (61%). A mediana de idade foi de 73 anos, sendo que 44% tinham 75 anos de idade ou mais. No período basal, 22% dos pacientes apresentavam estadio A de Binet, 42% apresentavam estadio B e 36%, estadio C. O escore mediano de comorbidade foi 8 e 76% dos pacientes incluídos apresentavam escore de comorbidade acima de 6. A mediana estimada de CrCl foi de 62 mL/min e 66% de todos os pacientes apresentavam CrCl < 70 mL/min. Quarenta e dois por cento dos pacientes incluídos apresentavam tanto CrCl < 70 mL/min como um escore de comorbidade > 6. Trinta e quatro por cento dos pacientes foram incluídos no escore de comorbidade isolado e 23% com função renal comprometida somente.
As condições clínicas coexistentes mais frequentemente reportadas (usando um corte de 30% ou mais) no sistema MedDRA são: distúrbios vasculares (73%), distúrbios cardíacos (46%), distúrbios gastrintestinais (38%), distúrbios do metabolismo e nutrição (40%), distúrbios renais e urinário (38%) e distúrbios musculoesqueléticos e do tecido conectivo (33%).
O desfecho primário do estudo foi a sobrevida livre de progressão (SLP) avaliada pelo investigador (SLP-INV). Além disso, uma comissão de revisão independente (IRC) avaliou todos os pacientes com relação à progressão e avaliou a SLP (SLP-IRC).
Os principais desfechos secundários de eficácia foram o percentual de resposta no final do tratamento, a remissão molecular no final do tratamento (doença residual mínima) e o tempo até desfechos (sobrevida livre de evento, nova terapia antileucêmica). A sobrevida global para o Estágio 1 é apresentada na Figura 2. A sobrevida global para o Estágio 2 continuará sendo acompanhada e os dados são ainda imaturos.
Tabela 1. Resumo de eficácia do estudo BO21004/CLL11
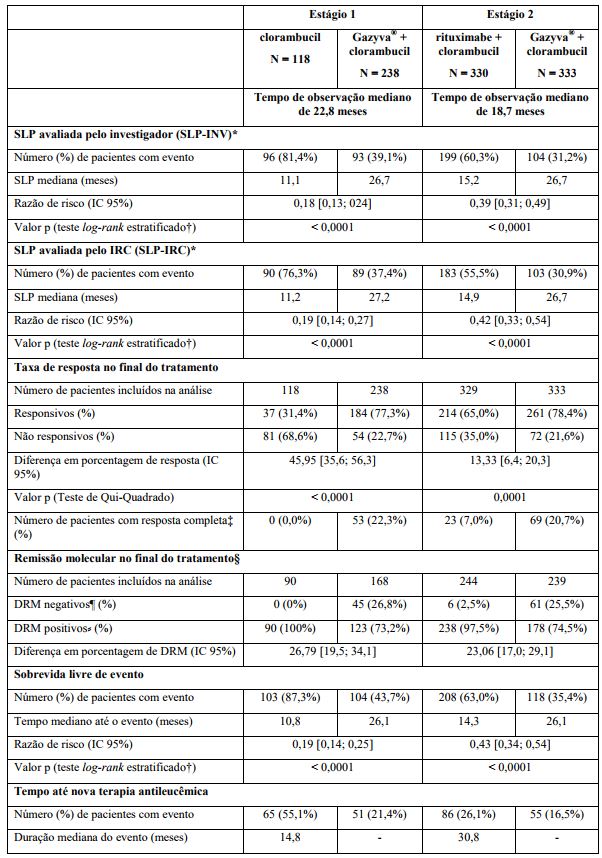
SLP: sobrevida livre de progressão; IC: intervalo de confiança; DRM: doença residual mínima.
* Definida como o tempo desde a randomização até a primeira ocorrência de progressão, recidiva ou óbito por qualquer causa conforme avaliação do investigador.
† Estratificado por estágio Binet no período basal.
‡ Inclui 11 pacientes no braço G-Clb com uma resposta completa e recuperação incompleta da medula.
§ Sangue e medula óssea combinados.
¶ Negatividade DRM definida como resultado abaixo de 0,0001.
⸗ Inclui pacientes DRM positivos e pacientes que progrediram ou morreram antes do final do tratamento NA = não alcançado.
** Dado ainda imaturo.
Resultados da análise de SLP do subgrupo (sexo, idade, estágios de Binet, CrCl, escore CIRS, beta2-microglobulina, estado mutacional do IgVH, anormalidades cromossômicas, contagem de linfócitos no período basal) foram compatíveis com os resultados observados no total da população com intenção de tratamento (ITT). O risco de progressão da doença ou óbito (SLP) foi reduzido no braço Obinutuzumabe mais clorambucil (GClb), em comparação com o braço que recebeu rituximabe mais clorambucil (RClb) e clorambucil isolado (Clb) em todos os subgrupos. A razão de risco variou de 0,08 a 0,42 para GClb vs. Clb e 0,28 a 0,71 para GClb vs. RClb.
Figura 1. Curva de Kaplan-Meier de Sobrevida Livre de Progressão do Estágio 1 Avaliada pelo Investigador
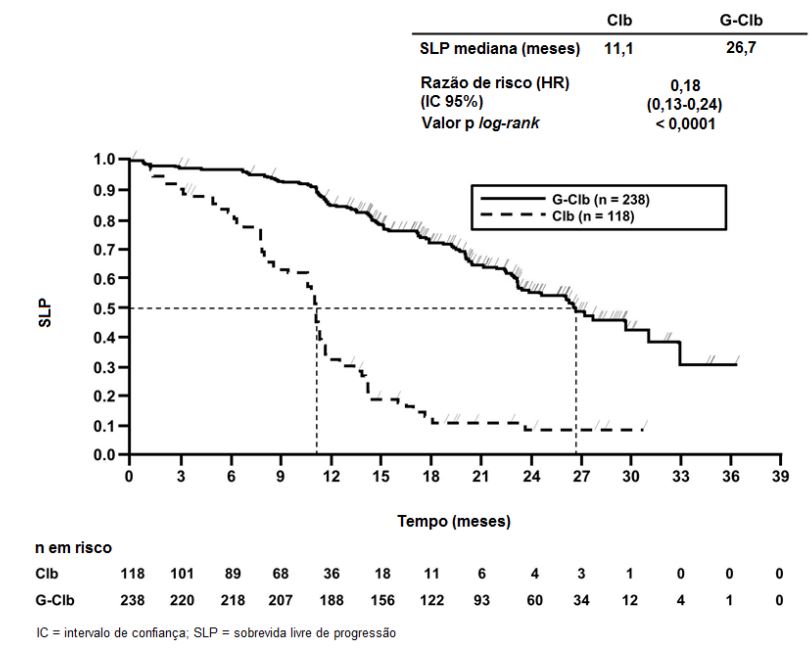
Figura 2. Curva de Kaplan-Meier de Sobrevida Global do Estágio 1
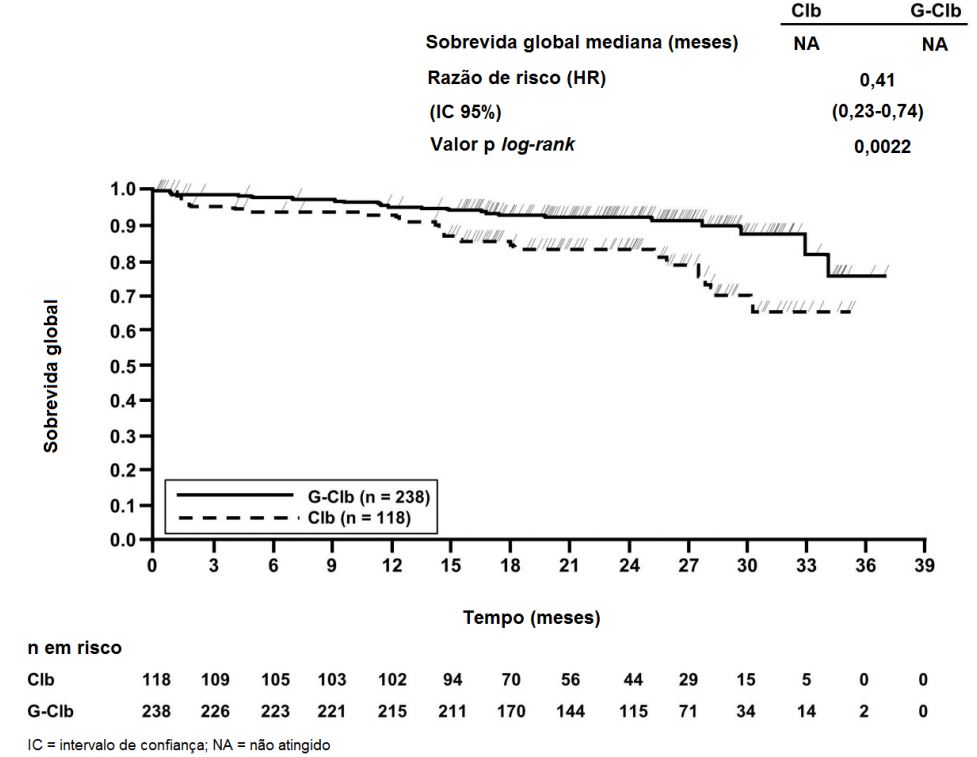
Figura 3. Curva de Kaplan-Meier de Sobrevida Livre de Progressão do Estágio 2 Avaliada pelo Investigador
Resultados Reportados pelos Pacientes
Nos questionários QLQC30 e QLQ-CLL-16, conduzidos durante o período de tratamento, não foi observada nenhuma diferença substancial em nenhuma das subescalas. Dados durante o acompanhamento, especialmente para o braço clorambucil isolado, são limitados. No entanto, nenhuma diferença notável foi identificada até o momento durante o acompanhamento do parâmetro qualidade de vida.
Avaliações de qualidade de vida relacionada à saúde, específicas para fadiga durante o período de tratamento, não mostram diferença estatisticamente significativa sugerindo que a adição de Obinutuzumabe ao regime de tratamento com clorambucil não aumenta a sensação de fadiga para os pacientes.
Imunogenicidade
Pacientes no estudo pivotal BO21004/CLL11 foram testados em vários momentos para anticorpos antidrogas (ATA) contra Obinutuzumabe . Nos pacientes tratados com Obinutuzumabe , 8 de 140 na fase randomizada e 2 em 6 na fase de inclusão tiveram testes positivos para ATA em 12 meses de acompanhamento. Desses pacientes, nenhum apresentou reações anafiláticas ou de hipersensibilidade consideradas relacionadas aos ATA, tampouco a resposta clínica foi afetada.
Resultados de ensaio de imunogenicidade são altamente dependentes de diversos fatores, incluindo sensibilidade e especificidade do ensaio, sua metodologia, robustez a quantidade de Obinutuzumabe circulante, manipulação de amostras, cronograma de coleta de amostras, medicações concomitantes e doença subjacente. Por essas razões, a comparação da incidência de anticorpos contra Obinutuzumabe com a incidência de anticorpos contra outros medicamentos pode estar equivocada.
Características Farmacológicas
Propriedades Farmacodinâmicas
Mecanismo de ação
Obinutuzumabe é um anticorpo monoclonal humanizado recombinante Tipo II anti-CD20 do isotipo IgG1 e produzido por glicoengenharia. É especificamente direcionado à alça extracelular do antígeno transmembrana CD20 na superfície de linfócitos pré-B e B maduros não malignos e malignos, mas não sobre células-tronco hematopoiéticas, células pro-B, plasmócitos normais ou outros tecidos normais. A glicoengenharia da porção Fc de Obinutuzumabe resulta em maior afinidade por receptores FcγRIII sobre células imunoefetoras, como células NK (Natural Killer) e macrófagos e monócitos em comparação com anticorpos não produzidos por glicoengenharia.
Em estudos não clínicos, Obinutuzumabe induz morte celular direta e é mediador de citotoxicidade celular dependente de anticorpos (CCDA) e fagocitose celular dependente de anticorpos (FCDA) por meio do recrutamento de células imunoefetoras positivas FcγRIII. Além disso, Obinutuzumabe apresenta baixo grau de citotoxicidade dependente do complemento (CDC). Em modelos animais, Obinutuzumabe induz depleção potente de células B com eficácia antitumoral. Em comparação com anticorpos CD20 Tipo I, Obinutuzumabe , um anticorpo Tipo II, é caracterizado por uma indução aumentada de morte celular direta com redução concomitante de CDC. Comparado a anticorpos anti-CD20 não produzidos por glicoengenharia, Obinutuzumabe se caracteriza por aumento da citotoxicidade celular dependente de anticorpos (CCDA) como consequência da glicoengenharia. Isso se traduz em depleção de células B e eficácia antitumoral superiores em modelos animais.
Efeitos farmacodinâmicos
No estudo clínico pivotal BO21004/CLL11, 91% (40 em 44) dos pacientes passíveis de avaliação tratados com Obinutuzumabe apresentaram depleção de células B (definido como número de células B CD19+ < 0,07 x 109 /L) no final do período de tratamento e permaneceram depletados durante os primeiros 6 meses de acompanhamento. A recuperação das células B foi observada dentro de 12 a 18 meses de acompanhamento em 35% (14 de 40) dos pacientes sem doença progressiva e 13% (5 de 40) com doença progressiva.
Propriedades Farmacocinéticas
Foi desenvolvido um modelo farmacocinético populacional para analisar dados farmacocinéticos de 678 pacientes com LNH (linfoma não Hodgkin) ou LLC que receberam Obinutuzumabe nos estudos Fase I, II e III, o qual foi utilizado para descrever as características farmacocinéticas de obinutuzumabe em pacientes com LLC.
Absorção
Obinutuzumabe é administrado por via intravenosa, portanto a absorção não se aplica nesse caso. Não foram realizados estudos clínicos com outras vias de administração. A partir do modelo farmacocinético populacional, após infusão do Dia 1 do Ciclo 6 em pacientes com LLC, o valor mediano estimado de Cmax foi 473,2 µg/mL e o valor de AUC(T) foi 9516 µg.d/mL.
Distribuição
Depois da administração intravenosa, o volume de distribuição do compartimento central (2,76 L) se aproxima ao volume do soro, o que indica que a distribuição é, em grande parte, restrita ao plasma e ao líquido intersticial.
Metabolismo
O metabolismo de Obinutuzumabe não foi estudado diretamente. A maior parte dos anticorpos é eliminada por catabolismo.
Eliminação
A depuração de Obinutuzumabe no Ciclo 6 em pacientes com LLC é de aproximadamente 0,083 L/dia com uma t ½ de eliminação mediana de 30,3 dias. A depuração de Obinutuzumabe compreende um modelo de depuração com tempo variável com duas vias paralelas que a descrevem: uma via de depuração linear e uma não linear que se altera em função do tempo.
Durante o início do tratamento, a via de depuração não linear variável com o tempo é dominante e responde pela principal via de depuração. À medida que o tratamento progride, o impacto dessa via diminui e a via de depuração linear predomina.
Esse é um indicativo de target mediated drug disposition (TMDD), em que a abundância inicial de células CD20 causa uma depleção rápida de Obinutuzumabe . No entanto, quando a maior parte das células CD20 fica ligada a Obinutuzumabe , existe uma redução do impacto de TMDD sobre a farmacocinética.
Farmacocinética em populações especiais
Na análise de farmacocinética populacional, o sexo se revelou uma covariável que justifica algumas das variabilidades entre os pacientes, com uma depuração em estado de equilíbrio dinâmico (CLss) 22% maior e um volume de distribuição (V) 18% maior no sexo masculino. No entanto, os resultados da análise populacional mostraram que as diferenças em exposição não são significativas (com uma mediana estimada de AUC e Cmax de 11282 µg*d/mL e 578,9 µg/mL no sexo feminino e 8451 µg*d/mL e 432,5 µg/mL no sexo masculino, respectivamente, no Ciclo 6), indicando que não existe a necessidade de ajuste de dose baseado no sexo.
Pacientes Idosos
A análise farmacocinética populacional de Obinutuzumabe mostrou que a idade não afeta a sua farmacocinética. Nenhuma diferença significativa foi observada na farmacocinética de Obinutuzumabe entre pacientes < 65 anos (n = 265), pacientes entre 65 e 75 anos (n = 197) e pacientes > 75 anos (n = 128).
Pacientes Pediátricos
Não foram conduzidos estudos para investigar a farmacocinética de Obinutuzumabe em crianças.
Insuficiência renal
A análise farmacocinética populacional de Obinutuzumabe mostrou que a depuração de creatinina não afeta a farmacocinética do produto. A farmacocinética de Obinutuzumabe em pacientes com depuração de creatinina levemente diminuída (CrCl 50-89 mL/min, n = 306) ou moderadamente diminuída (CrCl 30 a 49 mL/min, n = 72) foi semelhante à de pacientes com função renal normal (CrCl ≥ 90 mL/min, n = 207). Dados farmacocinéticos em pacientes com insuficiência renal grave (CrCl 15-29 mL/min) são limitados (n = 5), portanto, não é possível fazer nenhuma recomendação específica de dose.
Insuficiência Hepática
Não foram conduzidos estudos formais de farmacocinética e nenhum dado de farmacocinética populacional foi coletado em pacientes com insuficiência hepática.
Segurança pré-clínica
Carcinogenicidade
Não foram realizados estudos de carcinogenicidade para estabelecer o potencial carcinogênico de Obinutuzumabe.
Mutagenicidade
Não foram realizados estudos para estabelecer o potencial mutagênico de Obinutuzumabe.
Comprometimento da Fertilidade
Não foram realizados estudos específicos em animais para avaliar o efeito de Obinutuzumabe sobre a fertilidade. Nenhum evento adverso sobre órgãos reprodutores masculinos e femininos foi observado em estudos de toxicidade de dose repetida em macacos cynomolgus.
Teratogenicidade
Um estudo de toxicidade sobre o desenvolvimento pré e pós-natal foi realizado em macacas cynomolgus prenhes. Os animais receberam doses intravenosas semanais de Obinutuzumabe [médias de AUC0-168h em estado de equilíbrio (no Dia 139 p.c.) foram de 125.000 e 250.000 (µg.h)/mL com 25 e 50 mg/kg, respectivamente; a Cmax média foi 1.220 e 2.470 µg/mL com 25 e 50 mg/kg, respectivamente] durante a gestação (período de organogênese; Dia 20 pós-coito até o parto).
Os filhotes expostos não apresentaram nenhum efeito teratogênico, mas as células B estavam completamente depletadas no Dia 28 pós-parto. As exposições dos filhotes no Dia 28 pós parto sugerem que Obinutuzumabe pode atravessar a barreira hematoplacentária. As concentrações no soro do filhote no Dia 28 pós-parto estavam na faixa das concentrações do soro materno, enquanto que as concentrações no leite no mesmo dia eram muito baixas (menos que 0,5% dos níveis séricos maternos correspondentes), sugerindo que a exposição dos filhotes deve ter ocorrido dentro do útero. O número de células B retornou a níveis normais e a função imunológica foi restaurada dentro de 6 meses a partir do parto.
Outros
Em um estudo de 26 semanas com macacos cynomolgus, reações de hipersensibilidade foram notadas e atribuídas ao reconhecimento do anticorpo humanizado como estranho nesses macacos (Cmax e AUC0-168h em estado de equilíbrio - Dia 176 - depois da administração semanal de 5, 25 e 50 mg/kg foram 377, 1530 e 2920 µg/mL e 39.800, 183.000 e 344.000 (µg.h)/mL, respectivamente).
Os achados incluíram reações anafiláticas ou anafilactoides agudas e aumento da prevalência de inflamação sistêmica e infiltrados compatíveis com reações de hipersensibilidade mediadas por imunocomplexos, como arterite/periarterite, glomerulonefrite e inflamação serosa/adventícia.
Essas reações levaram à exclusão não programada de 6/36 animais tratados com Obinutuzumabe durante as fases de administração e recuperação; essas alterações foram parcialmente reversíveis. Não se observou nenhuma toxicidade renal de relação causal com Obinutuzumabe em seres humanos.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)