Qual a ação da substância do Zevuxa?
Resultados de eficácia
A eficácia e a segurança do Dasatinibe foram investigadas em pacientes adultos com LMC Ph+ ou LLA Ph+, resistentes ou intolerantes ao imatinibe: 1158 pacientes tinham LMC Ph+ na fase crônica, 858 pacientes tinham LMC Ph+ na fase acelerada, fase mieloide blástica, ou fase linfoide blástica, e 130 pacientes tinham LLA Ph+.
Em um estudo clínico de LMC Ph+ na fase crônica, a resistência ao imatinibe incluiu falha ao atingir a resposta hematológica completa (RHC; depois de 3 meses), resposta citogenética maior (RCM; depois de 6 meses), ou resposta citogenética completa (RCC; depois de 12 meses); ou perda de uma resposta molecular prévia (com aumento concomitante ≥ 10% em metáfases de Ph+), resposta citogenética, ou resposta hematológica. A intolerância ao imatinibe incluiu a incapacidade para tolerar 400 mg ou mais de imatinibe por dia ou a descontinuação do imatinibe devido à toxicidade.
Os resultados descritos abaixo são baseados em um mínimo de 2 anos de acompanhamento após o início do tratamento com Dasatinibe em pacientes com uma média de tempo desde o início do diagnóstico de aproximadamente 5 anos. Em todos os estudos, 48% dos paciente eram mulheres, 81% eram brancos, 15% negros ou asiáticos, 25% tinham 65 anos de idade ou mais, e 5% tinham 75 anos de idade ou mais.
A maioria dos pacientes possuía um longo histórico da doença com tratamentos anteriores extensos, incluindo imatinibe, quimioterapia citotóxica, interferon, e transplante de medula óssea. Em geral, 80% dos pacientes eram resistentes ao imatinibe e 20% eram intolerantes ao imatinibe. A dose máxima de imatinibe havia sido de 400- 600 mg/dia em aproximadamente 60% dos pacientes e > 600 mg/dia em 40% dos pacientes.
O objetivo principal de eficácia na fase crônica da LMC Ph+ foi a resposta citogenética maior ( RCM), definida como eliminação (resposta citogenética completa, RCC) ou diminuição substancial (de pelo menos 65%, resposta citogenética parcial) das células hematopoiéticas Ph+. O objetivo principal de eficácia na fase acelerada, fase mieloide blástica, fase linfoide blástica da LMC Ph+, e na LLA Ph+ foi a resposta hematológica maior (RHM), definida como uma resposta hematológica completa (RHC), ou como nenhuma evidência de leucemia (NEL).
LMC Ph+ em fase crônica recém-diagnosticada
Um estudo Fase 3, aberto, multicêntrico, internacional, randomizado foi realizado em pacientes adultos com LMC Ph+ fase crônica recém-diagnosticada. Os pacientes foram randomizados para receber Dasatinibe 100 mg uma vez ao dia ou imatinibe 400 mg uma vez ao dia. O desfecho primário foi a taxa de resposta citogenética completa confirmada (RCCc) em 12 meses. Os desfechos secundários incluem o tempo em RCCc (medida da duração da resposta), tempo para RCCc, taxa de resposta molecular maior (RMM), tempo para RMM, sobrevida livre de progressão (SLP) e sobrevida global (SG). Outros resultados de eficácia relevantes incluem RCC e taxa de resposta molecular completa (RMC)
Um total de 519 pacientes foram randomizados em um grupo de tratamento: 259 para Dasatinibe e 260 para imatinibe. As características basais foram bem balanceadas entre os dois grupos de tratamento com respeito à idade (a mediana foi de 46 anos para o grupo de Dasatinibe e 49 anos para o grupo de imatinibe com 10% e 11% dos pacientes com 65 anos de idade ou mais, respectivamente), gênero (44% e 37% de mulheres, respectivamente) e raça (51% e 55% de caucasianos, 42% e 36% de asiáticos, respectivamente).
O tempo mediano do diagnóstico inicial de LMC Ph+ até a randomização foi 1 mês (0,03 - 9,72) para Dasatinibe e 1 mês (0,10 - 8,02) para imatinibe. Pacientes com história de doença cardíaca grave foram incluídos neste estudo, exceto aqueles que tiveram infarto do miocárdio nos últimos 6 meses, insuficiência cardíaca congestiva ou angina descontrolada nos últimos 3 meses, arritmias significantes ou prolongamento do intervalo QT.
Na base, a distribuição dos escores de Hasford foi similar nos grupos de tratamento com Dasatinibe e imatinibe (baixo risco: 33% e 34%, risco intermediário: 48% e 47% e alto risco: 19% e 19%, respectivamente). O status de Performance (ECOG) foi também similar nos grupos de tratamento com Dasatinibe e imatinibe (ECOG 0 = 82% e 79%, ECOG 1 = 18% e 20% e ECOG 2 = 0 e 1%, respectivamente).
Com 12 meses de acompanhamento mínimo, 85% dos pacientes randomizados para o grupo de Dasatinibe e 81% dos pacientes randomizados no grupo do imatinibe ainda estavam recebendo tratamento em primeira linha. A descontinuação devido a progressão da doença ocorreu em 3% dos pacientes tratados com Dasatinibe e 5% dos pacientes tratados com imatinibe.
Com acompanhamento mínimo de 60 meses, 61% dos pacientes randomizados para o tratamento com Dasatinibe e 63% dos pacientes randomizados para o tratamento com o imatinibe ainda estavam recebendo tratamento em primeira linha.
A descontinuação devido a progressão da doença ocorreu em 7% dos pacientes tratados com Dasatinibe e 9% em pacientes tratados com imatinibe. Descontinuação devido à falha ao tratamento ocorreu em 4% dos pacientes tratados com Dasatinibe e 5% dos pacientes tratados com imatinibe. Descontinuação devido à intolerância ao tratamento ocorreu em 16% dos pacientes tratados com Dasatinibe e 7% dos pacientes tratados com imatinibe.
Os resultados de eficácia estão apresentados na Tabela 1. Uma proporção maior de paciente estatisticamente significativa no grupo de Dasatinibe alcançou a RCCc comparado com pacientes no grupo de imatinibe dentro dos primeiros 12 meses de tratamento. A eficácia de Dasatinibe foi consistentemente demonstrada entre os diferentes subgrupos, incluindo idade, gênero e escores basais de Hasford.
Tabela 1: Resultados de Eficácia em um Estudo Fase 3 de Pacientes com LMC Ph+ na Fase Crônica Recém-diagnosticados:
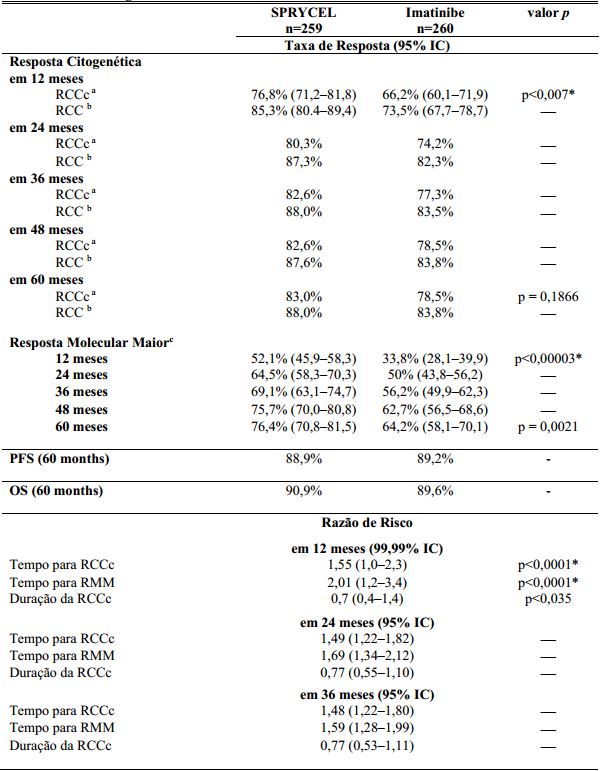
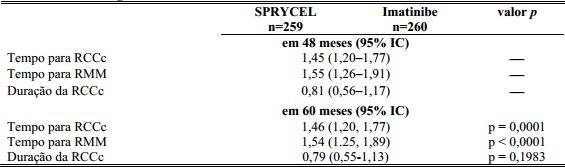
a Resposta citogenética completa confirmada (RCCc) é definida como a resposta notada em duas ocasiões consecutivas (em no mínimo 28 dias de distância).
b Resposta citogenética Completa (RCC) não confirmada é baseada em uma única avaliação citogenética da medula óssea.
c Resposta molecular maior (RMM) (a qualquer momento) é definida como taxas de BCR-ABL ≤0.1% por RQ-PCR em amostra simples de sangue periférico padronizada na escala internacional. Essas taxas cumulativas representam o acompanhamento mínimo para o prazo especificado.
*Ajustado para o índice de risco Hasford e significância estatística indicada em um nível nominal de significância pré-determinado.
IC = Intervalo de Confiança.
O traço na coluna valor p significa dado não calculado.
A progressão da doença foi definida como o aumento das células brancas do sangue apesar de manejo terapêutico apropriado, perda de RHC, perda de RCM, progressão para fase acelerada ou fase blástica, ou morte. Com um mínimo de 60 meses de acompanhamento, transformação para fase blástica ou acelerada ocorreu menos frequentemente com Dasatinibe (n=8, 3,1%) do que com imatinibe (n=15, 5,8%).
Após 60 meses de acompanhamento, o tempo médio para RCCc foi 3,1 meses em 214 respondentes ao Dasatinibe e 5,8 meses em 204 respondentes ao imatinibe. O tempo médio para RMM após 60 meses de acompanhamento foi 9,3 meses em 196 respondentes ao Dasatinibe e 15,0 meses em 163 respondentes ao imatinibe.
O tempo para RMM foi consistentemente menor com pacientes tratados com Dasatinibe comparado com pacientes tratados com imatinibe. Com um acompanhamento mínimo de 60 meses, a taxa de RMC (isto é, ao menos uma redução de 4,5-log a partir do valor base padronizado de relação BCR-ABL ≤0.0032%) a qualquer momento foi 44% e 34% no grupo tratado com Dasatinibe e com imatinibe, respectivamente.
A taxa de RMM a qualquer momento, em cada grupo de risco determinado pelo escore de Hasford, foi maior no grupo de Dasatinibe comparada ao grupo de imatinibe (baixo risco: 90% e 69%; risco intermediário: 71% e 65%; alto risco: 67% e 54%, respectivamente).
A taxa de SLP foi consistentemente maior em pacientes tratados com Dasatinibe que atingiram o nível de BCR-ABL ≤10% em 3 meses dos que não atingiram.
A taxa de SG foi consistentemente maior em pacientes tratados com Dasatinibe que atingiram nível de BCR- ABL≤10% do que aqueles que não atingiram.
Taxas de RMM foram consistentemente maiores nos pacientes tratados com Dasatinibe comparado com os pacientes tratados com imatinibe.
A taxa estimada de SLP de 60 meses foi de 88,9% (IC: 84,0%-92,4%) e 89,2% (IC: 84,3%-92,7%) para o grupo de tratamento com o Dasatinibe e com o imatinibe, respectivamente. As taxas estimadas de sobrevida de 60 meses para os pacientes tratados com Dasatinibe e imatinibe foram 90,9% (IC: 86,6%-93,8%) e 89,6% (IC: 85,2%-92,8%), respectivamente. No acompanhamento mínimo de 60 meses, não houve diferença entre Dasatinibe e imatinibe na SG (HR 1,01, 95% IC: 0,58-1,73, p=0,9800) ou SLP (HR 1,00, 95% IC 0,58-1,72, p=0,9998).
O número de pacientes no grupo Dasatinibe e imatinibe que apresentaram progressão/falha ao tratamento foi 34 (13,1%) e 39 (15%) pacientes, respectivamente.
Após 5 anos de acompanhamento, menos pacientes tratados com Dasatinibe transformaram para fase acelerada ou blástica comparado aos pacientes tratados com imatinibe. Após 12, 24, 36, 48 e 60 meses de tratamento, transformação foi reportada em um total de 5 (1,9%), 6 (2,3%), 8 (3,1%), 8 (3,1%) e 8 (3,1%) pacientes tratados com Dasatinibe comparado com 9 (3,5%), 13 (5,0%), 13 (5,0%), 14(5,4%) e 15 (5,8%) pacientes tratados com imatinibe, respectivamente. Notavelmente, não houve transformação adicional após 36 meses no grupo com Dasatinibe, 2 pacientes adicionais apresentaram transformação no grupo com imatinibe após 36 meses (ambos entre o Ano 4 e 5).
O Tempo até o Benefício Clínico Máximo (TBCM) avalia as razões cumulativas para a descontinuação do tratamento. No estudo CA180056, TBCM foi definido como o tempo desde a randomização até o último dia de medicação no estudo para os pacientes que descontinuaram devido à toxicidade, ou a primeira data na qual o critério para falha ao tratamento foi atingido.
Com um período de acompanhamento mínimo de 5 anos, um maior número de indivíduos foi descontinuado do estudo por causa de progressão, falha do tratamento ou intolerância no grupo de Dasatinibe em comparação com o grupo de imatinibe (74 vs. 55, respectivamente).
Tal diferença do tratamento não se manifestou até depois de 2 anos, momento no qual as curvas de Kaplan-Meier começaram a se separar resultando em um risco maior de eventos de progressão, falha do tratamento ou intolerância ao medicamento para o grupo Dasatinibe em comparação ao grupo imatinibe [HR (IC de 95%): 1,35 (0,95-1,91)].
No estudo de Fase 3 de LMC Ph+ na fase crônica recém-dignosticada, o sequenciamento de BCR-ABL foi realizado em amostras de sangue de pacientes que descontinuaram a terapia com Dasatinibe e imatinibe. Entre os pacientes tratados com Dasatinibe, as mutações detectadas foram T315I (4%), F317I/L (2%) e V299L (3%).
Dasatinibe, imatinibe e nilotinibe não parecem ser ativos contra a mutação T315I, baseado em dados in vitro.
Adicionalmente, mais pacientes tratados com Dasatinibe (84%) atingiram a resposta molecular precoce (definida como níveis de BCR-ABL ≤10% em 3 meses) comparado com os sujeitos tratados com imatinibe (64%). Os pacientes que atingiram resposta molecular precoce em ambos os grupos tiveram menor risco de transformação, maior taxa de sobrevida livre de progressão (SLP) e maior taxa de sobrevida global (SG), como demonstrado nas Tabelas 2 e 3.
Tabela 2: Pacientes tratados com Dasatinibe com BCR-ABL ≤10% e >10% em 3 Meses:
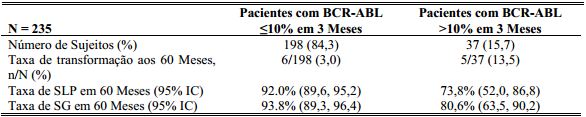
Tabela 3: Pacientes tratados com imatinibe com BCR-ABL ≤10% e >10% em 3 Meses:

 Outros estudos de longo prazo com pacientes com leucemia mieloide crônica recém diagnosticados estão em andamento.
Outros estudos de longo prazo com pacientes com leucemia mieloide crônica recém diagnosticados estão em andamento.
LMC Ph+ fase crônica
Estudo de otimização da dose
Um estudo Fase 3 randomizado, aberto, foi conduzido em pacientes com LMC Ph+ em fase crônica para avaliar a segurança e eficácia de Dasatinibe administrado uma vez ao dia comparado com Dasatinibe administrado duas vezes ao dia. Pacientes com doenças cardíacas significantes incluindo o infarto do miocárdio em 6 meses, insuficiência cardíaca congestiva em 3 meses, arritmias significantes ou prolongamento intervalo QTc foram excluídos do estudo. O objetivo principal de eficácia foi resposta citogenética maior (RCM) em pacientes com LMC Ph+ resistentes ao imatinibe. Um total de 670 pacientes, dos quais 497 eram resistentes ao imatinibe, foram randomizados nos seguintes grupos: 100 mg uma vez ao dia, 140 mg uma vez ao dia, 50 mg duas vezes ao dia ou 70 mg de Dasatinibe duas vezes ao dia. A média da duração do tratamento foi de 22 meses (faixa de <1-31 meses).
A eficácia foi atingida em todos os grupos tratados com Dasatinibe uma vez ao dia demonstrando eficácia comparável (não inferioridade) ao tratamento com Dasatinibe duas vezes ao dia para o objetivo principal de eficácia (diferença da RCM 1,9%; 95% de intervalo de confiança [- 6,8% - 10,6%].), entretanto, o regime de 100 mg uma vez ao dia demonstrou segurança e tolerabilidade melhorada.
Resultados de eficácia para pacientes com LMC Ph+ na fase crônica que receberam a dose inicial recomendada de 100 mg uma vez ao dia estão demonstrados na Tabela 4 e 5.
Tabela 4: Eficácia de Dasatinibe em Estudo Fase 3 de Optimização de Dose: LMC Ph+ na fase crônica Resistente ou Intolerante ao imatinibe (resultados de 2 anos):
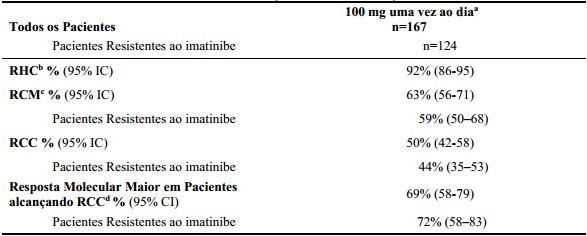
a Resultados reportados em doses iniciais recomendadas de 100 mg uma vez ao dia.
b Critério de resposta hematológica (toda resposta confirmada após 4 semanas): Resposta Hematológica Completa (RHC) (LMC Ph+ de fase crônica): células brancas no sangue ≤ Limite
Superior da Normalidade (LSN) institucional, plaquetas < 450.000/mm3, nenhum blasto ou promielócito no sangue periférico, < 5% mielócitos mais metamielócitos no sangue periférico, basófilos no sangue periférico < 20%, e nenhum envolvimento extramedular.c RCM combina as respostas completa (0% metáfases Ph+) e parcial (> 0%-35%).
d Critério para Resposta Molecular Maior: definido como controle BCR-ABL transcritos ≤0.1% por RQPCR em amostras de sangue periférico.
A eficácia foi avaliada também em pacientes que eram intolerantes ao imatinibe. Nesta população de paciente que recebeu 100 mg uma vez ao dia, RCM foi alcançada em 77% e RCC em 67% de pacientes com acompanhamento mínimo de 2 anos.
Por sete anos, a transformação quer para a fase acelerada ou para fase blástica ocorreram em nove pacientes em tratamento.
LMC Ph+ fase avançada e LLA Ph+
Estudo de otimização da dose
Um estudo Fase 3 randomizado, aberto, foi conduzido em pacientes com LMC Ph+ em fase avançada (LMC Ph+ na fase acelerada, LMC Ph+ na fase mieloide blástica, ou LMC Ph+ na fase linfoide blástica) ou LLA Ph+ para avaliar a eficácia e segurança de Dasatinibe administrado uma vez ao dia comparado com Dasatinibe administrado duas vezes ao dia.
O objetivo principal de eficácia foi resposta hematológica maior (RHM). Um total de 611 pacientes foram randomizados nos grupos de 140 mg de Dasatinibe uma vez ao dia ou de 70 mg de Dasatinibe duas vezes ao dia. A média da duração do tratamento foi de aproximadamente 6 meses para os dois grupos de tratamento (faixa de <1-31 meses). O grupo tratado com Dasatinibe uma vez ao dia demonstrou eficácia comparável (não inferioridade) ao tratamento com Dasatinibe duas vezes ao dia para o objetivo principal de eficácia, entretanto, o regime de 140 mg uma vez ao dia demonstrou segurança e tolerabilidade melhorada.
As taxas de resposta para pacientes no grupo de 140 mg uma vez ao dia estão apresentadas na Tabela 6.
Tabela 5: Eficácia a Longo Prazo de Dasatinibe em Estudo Fase 3 de Optimização de Dose LMC Ph+ de Fase Crônica Resistente ou Intolerante a:
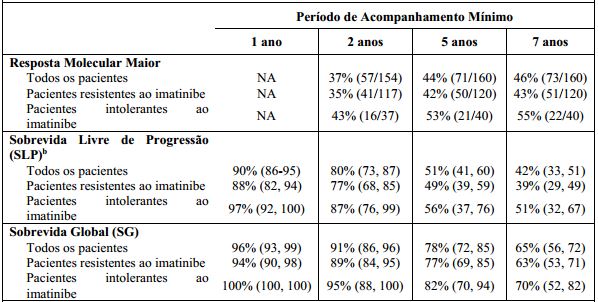
a Resultados reportados para dose recomendada de 100 mg uma vez ao dia.
b Progressão foi definida como aumento na contagem das células brancas sanguíneas, perda da CHR ou MCyR, ≥30% de aumento nas metáfases Ph+, doença AP/BP confirmada ou morte. SLP foi analisada em um princípio de intenção de tratamento e os pacientes foram acompanhados para os eventos incluindo terapia subsequente.
Por sete anos, a transformação quer para a fase acelerada ou para fase blástica ocorreram em nove pacientes em tratamento.
LMC Ph+ fase avançada e LLA Ph+
Estudo de otimização da dose: Um estudo Fase 3 randomizado, aberto, foi conduzido em pacientes com LMC Ph+ em fase avançada (LMC Ph+ na fase acelerada, LMC Ph+ na fase mieloide blástica, ou LMC Ph+ na fase linfoide blástica) ou LLA Ph+ para avaliar a eficácia e segurança de Dasatinibe administrado uma vez ao dia comparado com Dasatinibe administrado duas vezes ao dia.
O objetivo principal de eficácia foi resposta hematológica maior (RHM). Um total de 611 pacientes foram randomizados nos grupos de 140 mg de Dasatinibe uma vez ao dia ou de 70 mg de Dasatinibe duas vezes ao dia. A média da duração do tratamento foi de aproximadamente 6 meses para os dois grupos de tratamento (faixa de <1-31 meses). O grupo tratado com Dasatinibe uma vez ao dia demonstrou eficácia comparável (não inferioridade) ao tratamento com Dasatinibe duas vezes ao dia para o objetivo principal de eficácia, entretanto, o regime de 140 mg uma vez ao dia demonstrou segurança e tolerabilidade melhorada.
As taxas de resposta para pacientes no grupo de 140 mg uma vez ao dia estão apresentadas na Tabela 6.
Tabela 6: Eficácia de Dasatinibe em LMC Ph+ na fase avançada e em LLA Ph+ (Resultados de 2 Anos):

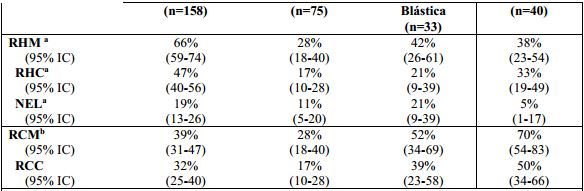
Em paciente com LMC Ph+ na fase acelerada tratados com o regime de 140 mg uma vez ao dia, a duração média da RHM e a sobrevida global (SG) média não foi atingida; a sobrevida livre de progressão (SLP) média foi de 25 meses. Em pacientes com LMC Ph+ na fase blástica mileóide tratados com o regime de 140 mg uma vez ao dia, a duração média da RHM foi 8 meses, a média da SLP foi 4 meses e a média de sobrevida global foi 8 meses. Em pacientes com LMC Ph+ na fase blástica linfóide, a duração média da RHM foi 5 meses, a média da SLP foi 5 meses e a sobrevida global média foi 11 meses. Em pacientes com LLA Ph+ tratados com o regime de 140 mg uma vez ao dia, a duração da RHM foi 5 meses, a média de SLP foi 4 meses e a média de sobrevida global foi 7 meses.
Características farmacológicas
Dasatinibe (Dasatinibe) é inibidor de quinase. O nome químico do Dasatinibe é N-(2-cloro-6-metilfenil)-2-[[6- [4-(2-hidroxietil)-1-piperazinil]-2-metil-4-pirimidinil]amino]-5-tiazolecarboxamida, monoidratado. A fórmula molecular é C22H26ClN7O2S • H2O, o que corresponde a um peso de 506,02 (monoidratado). A base anidra livre possui um peso molecular de 488,01. O Dasatinibe possui a seguinte estrutura química:
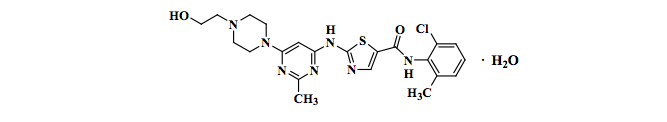
O Dasatinibe é um pó branco a quase branco. O fármaco é insolúvel em água e levemente solúvel em etanol e metanol.
Mecanismo de Ação
O Dasatinibe, em concentrações nanomolares, inibe as seguintes quinases: BCR-ABL, família SRC (SRC, LCK, YES, FYN), c-KIT, EPHA2, e PDGFRβ. Com base em estudos modelo, o Dasatinibe previsivelmente liga-se a conformações múltiplas da quinase ABL.
In vitro, o Dasatinibe é ativo em linhagens celulares leucêmicas representando variações da doença sensível e resistente ao mesilato de imatinibe. O Dasatinibe inibiu o crescimento de linhagens celulares de Leucemia Mieloide Crônica (LMC) e Leucemia Linfoblástica Aguda Cromossomo Philadelphia-positivo (LLA Ph+) com superexpressão de BCR-ABL. Sob as condições dos ensaios, o Dasatinibe foi capaz de superar a resistência ao imatinibe resultante das mutações no domínio da quinase do BCR-ABL, ativação das etapas de sinalização alternativas envolvendo as quinases da família SRC (LYN, HCK) e a superexpressão do gene de resistência a múltiplos medicamentos.
Farmacocinética
Absorção
As concentrações plasmáticas máximas (Cmáx) de Dasatinibe são observadas entre 0,5 e 6 horas (Tmáx), após a administração oral. O Dasatinibe exibe aumentos na AUC proporcionais à dose e características de eliminação lineares na faixa de dose de 15 mg a 240 mg/dia. A média da meia-vida terminal geral do Dasatinibe é de 3 a 5 horas.
Dados de um estudo realizado com 54 indivíduos sadios que receberam uma dose única de 100 mg de Dasatinibe 30 minutos após o consumo de uma refeição rica em gorduras indicaram um aumento de 14% na AUC média do Dasatinibe. Os efeitos dos alimentos não foram clinicamente relevantes.
Distribuição
Nos pacientes, o Dasatinibe apresenta um volume aparente de distribuição de 2505 L, sugerindo que a droga é extensamente distribuída para o espaço extravascular. A ligação do Dasatinibe e o seu metabólito ativo às proteínas plasmáticas humanas in vitro foi aproximadamente 96% e 93%, respectivamente, sem dependência da concentração no intervalo de 100 – 500 ng/ mL.
Metabolismo
O Dasatinibe é extensamente metabolizado em humanos, principalmente pela enzima 3A4 do citocromo P450. CYP3A4 é a principal enzima responsável pela formação do metabólito ativo. As enzimas mono-oxigenase 3 flavina (FMO-3) e a difosfato uridina glucuronosiltransferase (UGT) também estão envolvidas na formação dos metabólitos do Dasatinibe.
A exposição do metabólito ativo, a qual é equipotente ao Dasatinibe, representa aproximadamente 5% da AUC do Dasatinibe. Isso indica que o metabólito ativo do Dasatinibe dificilmente terá alguma função importante na farmacologia observada da droga. O Dasatinibe apresenta diversos outros metabólitos oxidativos inativos.
O Dasatinibe é um fraco inibidor da CYP3A4 dependente do tempo. Em concentrações clinicamente relevantes, Dasatinibe não inibe CYP1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, ou 2E1. O Dasatinibe não é um indutor das enzimas CYP humanas.
Eliminação
A eliminação dá-se principalmente pelas fezes. Após uma dose oral única de Dasatinibe marcado com [14C], aproximadamente 4% e 85% da radioatividade administrada foi recuperada na urina e nas fezes, respectivamente, dentro de 10 dias. O Dasatinibe inalterado contabilizou 0,1% e 19% da dose administrada na urina e fezes, respectivamente, sendo que o restante da dose corresponde aos metabólitos.
Efeitos da idade e gênero
Análises farmacocinéticas dos dados demográficos indicam que não há efeitos clinicamente relevantes sobre a idade e sexo da farmacocinética do Dasatinibe.
A farmacocinética do Dasatinibe não foi avaliada em pacientes pediátricos.
Insuficiência Hepática
Doses de 50 mg e 20 mg de Dasatinibe foram avaliadas em oito pacientes com insuficiência hepática moderada (Child-Pugh Classe B) e sete pacientes com insuficiência hepática grave (Child-Pugh Classe C), respectivamente. Controles combinados com função hepática normal (n=15) também foram avaliados e receberam uma dose de 70 mg de Dasatinibe. Comparados a sujeitos com função hepática normal, pacientes com insuficiência hepática moderada tiveram decréscimos na Cmáx de normalização da dose e AUC de 47% e 8%, respectivamente. Pacientes com insuficiência hepática grave tiveram um decréscimo de 43% na Cmáx de normalização da dose e de 28% na AUC comparado aos controles normais.
Estas diferenças na Cmáx e AUC não são clinicamente relevantes. O ajuste de dose não é necessário em pacientes com insuficiência hepática.
Devido a limitações deste estudo clínico, deve-se ter cautela ao administrar Dasatinibe a pacientes com insuficiência hepática.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)