Qual a ação da substância do Xyntha?
Resultados de Eficácia
Em um estudo principal de fase 3, a eficácia de alfamoroctocogue foi avaliada em profilaxia de rotina e tratamento conforme a necessidade. A profilaxia deveria ser iniciada em uma dose de 30 UI/kg administrada 3 vezes por semana. O regime de dose para tratamento conforme a necessidade deveria ser determinado pelo investigador. Noventa e quatro (94) PTPs (paciente tratado anteriormente) com hemofilia A moderadamente grave ou grave (FVIII:C ≤2%) receberam pelo menos 1 dose de alfamoroctocogue e foram incluídos na população com intenção de tratar (ITT). Oitenta e nove (89) pacientes somaram pelo menos 50 dias de exposição (EDs) a Alfamoroctocogue no estudo.
Dos 94 pacientes na população ITT, 30 pacientes com FVIII:C ≤1% também participaram de um período de estudo de farmacocinética, duplo-cego, randomizado, cruzado e foram incluídos na população por protocolo para análises de equivalência farmacocinética versus outro produto de rFVIII, Advate, e caracterização completa da farmacocinética. Os resultados destas análises mostraram que alfamoroctocogue é farmacocineticamente equivalente a Advate, e o perfil farmacocinético de alfamoroctocogue permaneceu estável após 6 meses de uso repetido.
As variáveis de eficácia de acordo com análise por intenção de tratamento foram positivas tanto na fase aberta de segurança do estudo quanto no período determinado para avaliar a eficácia clínica. Os 94 pacientes receberam alfamoroctocogue para profilaxia de rotina; a dose mediana administrada foi de 30,2 UI/kg (variação, 6,8 a 76,9 UI/kg). A maioria dos pacientes (57/94; 60,6%) não relatou sangramento espontâneo enquanto recebia profilaxia de rotina. A taxa de sangramento anual mediano (ABR) para todos os episódios de sangramento foi 1,9 (média 3,9, variação 0 a 42,1), indicando prevenção eficaz de sangramento na população do estudo.
Cinquenta e três (53) de 94 pacientes receberam alfamoroctocogue para tratamento conforme a necessidade; a dose mediana administrada foi de 30,6 UI/kg (variação, 6,4 a 74,4 UI/kg). A maioria dos episódios de sangramento (173/187; 92,5%) se resolveu com 1 ou 2 infusões. Este resultado não foi restrito a qualquer local de sangramento em particular, uma vez que foi observada eficácia semelhante em sangramento ocorrendo em articulações, tecidos moles/músculos e outros locais. Uma ampla gama de doses foi utilizada para iniciar tratamento de sangramento; no entanto, a distribuição de doses utilizadas para iniciar o tratamento de sangramento foi similar, independentemente do local de sangramento.
Pacientes classificaram a maioria das infusões utilizadas para iniciar o tratamento de sangramento como excelente ou bom (132/187; 70,6%). A incidência de efeito terapêutico menor que o esperado (LETE) ocorreu em uma taxa de 0,4% (25/6404 infusões profiláticas) quando alfamoroctocogue foi administrado para profilaxia e 0,5% (1/187 episódios de sangramento) quando administrado para tratamento conforme a necessidade.
O principal estudo fase 3 (estudo 311) para profilaxia cirúrgica em pacientes com hemofilia A incluiu pacientes previamente tratados (PTPs) com hemofilia A grave ou moderadamente grave (FVIII:C ≤2%) submetidos a procedimentos cirúrgicos de grande porte para receber alfamoroctocogue. Trinta (30) pacientes foram tratados com alfamoroctocogue e compreenderam a população ITT; 29 pacientes foram submetidos a cirurgia de grande porte e concluíram o estudo. Trinta (30) pacientes foram designados para receber alfamoroctocogue por injeção em bolus (IB; 22 pacientes) ou por infusão contínua (IC; 8 pacientes) a critério do médico para indicar hemostasia cirúrgica seguido por cuidado pós-operatório na internação ou ambulatorial.
Um paciente designado para IC recebeu alfamoroctocogue apenas para uma avaliação farmacocinética pré-cirurgia e posteriormente selecionado para não ser submetido à cirurgia. Os 22 pacientes tratados por IB receberam um total de 942 infusões (variando de 16 a 72 infusões por paciente) para uma dose cumulativa total de 2.037.386 UI de alfamoroctocogue ao longo de 682 dias de exposição (EDs) cumulativos totais (variando de 15 a 40 EDs por paciente). Os 8 pacientes designados ao tratamento por IC, incluindo 1 paciente que recebeu apenas 1 dose para avaliação de farmacocinética, recebeu uma dose total de 529.977 UI de alfamoroctocogue ao longo de 204 EDs totais (variação de 1 a 37 EDs por paciente).
Dos 29 pacientes submetidos à cirurgia, 25 foram incluídos na população avaliável de eficácia. Os procedimentos cirúrgicos de grande porte para os 25 pacientes avaliáveis de eficácia foram 11 artroplastias totais de joelho, 1 artroplastia de quadril, 5 sinovectomias, 1 liberação de transposição de nervo ulnar esquerdo, 1 reparação de hérnia abdominal/revisão de cicatriz, 1 artroscopia de joelho, 1 revisão e desbridamento do joelho após uma artroplastia total de joelho, 1 revisão de artroplastia de quadril, 1 substituição do estribo, 1 artrodese de tornozelo e 1 excisão de pseudotumor. Para os 25 pacientes cirúrgicos, as classificações do investigador de eficácia no final da cirurgia e no final do período pós-operatório inicial foram excelentes ou bons para todas as avaliações, perda sanguínea intraoperatória foi relatada como normal ou ausente para todos os procedimentos.
Treze dos 25 pacientes avaliáveis tiveram perda sanguínea no período pós-operatório e em 10 casos, a perda sanguínea pós-operatória foi classificada como normal. Em 3 casos, a perda sanguínea pós-operatória foi classificada como anormal: 1 devido à hemorragia após trauma cirúrgico na artéria epigástrica, 1 devido a uma perda sanguínea de 800 mL após cirurgia de artroplastia de quadril e 1 após uma sinovectomia de cotovelo em que a perda sanguínea não pôde ser medida pelo investigador.
Características Farmacológicas
Modo de Ação
O fator VIII ativado age como um cofator para o fator IX ativado, acelerando a conversão do fator X em fator X ativado. O fator X ativado converte protrombina em trombina. A trombina, então, converte fibrinogênio em fibrina e um coágulo é formado. A atividade de fator VIII é amplamente reduzida em pacientes com hemofilia A e, portanto, é necessária a terapia de reposição. A administração de alfamoroctocogue aumenta os níveis plasmáticos de atividade de fator VIII e pode corrigir temporariamente o defeito de coagulação nestes pacientes.
Propriedades Farmacodinâmicas
O alfamoroctocogue, fator VIII de coagulação recombinante é uma glicoproteína com uma massa molecular aproximada de 170.000 Da consistindo em 1.438 aminoácidos, que não contém o domínio B não funcional. O alfamoroctocogue é uma substância à base de DNA recombinante que tem características funcionais comparáveis às do fator VIII endógeno.
O complexo fator VIII/fator de von Willebrand consiste em duas moléculas (fator VIII e fator de von Willebrand) com diferentes funções fisiológicas. Quando administrado por infusão a um paciente hemofílico, o fator VIII se liga ao fator de von Willebrand na circulação do paciente.
Fator VIII ativado age como um cofator para o fator IX ativado, acelerando a conversão do fator X em fator X ativado. Fator X ativado converte protrombina em trombina. A trombina, então, converte fibrinogênio em fibrina e um coágulo é formado.
Hemofilia A é um distúrbio hereditário de coagulação sanguínea, ligado ao cromossomo X, devido a níveis reduzidos de fator VIII:C e causa sangramento em articulações, músculos ou órgãos internos, seja espontaneamente ou como resultado de trauma acidental ou cirúrgica. Com a terapia de reposição, os níveis plasmáticos de fator VIII são elevados, permitindo, assim, uma correção temporária da deficiência do fator e correção das tendências de sangramento.
Propriedades Farmacocinéticas
Em um estudo clínico principal, cruzado, (estudo 310) alfamoroctocogue demonstrou ser farmacocineticamente equivalente a Advate,* outro produto de fator VIII recombinante, em 30 pacientes tratados anteriormente (≥12 anos) utilizando a abordagem de bioequivalência padrão com base no ensaio de coagulação de estágio único. As razões de médias geométricas de mínimos quadrados de alfamoroctocogue-Advate foram de 100%, 89,8% e 88,0% para valor K, AUCt e AUC∞, respectivamente. Os intervalos de confiança correspondentes de 90% sobre as razões das médias geométricas de alfamoroctocogue-Advate estavam dentro da janela de bioequivalência de 80% a 125%, demonstrando equivalência farmacocinética entre alfamoroctocogue e Advate.
No mesmo estudo, os parâmetros farmacocinéticos para Alfamoroctocogue foram determinados na visita basal e acompanhados em 25 pacientes tratados anteriormente (≥12 anos) após administração repetida de alfamoroctocogue por seis meses.
Após uma única infusão intravenosa de 2 minutos da dose de 50 UI/kg de dose de alfamoroctocogue, FVIII:C no plasma aumentou acentuadamente com uma Cmax média (±SD) de 1,12 (±0,19) UI/mL. A partir de então, o declínio de FVIII:C exibiu uma característica de disposição bifásica. Na fase inicial, a atividade caiu para uma taxa compatível com uma distribuição relativamente rápida, mas limitada, no espaço extravascular.
O volume de distribuição médio no estado de equilíbrio (±SD) foi de 65,1 (± 35,1) mL/kg. Durante a fase terminal, a taxa de declínio em FVIII:C foi mais lenta que a fase inicial com uma meia-vida de eliminação média (±SD) de 11,8 (±5,1) horas. Um perfil farmacocinético comparável foi obtido após o uso repetido por seis meses (ver Tabela abaixo1). As razões de médias geométricas de mínimos quadrados para farmacocinética do mês 6-visita basal foram de 107%, 100% e 104% para valor K, AUCt e AUC∞, respectivamente.
Os respectivos intervalos de confiança de 90% sobre as razões do mês 6–visita basal para os parâmetros farmacocinéticos acima estavam dentro da janela de bioequivalência de 80% a 125%. Isto indica alterações não dependentes de tempo nas propriedades farmacocinéticas de alfamoroctocogue.
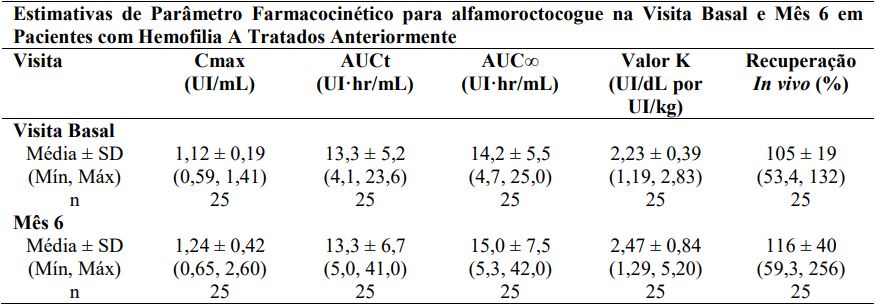
Abreviações: AUC∞= área sob a curva concentração plasmática-tempo do tempo zero até o infinito; AUCt = área sob a curva concentração plasmática-tempo de zero até a última concentração mensurável; Cmax = pico de concentração; Valor K = recuperação crescente; SD = desvio padrão.
Em um estudo principal de fase III (estudo 311) para profilaxia cirúrgica, a farmacocinética de alfamoroctocogue foi avaliada durante o tratamento perioperatório de pacientes com hemofilia A submetendo-se a cirurgia de grande porte. Na visita basal, todos os pacientes receberam uma dose única de alfamoroctocogue de aproximadamente 50 UI/kg. Amostras plasmáticas foram analisadas quanto à atividade de FVIII utilizando-se um método de coagulação validado de um estágio (OS). Os dados de recuperação estão disponíveis para um total de 30 pacientes; o valor K médio (± desvio padrão [SD]) foi de 2,11 (±0,43) UI/dL por UI/kg e o valor de recuperação médio in vivo (±SD) foi de 101,0% (±20%).
Em pacientes sem tratamento anterior (PUPs), os parâmetros farmacocinéticos do produto antecessor ReFacto foram avaliados utilizando-se o ensaio cromogênico. Estes pacientes (n = 59; idade mediana 10 ± 8,3 meses) tiveram uma recuperação crescente média na Semana 0 de 1,5 ± 0,6 UI/dL por UI/kg (variação 0,2-2,8 UI/dL por UI/kg), que foi menor que aquela obtida em PTPs na Semana 0 com um valor K médio de 2,4 + 0,4 UI/dL por UI/kg (variação 1,1-3,8 UI/dL por UI/kg). A recuperação crescente média foi estável ao longo do tempo (5 visitas durante um período de 2 anos) e variou de 1,5 a 1,8 UI/dL por UI/kg. O modelo farmacocinético da população utilizando dados de 44 PUPs levou a uma meia-vida média estimada de 8,0 ± 2,2 horas.
Dados de Segurança Pré-Clínicos
Não foram conduzidos estudos com alfamoroctocogue para avaliar seu potencial mutagênico ou carcinogênico.
Foi demonstrado que alfamoroctocogue é comparável ao produto antecessor ReFacto em relação a suas propriedades bioquímicas e fisicoquímicas, assim como sua toxicologia e farmacologia pré-clínicas in vivo. Por inferência, seria esperado que o produto antecessor ReFacto e Alfamoroctocogue tivessem potencial mutagênico e carcinogênico equivalentes. Foi demonstrado que o produto antecessor ReFacto não é genotóxico no ensaio de micronúcleo de camundongo. Não foram conduzidos estudos em animais para avaliar carcinogênese, comprometimento da fertilidade ou desenvolvimento fetal.
Em estudos pré-clínicos, alfamoroctocogue foi utilizado para restaurar a hemostasia de forma segura e eficaz. O alfamoroctocogue demonstrou um perfil toxicológico que foi semelhante ao perfil toxicológico observado com o produto antecessor ReFacto, que por sua vez demonstrou ter um perfil toxicológico semelhante ao produto de fator VIII derivado do plasma quando testado em estudos de toxicologia de doses repetidas em animais.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)