Qual a ação da substância do Waylivra?
Resultados de Eficácia
Eficácia clínica
Estudo APPROACH em pacientes com SQF
O estudo APPROACH é um estudo clínico multicêntrico, aleatorizado e duplo cego, controlado por placebo e com 52 semanas de duração realizado em 66 pacientes com SQF para avaliação da administração de 285 mg de Volanesorsena como injeção subcutânea (33 tratados com Volanesorsena e 33 com placebo). Os principais critérios de inclusão foram o diagnóstico de SQF (hiperlipoproteinemia tipo 1) em combinação com antecedentes de quilomicronemia evidenciada por documentação de soro lactescente ou medição de TG em jejum ≥ 880 mg/dl.
Para o diagnóstico de SQF foi exigida documentação de pelo menos um dos seguintes critérios:
- Homozigoto, heterozigoto composto, ou heterozigoto duplo confirmados para mutações de perda de função conhecida nos genes causadores da SQF (como LPL, APOC2, GPIHBP1 ou LMF1).
- Atividade da LPL plasmática pós-heparina ≤ 20% do normal.
Os pacientes que tomaram Glybera nos 2 anos anteriores à triagem foram excluídos do estudo.
Dos 33 pacientes no grupo de Volanesorsena, 19 completaram 12 meses de tratamento do estudo. Treze destes pacientes tiveram ajuste/pausa da dose no estudo. Dos 13, 5 tiveram uma pausa, 5 tiveram um ajuste da dose e 3 tiveram pausa e ajuste da dose.
A idade média foi de 46 anos (intervalo dos 20 aos 75 anos; 5 pacientes tinham idade ≥ 65 anos); 45% eram homens; 80% eram caucasianos, 17% eram asiáticos e 3% eram de outras raças. O índice de massa corporal médio era de 25 kg/m2 . Foram descritos antecedentes de pancreatite aguda documentada em 76% dos pacientes e de diabetes em 15% dos pacientes; 21% dos pacientes tinham antecedentes registrados de lipemia retinal e 23% de xantomas eruptivos. A idade mediana no diagnóstico foi de 27 anos, sendo que 23% demonstraram não ter mutação genética conhecida para SQF.
No momento da entrada no estudo, 55% dos pacientes estavam em tratamento com hipolipemiantes (48% com fibratos, 29% com óleos de peixe e 20% com inibidores de HMG-CoA redutase), 27% estavam em tratamento com medicamentos analgésicos, 20% estavam medicados com inibidores da agregação plaquetária e 14% estavam tomando suplementos nutricionais. As terapias hipolipemiantes de base permaneceram consistentes ao longo do estudo. Nas 4 semanas anteriores à triagem ou durante o estudo, os pacientes não puderam receber aférese plasmática; 11% dos pacientes tinham recebido previamente terapia gênica para deficiência da lipoproteína lipase (ou seja, alipogene tiparvovec), em média 8 anos antes de iniciarem este estudo. Após um período inicial de dieta durante 6 semanas, o nível médio de triglicérides em jejum no início do estudo foi de 2209 mg/dl (25,0 mmol/L). O cumprimento da dieta e da restrição alcoólica foi reforçado através de sessões de aconselhamento periódicas durante o estudo.
Volanesorsena levou a uma redução estatisticamente significativa dos níveis de triglicérides em comparação com o placebo no desfecho primário da eficácia, definido como a alteração percentual desde o início do estudo até ao 3.º mês nos triglicérides em jejum, além de uma incidência mais baixa de pancreatite ao longo do período de tratamento de 52 semanas em uma análise post-hoc (Tabela 1).
No desfecho primário da eficácia, a diferença de tratamento entre a Volanesorsena e o placebo na alteração percentual do valor médio de triglicérides em jejum foi de -94% (IC de 95%: - 122%, -67%; p ˂ 0,0001), com diminuição de -77% desde o início do estudo (IC de 95%: -97, -56) em pacientes medicados com Volanesorsena e um aumento de 18% desde o início do estudo (IC de 95%: - 4, 39) em pacientes medicados com placebo (Tabela 1).
Tabela 1: Alteração média nos triglicérides em jejum desde o início do tratamento no estudo de Fase 3 controlado por placebo em pacientes com SQF no 3.º mês(APPROACH)
| - | Placebo (N = 33) | Volanesorsena 285 mg (N = 33) | Diferença relativa na alteração vs. placebo |
| Alteração percentual média dos mínimos quadrados (IC de 95%) | +18% (-4, 39) | -77% (-97, -56) | -94%* (-122, -67) |
| Alteração absoluta média dos mínimos quadrados (IC de 95%) mg/dl ou mmol/L | +92 (-301, +486) mg/dl | -1 712 (-2 094, -1 330) mg/dl | -1 804 (-2 306, -1 302) mg/dl |
| +1 (-3, +5) mmol/L | -19 (-24, -15) mmol/L | 20 (-26, -15) mmol/L |
*Valor “p” < 0,0001 (desfecho primário da eficácia).
Diferença = média dos mínimos quadrados de [alteração percentual de Volanesorsena – alteração percentual de placebo] (modelo ANCOVA).
O início da redução foi rápido com separação do placebo observada tão cedo quanto as 4 semanas, tendo a resposta máxima sido observada às 12 semanas, com uma redução dos triglicérides clínica e estatisticamente significativa mantida ao longo das 52 semanas (Figura 1). A alteração percentual média dos triglicérides em jejum foi significativamente diferente entre os grupos de Volanesorsena e placebo aos 3, 6 e 12 meses; o grupo de Volanesorsena incluiu pacientes que não concluíram a administração posológica, mas que regressaram para avaliações durante o estudo de 52 semanas. Não se observaram diferenças significativas no efeito do tratamento nos fatores de estratificação acerca da presença ou ausência simultânea de ácidos graxos omega-3 ou fibratos.
Figura 1: Alteração percentual da média dos mínimos quadrados nos triglicérides em jejum no estudo de Fase 3 em pacientes com SQF (APPROACH)
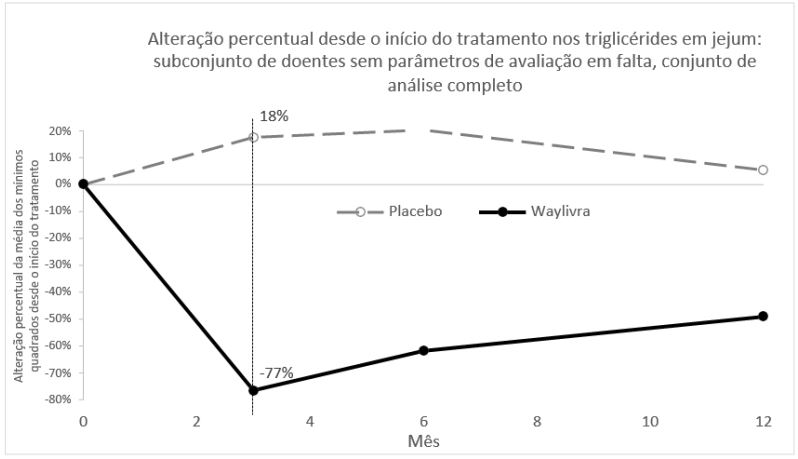
É apresentada a alteração percentual da média dos mínimos quadrados desde o início do estudo em triglicérides em jejum com base nos dados observados.
Diferença = média dos mínimos quadrados de [alteração percentual de Volanesorsena – alteração percentual de placebo] (modelo ANCOVA).
Valor “p” do modelo ANCOVA < 0,0001 no 3.º mês (desfecho primário da eficácia), 6.º mês e 12.º mês.
Os resultados adicionais de eficácia para alterações nos triglicérides são apresentados na Tabela 2. A maioria dos pacientes medicados com Volanesorsena apresentou redução clinicamente significativa dos triglicérides.
Tabela 2: Resultados adicionais para alterações dos triglicérides no estudo APPROACH (desfecho primário no 3.º mês)
| Parâmetro no 3.º mêsa | Placebo (N = 31) | Volanesorsena 285 mg (N = 30) |
| Percentagem de pacientesb com triglicérides plasmáticos em jejum < 750 mg/dl (8,5 mmol/L)* | 10% | 77% |
| Percentagem de pacientesc com redução ≥ 40% dos triglicérides em jejum** | 9% | 88% |
a O desfecho do 3.º mês foi definido como a média das avaliações em jejum da 12.ª semana (78.º dia) e da 13.ª semana (85.º dia). Se havia 1 consulta em falta, foi utilizada outra consulta como desfecho.
b O denominador para o cálculo da percentagem foi o número total de pacientes em FAS com valores iniciais de triglicérides em jejum ≥750 mg/dl (ou 8,5 mmol/L) em cada grupo de tratamento.
c O denominador para o cálculo da percentagem foi o número total de pacientes em cada grupo de tratamento.
* Valor “p” = 0,0001.
**Valor “p” < 0,0001.
Os valores “P” do modelo de regressão logística com tratamento, presença de pancreatite e presença de ácidos graxos omega-3 e/ou fibratos como fatores e triglicérides iniciais em jejum transformados em logaritmo como covariável.
No estudo APPROACH, a incidência numérica de pancreatite em pacientes tratados com Volanesorsena foi inferior quando comparada com a do placebo (3 pacientes, 4 eventos em 33 pacientes no grupo de placebo vs. 1 paciente, 1 evento em 33 pacientes no grupo de Volanesorsena).
Uma análise de pacientes com antecedentes de eventos de pancreatite recorrentes (≥ 2 eventos nos últimos 5 anos antes do 1.º dia do estudo) demonstrou uma redução significativa nos ataques de pancreatite nos pacientes tratados com Volanesorsena em comparação com os pacientes tratados com placebo (p = 0,0242). No grupo de Volanesorsena, dos 7 pacientes que tinham tido 24 ataques de pancreatite adjudicados nos últimos 5 anos, nenhum deles apresentou um ataque de pancreatite durante o período de tratamento de 52 semanas. No grupo placebo, dos 4 pacientes que tinham tido 17 ataques de pancreatite adjudicados nos últimos 5 anos, 3 pacientes apresentaram 4 ataques de pancreatite durante o período de tratamento de 52 semanas.
Redução de eventos de pancreatite durante o período de tratamento em pacientes tratados com Volanesorsena
CS16, um estudo de Fase 3, randomizado, duplo-cego, controlado por placebo, conduzido em 113 pacientes com hipertrigliceridemia grave [triglicérides plasmático em jejum ≥ 500 mg/dL (5,7 mmol/L)], incluindo pacientes com SQF, avaliou o tratamento com Volanesorsena 285 mg administrado uma vez por semana como injeção subcutânea (75 tratados com Volanesorsena, 38 com placebo).
Em uma análise post-hoc do conjunto de estudos Fase 3, APPROACH e CS16, foi demonstrada uma diminuição estatisticamente significativa na incidência de pacientes com pancreatite adjudicada: um total de 1 paciente (1% usando a abordagem de Cochran-Mantel-Haenszel) no conjunto de grupo Volanesorsena apresentou 1 evento durante o tratamento em comparação com 6 pacientes (8% usando a abordagem Cochran-Mantel-Haenszel) no grupo placebo que apresentou um total de 9 eventos durante o tratamento.
Tabela 3: Resumo de Pancreatite Adjudicada Durante o Tratamento nos Estudos APPROACH e CS16 (Conjunto de Análises Completo)
| Incidência de Pancreatite Adjudicada Durante o Tratamentoa | Placebo | Volanesorsen | ||
| Pacientes (N) | Eventos | Pacientes (N) | Eventos | |
| APPROACH | 3 (33) | 9 | 1 (33) | 1 |
| Valor-p | 0,6132 | |||
| CS16 | 3 (38) | 5 | 0 (75) | 0 |
| Valor-p | 0,0360 | |||
| APPROACH + CS16b | 6 (71) | 9 | 1 (108) | 1 |
| Valor-p | 0,0185 | |||
a Uma pancreatite aguda durante o tratamento é definida como qualquer pancreatite aguda que ocorreu desde a primeira dose do medicamento em estudo até 28 dias após a última dose do medicamento em estudo.
b A proporção combinada é ajustada por estudo usando a abordagem Cochran-Mantel-Haenszel (CMH).
Estudo de extensão aberto em pacientes com SQF
O CS7 é um estudo de Fase 3 de extensão aberto, multicêntrico, para avaliar a segurança e eficácia da dosagem e dosagem prolongada com Volanesorsena em pacientes com SQF. Todos os pacientes inscritos ou participaram do estudo APPROACH, ou do estudo CS16, ou eram novos pacientes com SQF e que concluíram as avaliações de qualificação antes de receberem 285 mg de Volanesorsena uma vez por semana ou uma frequência reduzida por razões de segurança ou tolerabilidade determinadas em seu estudo pivotal. Um total de 68 pacientes foram tratados e 4 (6%) pacientes no grupo nunca tratado continuam em tratamento. Cinquenta pacientes tiveram uma pausa de dose, 44 tiveram um ajuste de dose e 41 tiveram uma pausa de dose e um ajuste de dose.
Os dados do Estudo CS7 são fornecidos na Tabela 4. A mudança percentual no TG em jejum do valor basal do Estudo Principal até o Estudo Aberto no Mês 3 para os pacientes APPROACH e CS16-Volanesorsena foi de -49,2% e -64,9%, respectivamente. A variação percentual no TG em jejum desde o valor basal do Estudo Principal até o Estudo Aberto no Mês 6, Mês 12 e Mês 24 para os pacientes APPROACH-Volanesorsena foi de -54,8%, -35,1% e -50,2, respectivamente.
Tabela 4: Resumo dos triglicérides em jejum (média [DP, EPM], mg/dl) ao longo do tempo no estudo CS7 (n=68)
| Momento de avaliação | Grupo nunca tratado (“naïve”) (valor inicial do estudo abertoa, N = 51) | APPROACH-Volanesorsena (valor inicial do estudo principala, N = 14) | CS16-Volanesorsena (valor inicial do estudo principala, N = 3) | ||||||
| n | Valor observado | Alteração percentual desde o início no CS7 | n | Valor observado | Alteração percentual desde o início no APPROACH | n | Valor observado | Alteração percentual desde o início no CS16 | |
| Início do estudoa | 51 | 2341 (1193, 167) | - | 14 | 2641 (1228, 328) | - | 3 | 2288 (1524, 880) | - |
| 3º mês | 47 | 804 (564, 82) | -59,8 (37,0, 5,4) | 14 | 1266 (812, 217) | -49,2 (34,8, 9,3) | 3 | 855 (651, 376) | -64,9 (9,1, 5,3) |
| 6º mês | 49 | 1032 (695, 99) | -45,5 (42,9, 6,1) | 13 | 1248 (927, 257) | -54,8 (23,8, 6,6) | 3 | 1215 (610, 352) | -43,0 (19,7, 11,4) |
| 12º mês | 45 | 1332 (962, 143) | -36.3 (44.2, 6.6) | 12 | 1670 (1198, 346) | -35,1 (45,6, 13,2) | 3 | 1351 (929, 536) | -41.6 (36.3, 21.0) |
| 15º mês | 34 | 1328 (976, 167) | -35.6 (48.1, 8.2) | 10 | 1886 (1219, 386) | -26,5 (57,4, 18,1) | 2 | 1422 (190, 135) | 3.4 (23.3, 16.5) |
| 18º mês | 27 | 1367 (938, 181) | -37.5 (45.6, 8.8) | 7 | 1713 (1122, 424) | -38,4 (32,2, 12,2) | 2 | 1170 (843, 596) | -24.0 (31.9, 22.6) |
| 24º mês | 19 | 1214 (832, 191) | -41.4 (49.8, 11.4) | 5 | 1826 (1743, 780) | -50.2 (32.2, 14.4) | 2 | 1198 (1177, 832) | -26.3 (56.0, 39.6) |
a Os valores iniciais para o grupo nunca tratado (“naïve”) foram retirados do estudo CS7 aberto e o valor inicial para os grupos do APPROACH-Volanesorsena e CS16-Volanesorsena foram retirados do respetivo estudo principal.
NC = não calculado.
População idosa
Os estudos clínicos incluíram 4 pacientes com SQF com 65 anos de idade tratados com Volanesorsena em estudos de controle aleatorizados (estudo CS2 de fase II, 1 paciente; estudo APPROACH, 3 pacientes) e 6 pacientes com idade igual ou superior a 65 anos no estudo de extensão aberto (CS7). Não foram observadas diferenças globais na segurança ou na eficácia entre estes pacientes e pacientes mais jovens, contudo, os dados nesta subpopulação são limitados.
Referências bibliográficas
BLOM, Dirk J. et al. Characterizing familial chylomicronemia syndrome: baseline data of the APPROACH study. Journal of clinical lipidology, v. 12, n. 5, p. 1234-1243. e5, 2018.
GOUNI-BERTHOLD, Ioanna. Significant Quality of Life Improvement Observed in a Patient With FCS Associated With a Marked Reduction in Triglycerides. Journal of the Endocrine Society, v. 4, n. 2, p. bvz035, 2020.
WITZTUM, Joseph L. et al. Volanesorsen and triglyceride levels in familial chylomicronemia syndrome. New England Journal of Medicine, v. 381, n. 6, p. 531-542, 2019.
Características Farmacológicas
Propriedades farmacodinâmicas
Grupo farmacoterapêutico: Outros agentes modificadores de lipídios, código ATC: C10AX18
Mecanismo de ação
A Volanesorsena é um oligonucleótido antisense desenvolvido para inibir a formação da apoC-III, uma proteína reconhecida por regular tanto o metabolismo dos triglicérides como a depuração hepática de quilomícrons e de outras lipoproteínas ricas em triglicérides. A ligação seletiva de Volanesorsena ao ácido ribonucleico mensageiro (mRNA) da apoC-III dentro da região 3′ não traduzida, na posição de bases 489-508, causa a degradação do mRNA. Esta ligação impede a tradução da proteína apoC-III, removendo, assim, um inibidor da depuração de triglicérides e ativando o metabolismo através de uma via independente de LPL.
Efeitos farmacodinâmicos
Efeitos de Volanesorsena nos parâmetros lipídicos
Em pacientes com SQF no estudo clínico de Fase 3 APPROACH, Volanesorsena reduziu os níveis de triglicérides em jejum, colesterol total, colesterol não-HDL, apoC-III, apoB-48 e triglicérides nos quilomícrons e aumentou o LDL-C, o HDL-C e a apoB (ver Tabela 5). O início da redução foi rápido, com a separação do placebo, observado tão cedo quanto as 4 semanas, tendo a resposta máxima sido observada às 12 semanas.
Tabela 5: Valor inicial e alteração percentual médios dos parâmetros lipídicos desde o início do tratamento até o 3º mês
| Parâmetro lipídico (g/L para apoC-III, apoB e apoB-48; mmol/L para colesterol e triglicérides) | Placebo (N = 33) | Volanesorsena 285 mg (N = 33) | ||
| Valor inicial | Alteração percentual | Valor inicial | Alteração percentual | |
| Triglicérides | 24,3 | +24% | 25,6 | -72% |
| Colesterol total | 7,3 | +13% | 7,6 | -39% |
| LDL-C | 0,72 | +7% | 0,73 | +139% |
| HDL-C | 0,43 | +5% | 0,44 | +45% |
| Não HDL-C | 6,9 | +14% | 7,1 | -45% |
| ApoC-III | 0,29 | +6% | 0,31 | -84% |
| ApoB | 0,69 | +2% | 0,65 | +20% |
| ApoB-48 | 0,09 | +16% | 0,11 | -75% |
| Triglicérides nos quilomícrons | 20 | +38% | 22 | -77% |
Eletrofisiologia cardíaca
Numa concentração do fármaco 4,1 vezes superior ao pico das concentrações plasmáticas do fármaco (Cmáx) da dose máxima recomendada (injeção subcutânea de 285 mg), Volanesorsena não prolongou o intervalo QT corrigido para a frequência cardíaca (QTc).
Propriedades farmacocinéticas
Absorção
Após a injeção subcutânea, o pico das concentrações plasmáticas de Volanesorsena é tipicamente atingido em 2 a 4 horas. A biodisponibilidade absoluta de Volanesorsena após uma administração subcutânea única é de aproximadamente 80% (mais provavelmente superior porque foi utilizada uma AUC de 0 a 24 horas e Volanesorsena tem uma meia-vida > 2 semanas).
Após uma dose de 285 mg uma vez por semana em pacientes com SQF, a média geométrica estimada (% de coeficiente de variação da média geométrica) da Cmáx estacionária é de 8,92 µg/ml (35%), a AUC0-168h é de 136 µg*h/ml (38%) e a Cmín é de 127 ng/ml (58%) em pacientes que permaneçam negativos para anticorpos antifármaco. Um regime posológico alternativo de 285 mg de Volanesorsena a cada duas semanas resulta numa Cmín,ss de aproximadamente 58,0 ng/ml com Cmáx e AUC similares quando comparadas com o regime posológico de uma vez por semana.
Distribuição
Volanesorsena foi rápida e largamente distribuída para os tecidos após administração subcutânea ou intravenosa em todas as espécies avaliadas. O volume de distribuição estacionário (Vss) estimado em pacientes com SQF é de 330 L. A Volanesorsena está altamente ligada às proteínas plasmáticas humanas (> 98%) e a ligação é independente da concentração.
Estudos in vitro demonstram que Volanesorsena não é um substrato nem inibidor da glicoproteína-P (P-gp), proteína de resistência ao câncer da mama (BCRP), polipeptídios de transporte de ânions orgânicos (OATP1B1, OATP1B3), bomba de exportação de sais biliares (BSEP), transportadores de cátions orgânicos (OCT1, OCT2) ou transportadores de ânions orgânicos (OAT1, OAT3).
Biotransformação
Volanesorsena não é um substrato para o metabolismo da CYP e é metabolizado nos tecidos por endonucleases, originando oligonucleotídeos mais curtos que servem depois de substrato para o metabolismo adicional por exonucleases. A Volanesorsena inalterada é o componente circulante predominante.
Estudos in vitro indicam que a Volanesorsena não é um inibidor de CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 ou CYP3A4 nem indutor de CYP1A2, CYP2B6 ou CYP3A4.
Eliminação
A eliminação envolve o metabolismo nos tecidos e também a excreção urinária. A recuperação urinária do fármaco-mãe no ser humano foi limitada, sendo uma dose < 3% da dose subcutânea administrada recuperada dentro de 24 horas após a administração. O fármaco-mãe e os metabólitos de cadeia curta de 5- a 7-mer corresponderam a aproximadamente 26% e 55% dos oligonucleotídeos recuperados na urina, respetivamente. Após a administração subcutânea, a meia-vida de eliminação terminal é de aproximadamente 2 a 5 semanas.
Em animais, a eliminação de Volanesorsena foi lenta e ocorreu principalmente por excreção urinária, o que reflete uma depuração plasmática rápida principalmente para os tecidos. Tanto Volanesorsena como os metabólitos de oligonucleotídeos curtos (predominantemente metabolitos 7-mer [gerados a partir de 3′-deleções ou 5′-deleções]) foram identificados na urina humana.
Linearidade/não linearidade
A farmacocinética de dose única e múltipla de Volanesorsena em voluntários saudáveis e em pacientes com hipertrigliceridemia demonstrou que a Cmáx de Volanesorsena é proporcional à dose num intervalo de 100 mg a 400 mg e que a AUC é ligeiramente mais elevada do que a proporcional à dose no mesmo intervalo de dose. O estado estacionário foi atingido aproximadamente 3 meses após o início de Volanesorsena. Foi observada acumulação na Cmín (7 a 14 vezes), tendo sido observado um pequeno aumento ou nenhum aumento na Cmáx ou AUC após administração SC semanal num intervalo de dose de 200 mg a 400 mg. Foi observada alguma acumulação na AUC e Cmáx num intervalo de dose de 50 mg a 100 mg. Como a dose administrada será de 285 mg a cada duas semanas, ou de 142,5 mg semanalmente, prevê-se um pequeno aumento na Cmáx ou AUC após administração de múltiplas doses em contexto clínico.
Populações especiais
Comprometimento renal
Uma análise farmacocinética da população sugere que o comprometimento renal leve e moderado não tem efeito clinicamente relevante sobre a exposição sistêmica à Volanesorsena. Não estão disponíveis dados em pacientes com compromisso renal grave.
Comprometimento hepático
A farmacocinética de Volanesorsena em pacientes com comprometimento hepático não é conhecida.
Idade, sexo, peso e raça
Baseado na análise farmacocinética da população, a idade, o peso corporal, o sexo ou a raça não têm efeito clinicamente relevante sobre a exposição a Volanesorsena. Os dados disponíveis para indivíduos com idade > 75 anos são limitados.
Formação de anticorpos anti-volanesorsena que afeta a farmacocinética
A formação de anticorpos de ligação à Volanesorsena pareceu aumentar a Cmín total de 2 para 19 vezes.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)