Qual a ação da substância do Vsiqq?
Resultados de Eficácia
A segurança e a eficácia do Brolucizumabe foram avaliadas em dois estudos de Fase III randomizados, multicêntricos, duplomascarados e de controle ativo (HAWK e HARRIER) em pacientes com DMRI neovascular (úmida). Um total de 1.817 pacientes foram tratados nesses estudos por dois anos (1.088 com Brolucizumabe e 729 com aflibercepte). A idade dos pacientes variou de 50 a 97 anos, com uma idade média de 76 anos.
No HAWK, os pacientes foram randomizados na proporção de 1:1:1 para os seguintes regimes posológicos:
- Brolucizumabe 3mg administrado a cada 12 ou a cada 8 semanas (q12w/q8w) após as primeiras 3 doses mensais;
- Brolucizumabe 6 mg administrado a cada 12 ou a cada 8 semanas (q12w/q8w) após as primeiras 3 doses mensais;
- Aflibercepte 2 mg administrado a cada 8 semanas (q8w) após as primeiras 3 doses mensais.
No HARRIER, os pacientes foram randomizados na proporção de 1:1 para os seguintes regimes posológicos:
- Brolucizumabe 6 mg administrado a cada 12 ou a cada 8 semanas (q12w/q8w) após as primeiras 3 doses mensais;
- Aflibercepte 2 mg administrado a cada 8 semanas (q8w) após as primeiras 3 doses mensais.
Em ambos os estudos, após as três primeiras doses mensais (semana 0, 4 e 8), os pacientes com brolucizumabe foram tratados q12w (cada 12 semanas), com a opção de ajustar o intervalo de doses para q8w (cada 8 semanas) com base na atividade da doença.
A atividade da doença foi avaliada por um médico durante o primeiro intervalo de 12 semanas (nas semanas 16 e 20) e em cada visita de tratamento subsequente programada em intervalo de 12 semanas. Os pacientes que apresentaram atividade da doença (por exemplo, diminuição da acuidade visual, aumento da espessura do subcampo central (CST) e/ou presença de fluidos da retina (IRF/SRF, sub-RPE)) em qualquer uma dessas visitas, foram ajustados para um intervalo de tratamento de 8 semanas.
Resultados
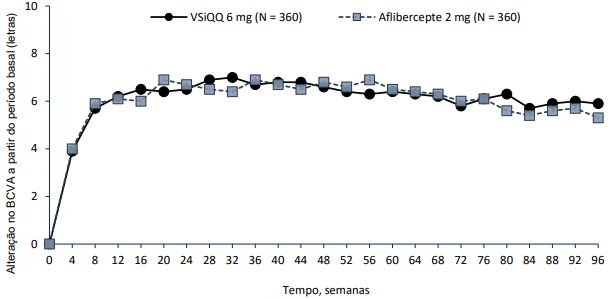
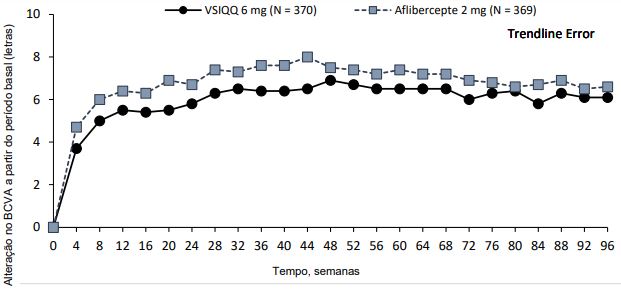
O desfecho primário de eficácia dos estudos foi a mudança da Melhor Acuidade Visual Corrigida na semana 48 em relação ao valor medido na linha de base (BCVA), conforme medida pelo Early Treatment Diabetic Retinopathy Study (ETDRS), com o objetivo principal de demonstrar a não inferioridade do Brolucizumabe vs aflibercepte. Nos dois estudos, o Brolucizumabe (administrado em regime q12w/q8w) demonstrou eficácia não inferior ao aflibercepte 2 mg (administrado em q8w). Os ganhos de acuidade visual observados no primeiro ano foram mantidos no segundo ano.
Os resultados detalhados de ambos os estudos são mostrados na Tabela 1 e na Figura 1 abaixo.
Tabela 1 - Resultados de acuidade visual nas semanas 48 e 96 dos estudos de fase III - estudos HAWK e HARRIER
| - | - | HAWK | - | HARRIER | |||
| Resultado de eficácia | Na semana | Brolucizumabe 6 mg (n=360) | Aflibercepte 2 mg (n=360) | Diferença (IC de 95%) brolucizumabe – aflibercepte | Brolucizumabe 6 mg (n=370) | Aflibercepte 2 mg (n=369) | Diferença (IC de 95%) brolucizuma beaflibercepte |
| Alteração média do BCVA em relação à linha de base (medida pelo escore de letras do ETDRS) | 48 | 6,6 (EP= 0,71) | 6,8 (EP = 0,71) | 0,2 (-2,1, 1,8) P <0,0001 a) | 6,9 (EP = 0,61) | 7,6 (EP = 0,61) | -0,7 (-2,4, 1,0) P <0,0001 a) |
| 36–48 b) | 6,7 (EP=0,68) | 6,7 (EP=0,68) | 0,0 (-1,9, 1,9) P <0,0001 a) | 6,5 (EP= 0,58) | 7,7 (EP= 0,58) | -1,2 (-2,8, 0,4) P =0,0003 a) | |
| 96 | 5,9 (EP= 0,78) | 5,3 (EP= 0,78) | 0,5 (-1,6, 2,7) | 6,1 (EP=0,73) | 6,6 (EP=0,73) | -0,4 (-2,5,1,6) | |
| % de pacientes que ganharam pelo menos 15 letras de visão | 48 | 33,6 | 25,4 | 8,2 (2,2, 15,0) | 29,3 | 29,9 | -0,6 (-7,1, 5,8) |
| 96 | 34,2 | 27,0 | 7,2 (1,4, 13,8) | 29,1 | 31,5 | -2,4 (-8,8, 4,1) | |
| % de pacientes que perderam acuidade visual (%) (> 15 letras de perda no BCVA) | 48 | 6,4 | 5,5 | 0,9 (-2,7, 4,3) | 3,8 | 4,8 | -1,0 (-3,9, 2,2) |
| 96 | 8,1 | 7,4 | 0,7 (-3,6, 4,6) | 7,1 | 7,5 | -0,4 (-3,8, 3,3) | |
BCVA: Melhor acuidade visual corrigida; dados ausentes são imputados usando o método da última observação transportada (LOCF – Last Observation Carried Forward).
ETDRS: Early Treatment Diabetic Retinopathy Study.
a) Valor P referente à hipótese de não-inferioridade com margem de não-inferioridade de 4,0 letras.
b) Desfecho secundário chave, contabilizando diferenças no tempo dos tratamentos com Brolucizumabe e aflibercepte.
Figura 1 - Alteração média da acuidade visual desde o período basal até a semana 96, nos estudos HAWK e HARRIER
HAWK
HARRIER
Esses ganhos de acuidade visual foram alcançados com 56% e 51% dos pacientes tratados com Brolucizumabe 6 mg no intervalo de doses a cada 12 semanas (q12w) na semana 48, e com 45% e 39% dos pacientes na semana 96, em HAWK e HARRIER, respectivamente. Entre os pacientes identificados como elegíveis para o intervalo q12w durante as primeiras 12 semanas, 85% e 82% permaneceram no intervalo de doses a cada 12 semanas até a semana 48. Dos pacientes no intervalo q12w na semana 48, 82% e 75% permaneceram no intervalo de cada 12 semanas até a semana 96.
Os efeitos do tratamento em subgrupos avaliados (por exemplo, idade, sexo, raça, acuidade visual basal, espessura basal de retina, tipo de lesão, tamanho da lesão, status do fluido), em cada estudo, foram geralmente consistentes com os resultados nas populações gerais.
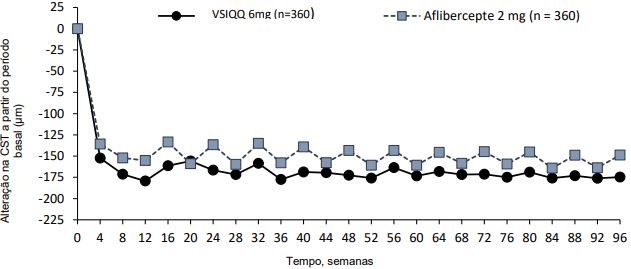
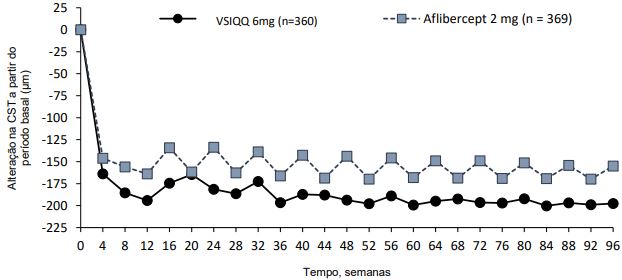
A atividade da doença foi avaliada por alterações na acuidade visual e/ou parâmetros anatômicos, incluindo espessura do subcampo central (CST) e/ou presença de fluidos retinianos (IRF/SRF, sub-RPE). Na semana 16, quando a atividade da doença foi avaliada pela primeira vez para determinar o intervalo de tratamento, estatisticamente menos pacientes apresentaram atividade da doença com Brolucizumabe 6 mg em comparação com aflibercepte 2 mg. A atividade da doença foi avaliada ao longo dos estudos. Os parâmetros anatômicos da atividade da doença foram menores na semana 48 e na semana 96 para o Brolucizumabe em comparação com o aflibercepte (Tabela 2).
Tabela 2 - Avaliação da atividade de doenças nos estudos HAWK e HARRIER até a semana 96
| - | - | HAWK | - | HARRIER | - | ||
| Resultado da eficácia (desfechos secundários préespecificados) | Na semana | Brolucizumabe 6mg (N=360) | Aflibercepte 2mg (N=360) | (IC de 95%) brolucizumabe – aflibercepte | Brolucizumabe 6mg (N=370) | Aflibercepte 2mg (N=369) | Diferença (IC de 95%) brolucizumabe – aflibercepte |
| % de pacientes com atividade da doençac) | 16 d) | 24,0 | 34,5 | -10,5 (-17,1, -3,5) P=0,0013 a) | 22,7 | 32,2 | -9,5 (-15,8, -3,1) P=0,0021 a) |
| Mudança média em CST a partir do período basal (µm) | 16 d) | -161,4 (EP=6,2) | - 133,6 (EP=6,2) | -27,8 (-45,1,-10,5) P=0,0008 a) | -174,4 (EP=6,7) | -134,2 (EP=6,7) | -40,2 (-58,9,-21,6) P<0,0001 a) |
| 48 | 172,8 (EP=6,7) | -143,7 (EP=6,7) | -29,0 (-47,6, -10,4) P=0,0012 a) | -193,8 (EP=6,8) | -143,9 (EP=6,8) | -49,9 (-68,9,-30,9) P<0,0001 a) | |
| 96 | -174,8 (EP=7,3) | -148,7 (EP=7,3) | -26,0 (-46,2, -5,9) P=0,0115 b) | -197,7 (EP=7,0) | -155,1 (EP=7,0) | -42,6 (-62,0, -23,3) P<0,0001 b) | |
| % de pacientes com fluido IRF e/ou SRF | 16 d) | 33,9 | 52,2 | -18,2 (-25,3,-10,9) P<0,0001 a) | 29,4 | 45,1 | -15,7 (-22,9, -9,0) P<0,0001 a) |
| 48 | 31,2 | 44,6 | -13,5 (-20,7, -6,1) P=0,0001 a) | 25,8 | 43,9 | -18,1 (-24,9,-11,8) P<0,0001 a) | |
| 96 | 24,0 | 36,9 | -12,9 (-19,7, -6,6) P=0,0002 b) | 24,4 | 38,5 | -14,1 (-21,3, -7,2) P<0,0001 b) | |
| % de pacientes com fluido subRPE | 16 d) | 18,7 | 27,3 | -8,6 (-14,4, -2,9) P=0,0030 b) | 16,0 | 23,8 | -7,8 (-13,0, -2,7) P=0,0041 b) |
| 48 | 13,5 | 21,6 | -8,1 (-13,6, -2,7) P=0,0035 b) | 12,9 | 22,0 | -9,1 (-13,8, -3,9) P=0,0007 b) | |
| 96 | 10,9 | 14,7 | -3,8 (-8,5, 0,8) P=0,1213 b) | 16,5 | 22,4 | -5,9 (-11,5, -0,3) P=0,0371 b) | |
CST: Espessura do subcampo central; IRF/SRF: Fluido intrarretiniano/sub-retiniano; RPE: Epitélio pigmentado da retina.
a) Desfecho secundário em HARRIER, análise confirmatória em HAWK; Valores p unilaterais para superioridade do brolucizumabe.
b) Desfechos secundários em HAWK e HARRIER; Valores p de dois lados.
c) As avaliações da atividade da doença foram baseadas no julgamento do médico, apoiado nas orientações do protocolo, na semana 16: Diminuição da BCVA de ≥ 5 letras em comparação com a linha de base, diminuição da BCVA de ≥ 3 letras e aumento do CST ≥75 μm em comparação com a semana 12, diminuição da BCVA de ≥ 5 letras devido à atividade da doença por DMRI neovascular em comparação com a semana 12 ou novos ou piora dos cistos intrarretinianos (IRC)/fluido intrarretiniano (IRF) em comparação com a semana 12.
d) Até a semana 16, a exposição ao tratamento era idêntica, permitindo uma comparação direta entre Brolucizumabe e aflibercepte.
Figura 2 - Alteração da espessura do subcampo central desde o período basal até a semana 96, nos estudos HAWK e HARRIER
HAWK
HARRIER
Nos dois estudos, o Brolucizumabe demonstrou aumentos clinicamente significativos desde o período basal, no desfecho secundário de eficácia pré-especificado, dos resultados reportados pelo paciente, relatados através do Questionário de Função Visual do Instituto Nacional do Olho (National Eye Institute Visual Function Questionnaire - NEI VFQ25). A magnitude dessas alterações foi semelhante à observada em estudos publicados, que correspondeu a um ganho de 15 letras na melhor acuidade visual corrigida (BCVA). Os benefícios relatados pelos pacientes foram mantidos no segundo ano.
Não foram encontradas diferenças clinicamente significativas entre o Brolucizumabe e o aflibercepte nas alterações a partir do período basal até a semana 48 na pontuação total e nas sub-escalas do NEI VFQ-25 (visão geral, dor ocular, atividades de perto, atividades à distância, sociabilidade, saúde mental, dificuldades profissionais, dependência, manejo de automóveis, visão de cores e visão periférica).
Referências Bibliográficas
1. [Clinical Overview] RTH258 - 2.5 Clinical Overview in neovascular age-related macular degeneration (nAMD). Novartis. Dec-2018.
2. [Summary of Clinical Efficacy] RTH258 - 2.7.3 Summary of Clinical Efficacy in neovascular age-related macular degeneration (nAMD). Novartis. Dec-2018.
Características Farmacológicas
Grupo farmacoterapêutico: oftalmológicos, agentes antineovascularizantes.
Código ATC: S01LA06.
Mecanismo de ação
Níveis aumentados de sinalização através do fator de crescimento vascular endotelial A (VEGF-A) estão associados à angiogênese ocular patológica e edema da retina. O brolucizumabe se liga com alta afinidade às isoformas de VEGFA (por exemplo, VEGF110, VEGF121 e VEGF165), impedindo, assim, a ligação do VEGF-A aos seus receptores VEGFR-1 e VEGFR-2. Ao inibir a ligação ao VEGF-A, o brolucizumabe suprime a proliferação de células endoteliais, reduzindo assim a neovascularização patológica e diminuindo a permeabilidade vascular.
Farmacodinâmica
A degeneração macular neovascular (úmida) relacionada à idade (DMRI) é caracterizada pela neovascularização coroidal (NVC) patológica. O vazamento de sangue e fluidos da NVC pode causar espessamento ou edema da retina e/ou hemorragia sub/intrarretiniana, resultando na perda da acuidade visual.
Nos estudos HAWK e HARRIER, os parâmetros anatômicos relacionados fizeram parte das avaliações da atividade da doença que norteiam as decisões de tratamento. Foram observadas reduções na espessura do subcampo central (CST) e na presença de fluido intrarretiniano/sub-retiniano (IRF/SRF) ou fluido sob o epitélio pigmentado da retina (sub-RPE) em pacientes tratados com Brolucizumabe, já em 4 semanas após o início do tratamento e até a semana 48 e a semana 96. Foram demonstradas reduções maiores, estatisticamente significativas, na CST e na presença de IRF/SRF em relação ao aflibercepte nas semanas 16 e 48.
Nestes estudos, para pacientes tratados com Brolucizumabe, foram observadas reduções no tamanho da lesão de neovascularização coroidal já em 12 semanas e nas semanas 48 e 96 após o início do tratamento.
Farmacocinética
O Brolucizumabe é administrado diretamente no vítreo para exercer efeitos locais no olho.
Absorção/Distribuição
Após administração intravítrea de 6 mg de brolucizumabe por olho, em pacientes com DMRI neovascular (úmida), a Cmáx média de brolucizumabe livre no plasma foi de 49,0 ng/mL (intervalo: 8,97 a 548 ng/mL) e foi atingida em 1 dia.
Metabolismo/Eliminação
O brolucizumabe é um fragmento de anticorpo monoclonal e não foram realizados estudos de metabolismo de medicamentos. Como um fragmento de anticorpo de cadeia única, espera-se que o brolucizumabe livre seja eliminado através de disposição mediada pelo alvo, via ligação ao VEGF endógeno livre, eliminação renal passiva e metabolismo por proteólise.
Após injeções intravítreas, o brolucizumabe foi eliminado com uma aparente meia-vida sistêmica de 4,3 dias (± 2 dias) após uma dose única intravítrea. As concentrações foram geralmente próximas ou abaixo do limite de quantificação (<0,5 ng/mL), aproximadamente 4 semanas após a administração, na maioria dos pacientes. O Brolucizumabe não se acumulou no soro sanguíneo quando administrado por via intravítrea a cada 4 semanas.
Excreção
A excreção de brolucizumabe não foi totalmente caracterizada. No entanto, espera-se que o brolucizumabe livre sofra disposição mediada por alvo e/ou excreção renal passiva.
Populações especiais
Pacientes geriátricos (65 anos ou mais)
Nos estudos clínicos HAWK e HARRIER, aproximadamente 90% (978/1088) dos pacientes randomizados para tratamento com Brolucizumabe tinham idade ≥65 anos e aproximadamente 60% (648/1088) tinham idade ≥75 anos. Não foram observadas diferenças significativas em eficácia ou segurança com o aumento da idade, nesses estudos.
Raça/Etnia
Não houve diferenças étnicas na farmacocinética sistêmica após injeção intravítrea em um estudo com 24 pacientes caucasianos e 26 japoneses.
Insuficiência renal
A insuficiência renal de leve a grave não deve impactar na exposição sistêmica geral ao brolucizumabe, porque a concentração sistêmica de brolucizumabe é direcionada pela distribuição a partir do olho e não pela taxa de eliminação, e porque a exposição sistêmica do brolucizumabe é baixa.
A depuração sistêmica do brolucizumabe foi avaliada em pacientes com DMRI neovascular (úmida) que tinham disponíveis dados séricos da farmacocinética de brolucizumabe e dados da depuração da creatinina. Indivíduos com insuficiência renal leve (50 a 79 mL/min (n = 13)) apresentaram taxas médias de depuração sistêmica de brolucizumabe, que estavam dentro de 15% da taxa média de depuração para indivíduos com função renal normal (≥80 mL/min (n = 25)). Pacientes com insuficiência renal moderada (30 a 49 mL/min (n = 3)) apresentaram taxas médias de depuração sistêmica do brolucizumabe mais baixas que pacientes com função renal normal, mas o número de pacientes foi muito baixo para fazer conclusões definitivas. Não foram estudados pacientes com insuficiência renal grave (<30 mL/min).
Insuficiência hepática
A insuficiência hepática de leve a grave não deve impactar na exposição sistêmica geral ao brolucizumabe, porque o metabolismo ocorre via proteólise e não depende da função hepática.
Dados de segurança pré-clínica
Carcinogenicidade e mutagenicidade
Não foram realizados estudos sobre o potencial carcinogênico ou mutagênico do Brolucizumabe.
Toxicidade de dose repetida
Os dados não-clínicos não revelam riscos especiais para o ser humano, com base em estudos de toxicidade de dose repetida em 3 e 6 meses. As injeções intravítreas de brolucizumabe em macacos cynomolgus em doses de até 6 mg por olho a cada 4 semanas por 26 semanas não resultaram em efeitos oculares ou sistêmicos e foram bem toleradas.
As avaliações incluíram observações diárias de morbimortalidade, observações clínicas (incluindo respiração e comportamento anormais), determinações de peso corporal, exames de biomicroscopia e oftalmoscopia indireta, medições de pressão intraocular, eletrorretinogramas, patologia clínica, análise toxicocinética e de anticorpos antidrogas plasmática e do vítreo, e exames macroscópicos e microscópicos.
O nível ocular e sistêmico de efeito adverso não observado (No Observed Adverse Effect Level - NOAEL) com brolucizumabe 6 mg por olho a cada 4 semanas fornece uma margem 2 vezes maior de segurança ocular (com base no volume ocular comparativo) para a dose humana recomendada.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)