Qual a ação da substância do Votrient?
Resultados de Eficácia
Estudos clínicos
Carcinoma de Células Renais (RCC)
A segurança e a eficácia de Cloridrato de Pazopanibe no carcinoma de células renais (RCC) foram avaliadas em um estudo multicêntrico, randômico, duplo-cego e controlado com placebo. Pacientes (N=435) com RCC localmente avançado e/ou metastático foram randomizados para receber Cloridrato de Pazopanibe 800 mg ou placebo uma vez ao dia. O endpoint primário do estudo foi avaliar e comparar os dois grupos de tratamento em relação à sobrevida livre de progressão da doença (SLP). O endpoint secundário foi a sobrevida global (SG). Os demais endpoints foram a avaliação da taxa de resposta global e da duração da resposta.
Do total de 435 pacientes desse estudo, 233 eram virgens de tratamento e 202 eram pacientes (de segunda linha) que receberam uma terapia prévia baseada em IL-2 ou INF-α. Observou-se semelhança no performance status (ECOG) entre o grupo de Cloridrato de Pazopanibe e o de placebo (ECOG 0: 42% vs 41%; ECOG 1: 58% vs 59%). Todos os pacientes apresentavam histologia compatível com células clara ou predominantemente clara. Aproximadamente a metade dos pacientes tinha três ou mais órgãos envolvidos em sua doença e a maioria dos pacientes tinha o pulmão (74%) e/ou nódulos linfáticos (54%) como localização metastática da doença na randomização do estudo.
Uma proporção similar de pacientes em cada grupo era virgem de tratamento ou tinha sido pré-tratada a base de citoquinas (53% e 47% no grupo de Cloridrato de Pazopanibe e 54% e 46% no de placebo). No subgrupo pré-tratado com citoquinas, a maioria (75%) tinha sido submetida a tratamento à base de interferon.
Proporções semelhantes de pacientes em cada grupo haviam sido submetidas à nefrectomia (89% no grupo de Cloridrato de Pazopanibe e 88% no de placebo) e/ou a radioterapia prévia (22% e 15%, respectivamente).
A análise principal do endpoint primário (PFS) se baseia na avaliação da doença por análise radiológica independente, na população total do estudo (de primeira linha e de segunda linha).
Tabela 1. Resultados gerais de eficácia sobre o RCC obtidos pelo Comitê de Avaliação Independente (IRC) (VEG105192).
Endpoints / população do estudo | Cloridrato de Pazopanibe | Placebo | HR (IC de 95%) | Valor de P (oneSLG sided) |
SLG | Mediana (meses) | |||
Geral | N=290 | N=145 | - | - |
| 9,2 | 4,2 | 0,46 (0,34, 0,62) | <0,0000001 | |
Sem tratamento anterior | N=155 | N=78 | - | - |
| 11,1 | 2,8 | 0,40 (0,27, 0,60) | <0,0000001 | |
Pré-tratados com citocina | N=135 | N=67 | - | - |
7,4 | 4,2 | 0,54 (0,35, 0,84) | <0,001 | |
Taxa de resposta | % (IC de 95%) | - | - | |
Geral | N=290 | N=145 | - | - |
| 30 (25,1, 35,6) | 3 (0,5, 6,4) | - | <0,001 | |
IC: intervalo de confiança;
HR: Hazard Ratio;
ITT: intenção de tratar;
SLP: sobrevida livre de progressão da doença.
No caso dos pacientes que responderam ao tratamento, a duração média de resposta foi de 58,7 semanas, de acordo com a avaliação do comitê independente.
Os dados da mediana de sobrevida global (SG) na análise de sobrevida final especificada no protocolo foram de 22,9 meses e 20,5 meses [HR=0,91 (IC de 95%: 0,71-1,16; p=0,224)] para os pacientes randomizados nos grupos Cloridrato de Pazopanibe e placebo, respectivamente. Os resultados da SG são sujeitos a possíveis vieses porque 54% dos pacientes do grupo placebo também receberam Cloridrato de Pazopanibe na parte de extensão desse estudo depois da progressão da doença. Sessenta e seis por cento (66%) dos pacientes de placebo receberam terapia posterior ao estudo em comparação com 30% dos pacientes de Cloridrato de Pazopanibe.
No estudo pivotal, as avaliações de qualidade de vida (QoL) foram baseadas nas pontuações globais obtidas de maneira cega e por autorelato por meio de dois questionários especificados segundo protocolo, EORTC QLQ-C30 e EuroQoL EQ-5D. A análise foi baseada em pacientes de ambos os grupos que continuaram em terapia antes da progressão. As avaliações mostraram que não há diferença entre o tratamento com Cloridrato de Pazopanibe e o tratamento com placebo (p > 0.05), indicando que Cloridrato de Pazopanibe não exerce impacto negativo sobre a qualidade de vida global.
Em um estudo de Fase II com 225 pacientes com carcinoma renal de células claras localmente recorrente ou metastático, a taxa de resposta objetiva foi de 35% e a duração média da resposta foi de 68 semanas, de acordo com a avaliação do comitê independente.
Em um estudo de fase III aberto, randomizado, paralelo e de não inferioridade (VEG108844), foram avaliadas segurança, eficácia e qualidade de vida de Cloridrato de Pazopanibe comparado ao sunitinibe. Pacientes (N=1110) com RCC localmente avançado e/ou metastático que não tinham recebido terapia sistêmica prévia foram randomizados para receber Cloridrato de Pazopanibe 800 mg uma vez ao dia, continuamente, ou sunitinibe 50 mg uma vez ao dia em ciclos de 6 semanas sendo 4 semanas de tratamento e 2 sem tratamento.
O endpoint primário deste estudo foi avaliar e comparar a SLP em pacientes tratados com Cloridrato de Pazopanibe àqueles tratados com sunitinibe. As características demográficas foram similares entre os grupos de tratamento. As características da doença no diagnóstico inicial e no recrutamento foram balanceadas entre os grupos de tratamento, com a maioria dos pacientes apresentando histologia celular clara e doença no estágio IV.
O estudo VEG108844 alcançou o endpoint primário de SLP e demonstrou que Cloridrato de Pazopanibe não foi inferior ao sunitinibe, uma vez que o limite superior do IC 95 % para Hazard Ratio (HR) foi menor que a margem de não inferioridade de 1,25 especificada no protocolo. Os resultados gerais de eficácia estão descritos na Tabela 2.
Tabela 2: Resultados Gerais de Eficácia (VEG108844).
Endpoint | Cloridrato de Pazopanibe N=557 | Sunitinibe N=553 | HR |
SLP | |||
Geral | |||
Mediana (meses) | 8.4 | 9.5 | - |
(95 % IC) | (8.3, 10.9) | (8.3, 11.0) | - |
| - | - | - | 1.047 |
| - | - | - | (0.898,1.220) |
Sobrevida Global (SG) | |||
Mediana (meses) | 28.3 | 29.1 | - |
(95 % IC) | (26.0, 35.5) | (25.4, 33.1) | - |
| - | - | - | 0.915a |
| - | - | - | (0.786, 1.065) |
IC: intervalo de confiança;
HR = Hazard Ratio;
ITT: intenção de tratar;
SLP: sobrevida livre de progressão, baseada na revisão do Comitê de Avaliação Independente (IRC).
a valor de P = 0.245 (2-sided).
Sarcoma de partes moles (STS)
A segurança e eficácia de Cloridrato de Pazopanibe em STS foram avaliadas em um estudo pivotal de fase III randomizado, duplo-cego, controlado com placebo, multicêntrico (VEG110727). Um total de 369 pacientes com STS avançado foram randomizados para receber Cloridrato de Pazopanibe 800 mg uma vez ao dia ou placebo. É importante destacar que foi permitida a participação no estudo apenas de pacientes com subtipos histológicos selecionados de STS, portanto a eficácia e a segurança do Cloridrato de Pazopanibe podem ser consideradas estabelecidas apenas para estes subgrupos de STS e o tratamento com Cloridrato de Pazopanibe deve ser restrito a tais subtipos de STS.
Os seguintes tipos de tumor foram elegíveis:
Fibroblástico (fibrossarcoma adulto, mixofibrossarcoma, fribrossarcoma epitelioide esclerosante, tumores fibrosos solitários malignos), os chamados fibrohistiocíticos (histiocitoma fibroso maligno pleomórfico [MFH], células gigantes MFH, MFH inflamatório), leiomiossarcoma, tumores gliômicos malignos, músculos esqueléticos (pleomórfico e rabdomiossarcoma alveolar), vascular (hemangioendotelioma epitelioide, angiosarcoma), diferenciação incerta (sinovial, epitelioide, parte mole alveolar, de células claras, desmoplásicas de células pequenas e rodadas, rabdóide extrarrenal, mesenquimoma maligno, PEComa, sarcoma intimal), tumores da bainha dos nervos periféricos malignos, sarcomas de tecidos moles não especificadas (NOS) e outros tipos de sarcoma (não listados como não elegíveis).
Os seguintes tipos de tumor não foram elegíveis:
Sarcoma adipocítico (todos os subtipos), todos os rabdomiossarcoma que não eram alveolares ou pleomórficos, condrossarcoma, osteossarcoma, tumores de Ewing / tumores neuroectodérmicos primitivos (PNET), GIST, sarcoma protuberante, sarcoma miofibroblástico inflamatório, mesotelioma maligno e tumores mesodérmicos mistos do útero.
Os pacientes com sarcoma adipocítico foram excluídos do estudo pivotal de fase III uma vez que em um estudo preliminar de fase II (VEG20002), a atividade (SLP na semana 12) observada com Cloridrato de Pazopanibe no adipocítico não satisfazia a taxa de pré-requisito para permitir testes clínicos adicionais.
Outros critérios de elegibilidade chave do estudo VEG110727 foram: evidência histológica de STS maligna de grau alto ou intermediário e progressão da doença dentro de 6 meses após a terapia para doença metastática, ou recorrência dentro de 12 meses de terapia (neo) / adjuvante. Noventa e oito por cento (98%) de pacientes receberam doxorrubicina anteriormente, 70% ifosfamida prévia, e 65% dos pacientes receberam pelo menos três ou mais agentes quimioterápicos antes do recrutamento do estudo.
Pacientes foram estratificados pelos fatores de status de desempenho da OMS (OMS OS) (0 ou 1) na linha basal e o número de linhas antes da terapia sistêmica para doença avançada (0 ou 1 vs. 2+). Em cada grupo de tratamento, houve um pequeno aumento da porcentagem de pacientes nas linhas 2+ da terapia sistêmica prévia para doença sistêmica (58% e 55% respectivamente para os braços de tratamento de placebo e Cloridrato de Pazopanibe). A duração média do acompanhamento de pacientes (definido como data de recrutamento a data do último contato ou morte) foi similar para ambos os braços de tratamento (9,36 meses para placebo [faixa 0,69 a 23,0 meses] e 10,4 meses para Cloridrato de Pazopanibe [faixa 0,2 a 24,3 meses]).
O objetivo primário do estudo foi sobrevida livre de progressão (SLP avaliada por revisão radiológica independente); os endpoints secundários incluíram sobrevida global (SG), taxa de resposta global e duração da resposta.
Tabela 3: Resultados de eficácia global em STS por avaliação independente (VEG110727).
Endpoint / população do estudo | Cloridrato de Pazopanibe | Placebo | HR (IC de 95 %) | Valor de P (bilateral) |
SLP | ||||
ITT global | N = 246 | N = 123 | - | - |
Mediana (semanas) | 20,0 | 7,0 | 0,35 (0,26, 0,48) | < 0,001 |
Leiomiosarcoma | N = 109 | N = 49 | - | - |
Mediana (semanas) | 20,1 | 8,1 | 0,37 (0,23, 0,60) | < 0,001 |
Subgrupos sarcoma sinovial | N = 25 | N = 13 | - | - |
Mediana (semanas) | 17,9 | 4,1 | 0,43 (0,19, 0,98) | 0,005 |
Subgrupo ‘Outros STS’ | N = 112 | N = 61 | - | - |
Mediana (semanas) | 20,1 | 4,3 | 0,39 (0,25, 0,60) | < 0,001 |
SG | ||||
ITT global | N = 246 | N = 123 | - | - |
Mediana (meses) | 12,6 | 10,7 | 0,87 (0,67,1,12) | 0,256 |
Leiomiosarcoma* | N = 109 | N = 49 | - | - |
Mediana (meses) | 16,7 | 14,1 | 0,84 (0,56, 1,26) | 0,363 |
Subgrupos sarcoma sinovial * | N = 25 | N = 13 | - | - |
Mediana (meses) | 8,7 | 21,6 | 1,62 (0,79, 3,33) | 0,115 |
Subgrupo ‘Outros STS’* | N = 112 | N = 61 | - | - |
Mediana (meses) | 10,3 | 9,5 | 0,84 (0,59, 1,21) | 0,325 |
Taxa de resposta (RC+RP) | ||||
% (IC de 95 %) | 4 (2,3, 7,9) | 0 (0,0, 3,0) | - | - |
Duração da resposta | ||||
Mediana (semanas) (IC de 95 %) | 38,9 (16,7, 40,0) | - | - | - |
HR = Razão de risco;
ITT = Intenção de tratar;
SLP = sobrevida livre de progressão;
RC = resposta completas;
RP = resposta parcial. SG = sobrevida global.
* A sobrevida global dos respectivos subgrupos histológicos STS (leiomiossarcoma, sarcoma sinovial e "Outros" STS) deve ser interpretada com cautela devido ao pequeno número de indivíduos e intervalos de confiança amplos.
Observou-se uma melhora semelhante na SLP com base na avaliação do investigador no braço Cloridrato de Pazopanibe em comparação com o braço placebo (na população total ITT HR: 0,39, IC de 95%, 0,30 a 0,52, p <0,001).
Figura 1: Curva Kaplan-Meier para Sobrevida livre de progressão em STS por avaliação independente para a população geral (VEG110727).
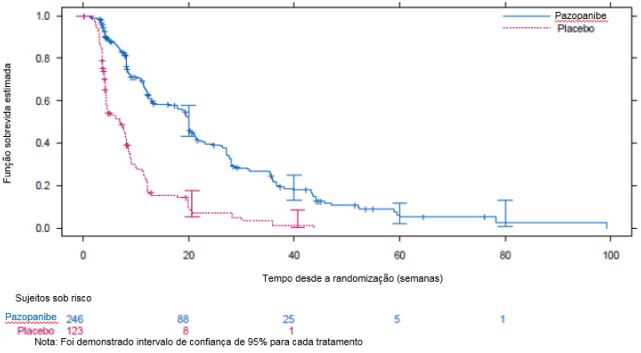
Nenhuma diferença significativa foi observada entre os dois grupos de tratamento na análise final de SG realizada após 76% (280/369) dos eventos ocorridos (HR 0,87, IC 95% 0,67, 1,12 p = 0,256).
População pediátrica
Um estudo de Fase I (ADVL0815) de pazopanibe foi conduzido em 44 pacientes pediátricos com vários tumores sólidos recorrentes ou refratários. O objetivo principal foi investigar a dose máxima tolerada (DMT), o perfil de segurança e as propriedades farmacocinéticas do pazopanibe em crianças. A duração média da exposição neste estudo foi de 3 meses (1-23 meses).
Um estudo de Fase II (PZP034X2203) de pazopanibe foi conduzido em 57 pacientes pediátricos com tumores sólidos refratários incluindo rabdomiossarcoma (N = 12), sarcoma de tecidos moles não rabdomiossarcoma (N = 11), sarcoma de Ewing / pPNET (N = 10), osteossarcoma (N = 10), neuroblastoma (N = 8) e hepatoblastoma (N = 6). O estudo foi de agente único, não controlado e aberto para determinar a atividade terapêutica do pazopanibe em crianças e adolescentes com idade entre 1 e <18 anos. Pazopanibe foi administrado diariamente na forma de comprimido na dose de 450 mg/m2 /dose ou como suspensão oral na dose de 225 mg/m2 /dose. A dose diária máxima permitida foi de 800 mg para o comprimido e 400 mg para a suspensão oral. A duração média da exposição foi de 1,8 meses (1 dia-29 meses).
Os resultados deste estudo não mostraram qualquer atividade antitumoral significativa na respectiva população pediátrica. Portanto, o pazopanibe não é recomendado para o tratamento destes tumores na população pediátrica.
Referências Bibliográficas:
1. A Phase II Study of GW786034 Using a Randomized Discontinuation Design in Subjects with Locally Recurrent or Metastatic Clear-Cell Renal Cell Carcinoma. Study VEG102616.Report RM2007/00899/00, 2007.
2. A Randomized, Double-blind, Placebo-controlled, Multi-center Phase III Study to Evaluate the Efficacy and Safety of Pazopanib (GW786034) Compared to Placebo in Patients with Locally Advanced and/or Metastatic Renal Cell Carcinoma (RCC). Study Number: VEG105192. Report UM2008/00012/00
3. A randomized double blind phase III trial of pazopanib versus placebo in patients with soft tissue sarcoma whose disease has progressed during or following prior therapy. Study Number: VEG110727. Report 2010N109979/00.
Características Farmacológicas
Grupo farmacoterapêutico: agente antineoplásico – inibidor da proteína quinase. Código ATC: L01XE11
Propriedades Farmacodinâmicas
Mecanismo de ação
Cloridrato de Pazopanibe, administrado por via oral, é um potente inibidor multialvo da tirosinoquinase (TKI) de receptores dos fatores de crescimento endotelial vascular 1, 2 e 3 (VEGFR-1, VEGFR-2, VEGFR-3), dos fatores de crescimento derivados de plaquetas α e β (PDGFR-alfa e PDGFR-beta) e do receptor do fator de célula-tronco (c-KIT), cujos valores IC50 são, respectivamente, de 10, 30, 47, 71, 84 e 74 nM.
Em experimentos pré-clínicos, o pazopanibe inibiu de modo dependente de dose a autofosforilação induzida por ligante dos receptores VEGFR-2, c-KIT e PDGFR-beta em células. In vivo, o pazopanibe inibiu a fosforilação de VEGFR-2 induzido por VEGF em pulmões de camundongos, a angiogênese em vários modelos animais e o crescimento de múltiplos xenoenxertos de tumor humano em camundongos.
Farmacocinética
Em uma meta-análise farmacogenética de dados de 31 estudos clínicos de Cloridrato de Pazopanibe administrado em monoterapia ou em combinação com outros agentes, valores de ALT 5 vezes acima do limite superior normalidade (LSN)(NCI CTC Grau 3) ocorreram em 19% dos portadores do alelo HLA-B*57:01 e em 10% dos não portadores. Nestes dados, 133/2235 (6%) dos pacientes eram portadores do alelo HLA-B*57:01.
Propriedades Farmacocinéticas
Absorção
O pazopanibe é absorvido oralmente e alcança a sua concentração máxima no prazo mediano de duas a quatro horas após a administração. A dosagem diária resulta em aumento deAUC de 1,23 a 4 vezes. Não houve aumento consistente de AUC e de Cmáx quando se usou uma dose de Cloridrato de Pazopanibe acima de 800 mg uma vez ao dia. A exposição sistêmica ao pazopanibe é aumentada quando administrado com alimentos.
A administração de Cloridrato de Pazopanibe com uma refeição rica ou pobre em gorduras resulta em aumento praticamente duplicado de AUC e Cmáx. Por isso, Cloridrato de Pazopanibe deve ser administrado no mínimo uma hora antes da refeição ou duas horas depois. A administração de um único comprimido de 400 mg de Cloridrato de Pazopanibe esmagado aumentou a AUC(0-72) em 46% e a Cmáx em aproximadamente duas vezes e diminuiu o tmáx em aproximadamente 90 minutos, em comparação com a administração do comprimido inteiro. Esses resultados indicam que a biodisponibilidade e a taxa de absorção oral de pazopanibe aumentaram depois da administração do comprimido esmagado em comparação com o comprimido inteiro. Portanto, devido a esse potencial de aumento da exposição, os comprimidos não devem esmagados.
Distribuição
A ligação do pazopanibe à proteína de plasma humano in vivo foi superior a 99% sem dependência de concentração acima da faixa de 10-100 micrograma/mL. Estudos in vitro sugerem que o pazopanibe é um substrato da glicoproteína P (Pgp) e da proteína resistente ao câncer de mama (BCRP).
Metabolismo
Resultados de estudos in vitro demonstraram que o metabolismo do pazopanibe é mediado basicamente pelo CYP3A4, com contribuições menores do CYP1A2 e do CYP2C8.
Eliminação
O pazopanibe é eliminado de forma lenta e possui meia-vida média de 30,9 horas após a administração da dose recomendada de 800 mg. A eliminação ocorre principalmente pelas fezes, e a eliminação renal representa menos que 4% da dose administrada.
Populações especiais
Insuficiência Renal
Em uma análise farmacocinética da população, com 408 pacientes diagnosticados com variados tipos de câncer, o clearance de creatinina (30 a150 mL/min) não influenciou o clearance de pazopanibe. Não é esperado que a insuficiência renal influencie na farmacocinética do pazopanibe, não havendo necessidade de alterações na dose em pacientes com clearance de creatina ≥ 30 mL/min.
Insuficiência Hepática
A mediana no estado de equilíbrio da Cmáx e AUC(0-24) de pazopanibe, em pacientes com insuficiência hepática leve (definida tanto como bilirrubina normal e qualquer grau de elevação de ALT - alaninaminotransferase, quanto como elevação de bilirrubina até 1,5 X LSN - Limite Superior Normal, independente do valor de ALT), após uma dose diária de 800 mg/dia (30,9 micrograma/mL, no intervalo de 12,5 a 47,3 e 841,8 micrograma.h/mL, no intervalo de 600,4 a 1078), são similares a mediana dos pacientes sem insuficiência hepática (49,4 micrograma/mL, no intervalo de 17,1 a 85,7 e 888,2 micrograma. /mL, no intervalo de 345.5 a 1482).
A dose máxima tolerada (DMT) de Cloridrato de Pazopanibe por pacientes com insuficiência hepática moderada (definida como uma elevação de bilirrubina > 1,5 X a 3 X LSN, independente dos valores de ALT) foi de 200 mg, uma vez ao dia.
Os valores da mediana no estado de equilíbrio da Cmáx (22,4 micrograma/mL, no intervalo de 6,4 a 32,9) e AUC(0- 24) (350,0 micrograma.h/mL, no intervalo de 131,8 a 487,7), após a administração de 200 mg de Cloridrato de Pazopanibe, uma vez ao dia, em indivíduos com insuficiência hepática moderada, foram de aproximadamente 45% e 39%, respectivamente, o que corresponde aos valores da mediana após administração de 800 mg, uma vez ao dia, em indivíduos com função hepática normal. Não existem dados suficientes sobre o uso de Cloridrato de Pazopanibe em pacientes com insuficiência hepática grave (total de bilirrubina > 3 x LSN, independente do valor de ALT), portanto o uso de Cloridrato de Pazopanibe não é recomendado para esses pacientes.
População pediátrica
Após a administração de pazopanibe 225 mg/m2 (como suspensão oral) em pacientes pediátricos, os parâmetros farmacocinéticos (Cmax, Tmax e ASC) foram semelhantes aos previamente notificados em pacientes adultos tratados com 800 mg de pazopanibe. Os resultados não indicaram nenhuma diferença marcante na depuração de pazopanibe, normalizada pela área de superfície corporal, entre crianças e adultos.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)