Qual a ação da substância do Vacina Adsorvida Hepatite B (Recombinante) Instituto Butantan?
Resultados da eficácia
Eficácia clínica
A eficácia da Antígeno de Superfície da Hepatite B Recombinante não foi avaliada através de estudos clínicos. A eficácia da vacina foi inferida através da demonstração de indução de respostas de anticorpos bactericidas séricos contra cada um dos antígenos da vacina.
Imunogenicidade
As respostas de anticorpos bactericidas séricos para cada um dos antígenos NadA, fHbp, NHBA e PorA P1.4 da vacina, foram avaliadas utilizando-se um conjunto de quatro cepas meningocócicas de referência do grupo B. Os anticorpos bactericidas contra estas cepas foram medidos pelo Ensaio Bactericida Sérico, utilizando soro humano como fonte de complemento (hSBA). Não estão disponíveis dados de todos os esquemas de vacinação utilizando a cepa de referência para NHBA.
A maioria dos estudos de imunogenicidade primária foi realizada como estudos clínicos randomizados, controlados e multicêntricos. A imunogenicidade foi avaliada em lactentes, crianças, adolescentes e adultos.
Imunogenicidade em lactentes e crianças
Nos estudos com lactentes, os participantes receberam três doses da Antígeno de Superfície da Hepatite B Recombinante aos 2, 4 e 6 ou aos 2, 3 e 4 meses de idade, e uma dose de reforço, no segundo ano de vida, logo a partir dos 12 meses de idade. Os soros foram obtidos tanto antes da vacinação quanto um mês após a terceira dose da vacinação (vide Tabela 1) e um mês após a vacinação de reforço (vide Tabela 2). Em um estudo de extensão, a persistência da resposta imune foi avaliada um ano após a dose de reforço (vide Tabela 2). Crianças não vacinadas anteriormente também receberam duas doses no segundo ano de vida, com a persistência de anticorpos sendo medida um ano após a segunda dose (vide Tabela 3). A imunogenicidade após duas doses também foi documentada em outro estudo em lactentes a partir de 6 a 8 meses de idade na fase de recrutamento do estudo (vide Tabela 3).
Imunogenicidade em lactentes de 2 a 6 meses de idade
Os resultados de imunogenicidade obtidos um mês após a administração de três doses da Antígeno de Superfície da Hepatite B Recombinante aos 2, 3, 4 e 2, 4 e 6 meses de idade estão resumidos na Tabela 1. As respostas de anticorpos bactericidas contra cepas meningocócicas de referência, um mês após a terceira dose da vacinação, foram altas contra os antígenos fHbp, NadA e PorA P1.4 em ambos os esquemas de vacinação com a Antígeno de Superfície da Hepatite B Recombinante. As respostas bactericidas contra o antígeno NHBA também foram elevadas em lactentes vacinados no esquema 2, 4 e 6 meses, mas este antígeno pareceu ser menos imunogênico no esquema 2, 3 e 4 meses . As consequências clínicas da redução da imunogenicidade do antígeno NHBA neste esquema de vacinação não são conhecidas.
Tabela 1. Respostas de anticorpos bactericidas séricos obtidas um mês após a terceira dose da Antígeno de Superfície da Hepatite B Recombinante, administrada aos 2, 3, 4 ou 2, 4 e 6 meses de idade
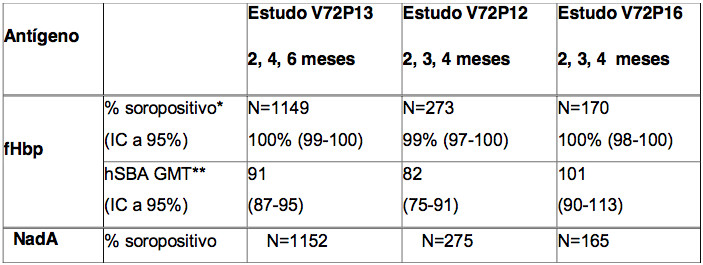
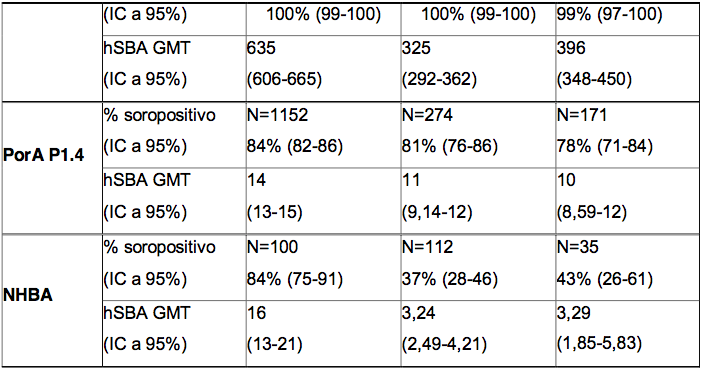
* % soropositivo = porcentagem de lactentes que atingiram um hSBA ≥ 1:5.
** GMT = títulos geométricos médios.
Os dados sobre a persistência de anticorpos bactericidas aos 8 meses após a administração da Antígeno de Superfície da Hepatite B Recombinante aos 2, 3 e 4 meses de idade, e aos 6 meses após a administração da Antígeno de Superfície da Hepatite B Recombinante aos 2, 4 e 6 meses de idade (período pré-dose de reforço), bem como os dados relacionados à dose de reforço após a administração da quarta dose da Antígeno de Superfície da Hepatite B Recombinante aos 12 meses de idade, estão resumidos na Tabela 2. A persistência da resposta imune um ano após a dose de reforço também é apresentada na Tabela 2.
Tabela 2. Respostas de anticorpos bactericidas séricos seguidas de uma dose de reforço aos 12 meses após a administração de um esquema primário de vacinação aos 2, 3 e 4 ou 2, 4 e 6 meses de idade, e persistência de anticorpos bactericidas um ano após a dose de reforço
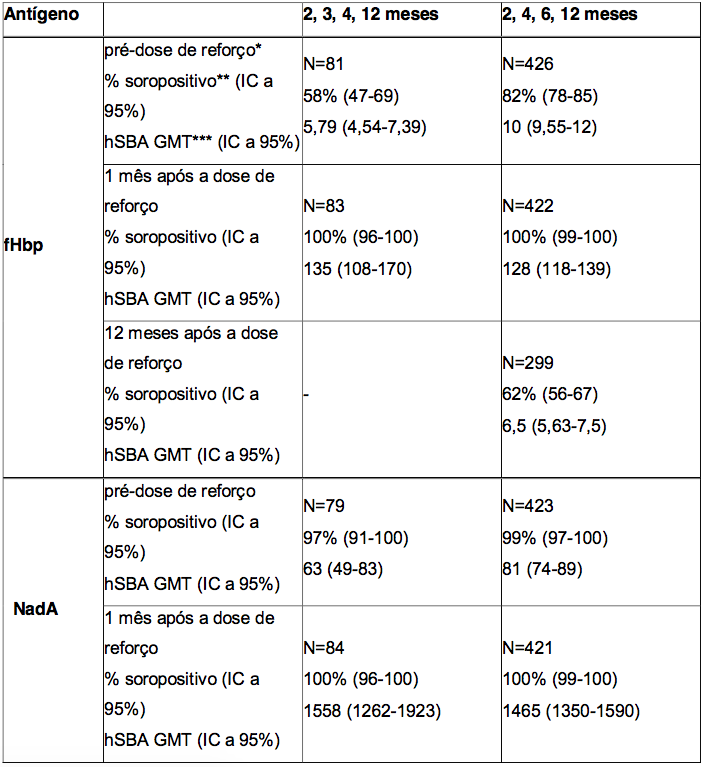
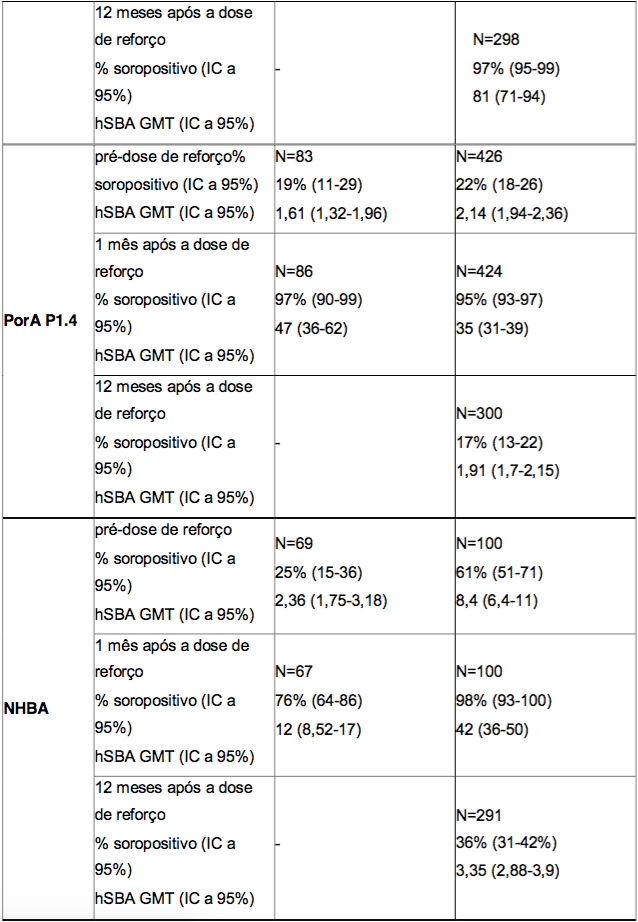
* O período pré-dose de reforço representa a persistência de anticorpos bactericidas aos 8 meses após a administração da Antígeno de Superfície da Hepatite B Recombinante aos 2, 3 e 4 meses de idade, e aos 6 meses após a administração da Antígeno de Superfície da Hepatite B Recombinante aos 2, 4 e 6 meses da idade.
** % soropositivo = porcentagem de lactentes que atingiram um hSBA ≥ 1:5.
*** GMT = títulos geométricos médios.
Imunogenicidade em crianças de 6 a 11 meses, 12 a 23 meses e 2 a 10 anos de idade
A imunogenicidade após a administração de duas doses, com intervalo de dois meses, em crianças de 6 a 26 meses de idade foi documentada em três estudos cujos resultados estão resumidos na Tabela 3. Contra cada um dos antígenos vacinais, as porcentagens de sororesposta e hSBA GMTs foram altas e semelhantes após o esquema de duas doses em lactentes de 6-8 meses de idade e crianças de 13-15 e 24-26 meses de idade. Os dados sobre a persistência de anticorpo um ano após as duas doses aos 13 e 15 meses de idade também estão resumidos na Tabela 3.
Tabela 3. Respostas de anticorpos bactericidas séricos após a administração da Antígeno de Superfície da Hepatite B Recombinante aos 6 e 8 meses de idade, aos 13 e 15 meses de idade, ou aos 24 e 26 meses de idade, e persistência de anticorpos bactericidas um ano após as duas doses aos 13 e 15 meses de idade
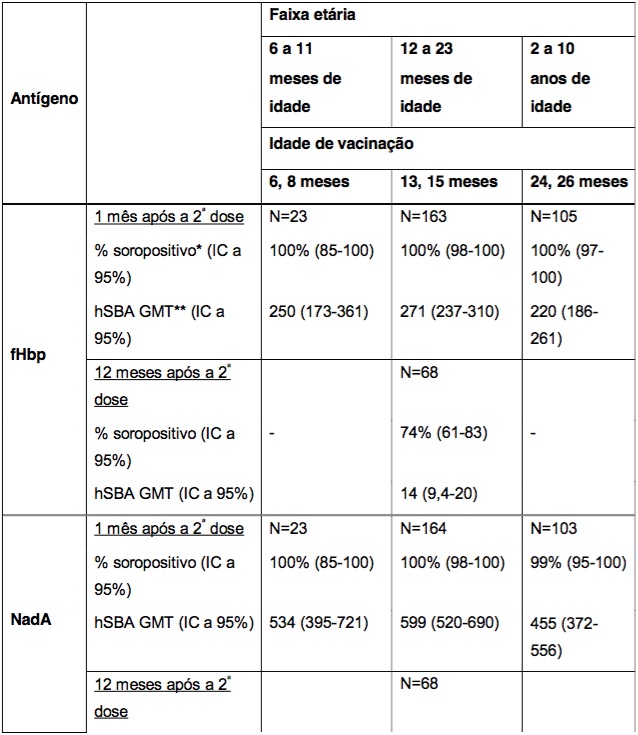
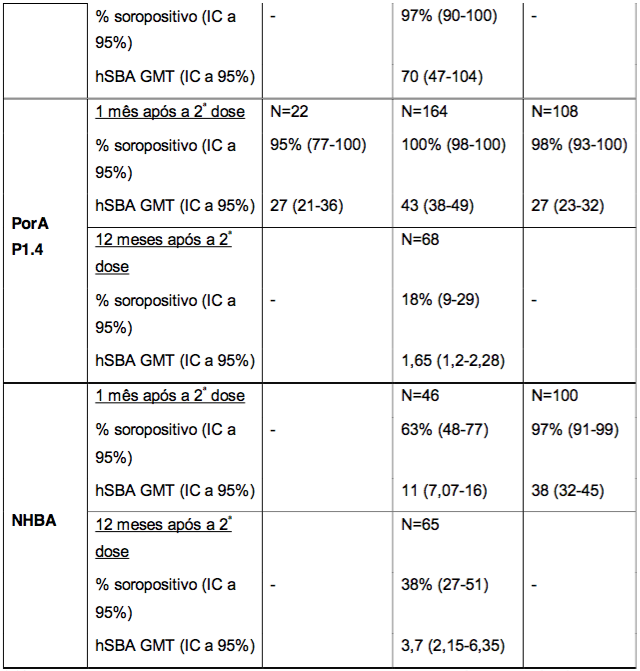
* % soropositivo = porcentagem de indivíduos que atingiram um hSBA ≥ 1:4 (na faixa etária de 6 a 11 meses) e hSBA ≥ 1:5 (nas faixas etárias de 12 a 23 meses e de 2 a 10 anos de idade).
** GMT = títulos geométricos médios.
Em um grupo adicional de 67 crianças avaliadas após a administração de duas doses da Antígeno de Superfície da Hepatite B Recombinante, tendo início a partir dos 40 até os 44 meses de idade, em dois estudos de extensão (N = 36 e N = 29-31, respectivamente), foi observado um aumento nos títulos de hSBA para os quatro antígenos de referência. As porcentagens de indivíduos soropositivos foram de 100% para fHbp e NadA, 94% e 90% para PorA P1.4; 89% e 72% para NHBA.
Imunogenicidade em adolescentes (a partir de 11 anos de idade) e adultos
Os adolescentes receberam duas doses da Antígeno de Superfície da Hepatite B Recombinante, com intervalos de um, dois ou seis meses entre as doses; estes dados estão resumidos nas Tabelas 4 e 5. Em estudos com adultos, os dados também foram obtidos após a administração de duas doses da Antígeno de Superfície da Hepatite B Recombinante, com um intervalo de um mês ou dois meses entre as doses (vide Tabela 4).
Os esquemas de vacinação de duas doses administradas com um intervalo de um ou dois meses mostraram respostas imunológicas semelhantes em adultos e adolescentes. Respostas semelhantes foram também observadas em adolescentes que receberam duas doses da Antígeno de Superfície da Hepatite B Recombinante com um intervalo de seis meses.
Tabela 4. Respostas de anticorpos bactericidas séricos em adolescentes ou adultos, um mês após a administração de duas doses da Antígeno de Superfície da Hepatite B Recombinante, aplicada de acordo com os diferentes esquemas de duas doses, e persistência de anticorpos bactericidas 18 a 23 meses após a segunda dose
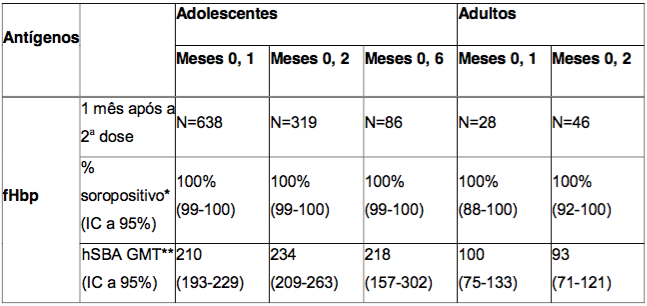
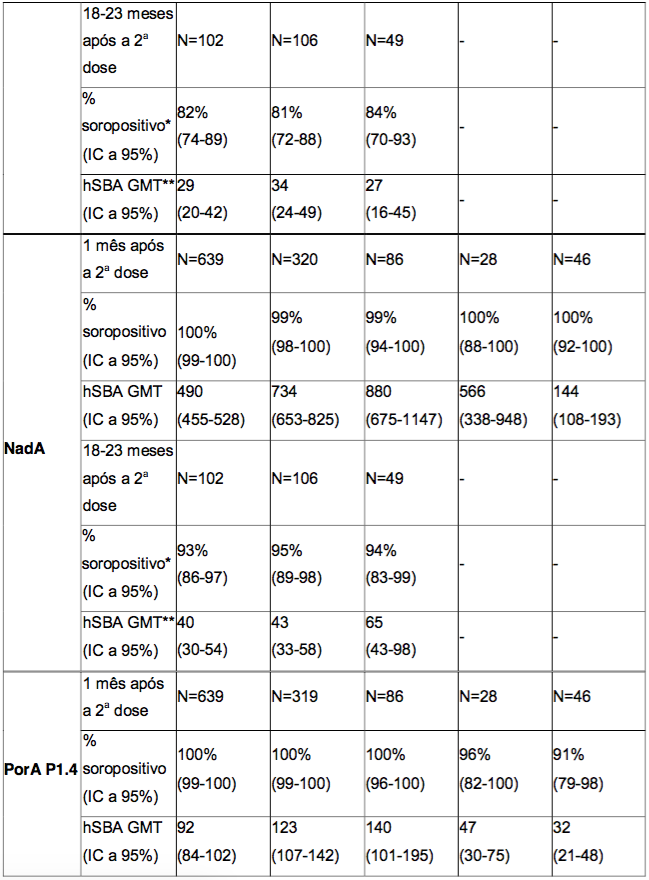
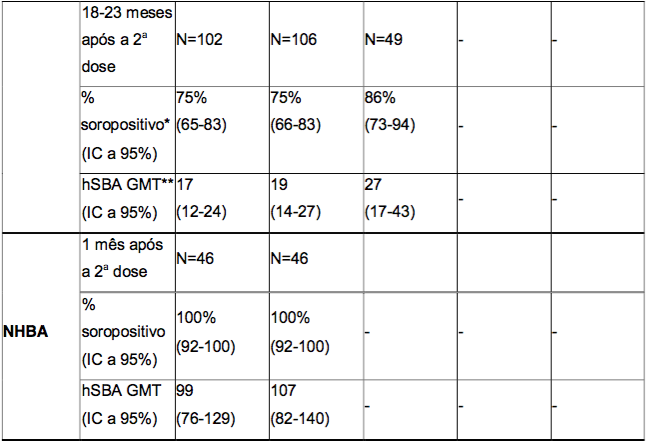
* % soropositivo = porcentagem de indivíduos que atingiram um hSBA ≥ 1:4.
** GMT = títulos geométricos médios.
No estudo com adolescentes, as respostas bactericidas após duas doses da Antígeno de Superfície da Hepatite B Recombinante foram estratificadas por um hSBA basal menor que 1:4, igual a 1:4 ou superior a 1:4. As porcentagens de sororesposta e porcentagens de indivíduos com, pelo menos, um aumento de 4 vezes no título basal de hSBA, um mês após a administração da segunda dose da Antígeno de Superfície da Hepatite B Recombinante, estão resumidas na Tabela 5. Após a vacinação com a Antígeno de Superfície da Hepatite B Recombinante, uma alta porcentagem de indivíduos foi soropositiva e teve um aumento de 4 vezes nos títulos de hSBA, independente do estado pré-vacinação.
Tabela 5. Porcentagem de adolescentes com sororesposta e com um aumento de pelo menos 4 vezes nos títulos bactericidas um mês após a administração de duas doses da Antígeno de Superfície da Hepatite B Recombinante, aplicada de acordo com diferentes esquemas de duas doses - estratificada pelos títulos pré-vacinação
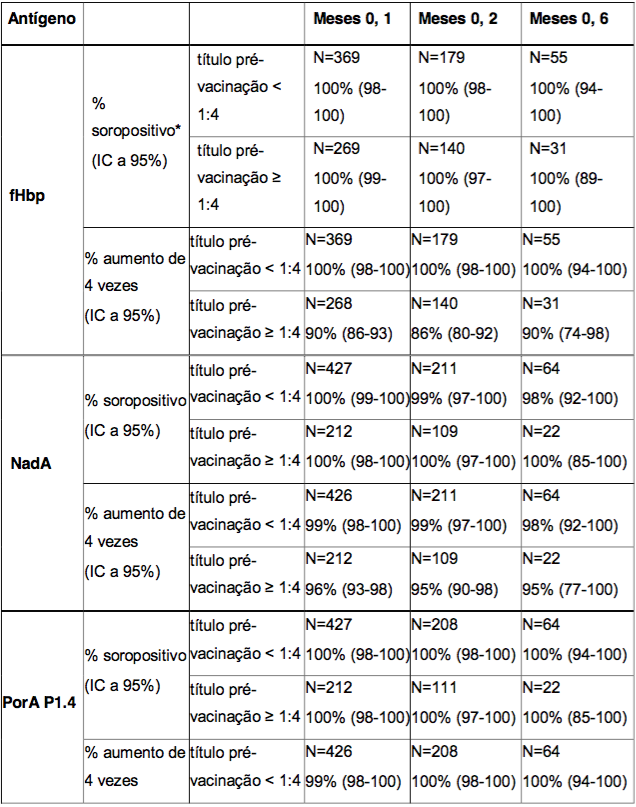
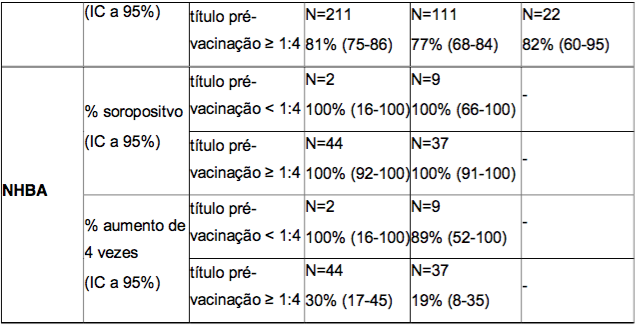
* % soropositivo = porcentagem de indivíduos que atingiram um hSBA ≥ 1:4.
Características Farmacológicas
Propriedades farmacodinâmicas
- - Grupo farmacoterapêutico: vacinas meningocócicas
- - Código ATC: J07AH09.
Propriedades farmacocinéticas
A avaliação das propriedades farmacocinéticas não é necessária para as vacinas; portanto, nenhum estudo farmacocinético foi conduzido com a vacina.
Dados Epidemiológicos
A doença meningocócica invasiva (DMI) é uma importante causa de meningite e sepse, que pode conduzir à mortalidade (até 20% dos casos de DMI), ou sequelas permanentes (11-20% dos sobreviventes). A incidência de DMI de todos os sorogrupos atualmente no Brasil é de aproximadamente 2,0 por 100.000 habitantes, embora taxas de incidência um pouco maiores sejam relatadas em áreas urbanas. A maior incidência de DMI ocorre em lactentes com menos de 1 ano de idade (17 por 100.000 habitantes), seguida por crianças de 1 a 4 anos de idade (7 por 100.000 habitantes). A incidência diminui ainda mais com o aumento da idade. Maiores taxas de incidência foram observadas durante as epidemias de DMI.
Há 13 cápsulas distintas de polissacarídeos, mas no Brasil somente os sorogrupos B, C, W-135 e Y causam DMI. Não foram observadas doenças causadas pelo sorogrupo A no Brasil em várias décadas. De acordo com a rede de vigilância de laboratórios sentinelas SIREVA II, 26% das DMI no Brasil em 2009 foram causadas pelo grupo B. A distribuição dos grupos causadores da DMI varia conforme a região, sendo o grupo B ainda o mais prevalente dos sorogrupos causadores de doença nos estados do Sul do Brasil.
Com base no Multi Locus Sequence Typing (MLST), o meningococo do grupo B demonstra significativa diversidade. Além de causar doença endêmica, o grupo B tem causado surtos prolongados devido às cepas hipervirulentas, incluindo a ST-32 (França, Oregon (EUA)) e ST-41/44 (Noruega, Nova Zelândia). O Brasil testemunhou prolongadas epidemias de DMI pelo grupo B em meados dos anos 1980 até 2002. Estudos obtidos dos isolados de DMI durante estes surtos relataram que a maioria das cepas do grupo B pertencia ao complexo ST-32.
Atualmente, não existem estudos mais recentes sobre a distribuição de complexo circulante/soro(sub)tipos a nível nacional.
Mecanismos de ação
A imunização com a Antígeno de Superfície da Hepatite B Recombinante tem o objetivo de estimular a produção de anticorpos bactericidas que reconhecem os antígenos NHBA, NadA, fHbp e PorA P1.4 (o antígeno imunodominante presente no componente OMV) da vacina e com os quais se espera um efeito protetor contra a doença meningocócica invasiva (DMI). Como esses antígenos são expressos de forma variável por diferentes cepas, os meningococos que os expressam a níveis suficientes são passíveis de eliminação pelos anticorpos induzidos pela vacina. O Sistema de Tipagem de Antígenos Meningocócicos - Meningococcal Antigen Typing System (MATS), foi desenvolvido para relacionar os perfis antigênicos de diferentes cepas de bactérias meningocócicas do grupo B com a capacidade de eliminação das cepas através do Ensaio de Anticorpos Bactericidas Séricos, utilizando soro humano como fonte de complemento (hSBA) e, desta maneira, estimar a amplitude de cobertura das cepas. Com base na análise pelo MATS dos isolados meningocócicos invasivos do grupo B coletados em 2010, a estimativa de cobertura das cepas pela Antígeno de Superfície da Hepatite B Recombinante no Brasil é de 81% (intervalo de confiança a 95%: 71% - 95%).
Os antígenos presentes na Antígeno de Superfície da Hepatite B Recombinante foram também expressos por cepas pertencentes a outros grupos meningocócicos além do grupo B. Dados limitados indicam proteção contra algumas cepas além das pertencentes ao grupo B; no entanto, a extensão desta proteção adicional ainda não está totalmente determinada.
Dados de segurança não clínicos
Os dados não clínicos não revelam nenhum risco para humanos com base nos estudos de toxicidade de dose repetida e nos estudos de toxicidade reprodutiva e de desenvolvimento.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)