Qual a ação da substância do Uplizna?
Resultados de Eficácia
Eficácia e segurança clínicas
A eficácia de inebilizumabe para o tratamento de DENMO foi avaliada em um estudo clínico randomizado (3:1), duplo cego, controlado por placebo, em adultos com DENMO soropositivo ou soronegativo para AQP4-IgG. O estudo incluiu pacientes que apresentaram pelo menos um ataque agudo de DENMO no ano anterior ou pelo menos 2 ataques nos 2 anos anteriores que precisaram de terapia de resgate (por exemplo, esteroides, plasmaférese, imunoglobulina intravenosa) e apresentaram uma pontuação ≤ 7,5 na Escala Expandida do Estado de Incapacidade (EDSS) (os pacientes com uma pontuação de 8,0 eram aptos se fossem razoavelmente capazes de participar). Os pacientes foram excluídos se previamente tratados com terapias imunossupressoras dentro de um intervalo especificado para cada terapia. Terapias imunossupressoras antecedentes para a prevenção de ataques de DENMO não eram permitidas. Um curso de 2 semanas de corticosteroides orais (mais 1 semana de redução gradual) foi administrado no início do tratamento com inebilizumabe no estudo pivotal.
Os pacientes foram tratados com infusões intravenosas de 300 mg de inebilizumabe no Dia 1 e no Dia 15, ou placebo correspondente, e depois seguidos por um período de até 197 dias ou um ataque adjudicado, denominado período controlado randomizado (PCR). Todos os ataques potenciais foram avaliados por um Comitê de Adjudicação (CA) cego e independente, que determinou se o ataque atendia aos critérios definidos pelo protocolo. Os critérios de ataque reconheciam ataques em todos os domínios afetados por DENMO (neurite óptica, mielite, cérebro e tronco cerebral) e incluíram critérios baseados exclusivamente em manifestações clínicas substanciais, bem como critérios que enfatizaram os achados clínicos mais modestos com o uso de imagem por ressonância magnética (consulte a Tabela 1).
Tabela 1. Visão geral dos critérios definidos por protocolo para um ataque de DENMO
| Domínio | Sintomas representativos | Achados apenas clínicos | Achados clínicos MAIS radiológicos |
| Nervo óptico | Visão embaçada | Oito critérios baseados em alterações na acuidade visual ou defeito pupilar aferente relativo (DPAR) | Três critérios baseados em alterações na acuidade visual ou DPAR mais presença de achados correspondentes na imagem por ressonância magnética do nervo óptico |
| Perda de visão | |||
| Dor ocular | |||
| Medula espinhal | Dor profunda ou radicular | Dois critérios baseados em alterações nas pontuações funcionais piramidais, da bexiga/intestino ou sensoriais | Dois critérios baseados em alterações nas pontuações funcionais piramidais, da bexiga/intestino ou sensoriais MAIS achados correspondentes na imagem por ressonância magnética da medula espinhal |
| Parestesia de extremidade | |||
| Fraqueza | |||
| Disfunção esfincteriana | |||
| Sinal de Lhermitte (não isolado) | |||
| Tronco cerebra | Náusea | Nenhuma | Dois critérios baseados em sintomas ou alterações nas pontuações funcionais do tronco cerebral/cerebelar MAIS achados correspondentes na imagem por ressonância magnética do tronco cerebral |
| Vômito intratável | |||
| Soluços intratáveis | |||
| Outros sinais neurológicos (por exemplo, visão dupla, disartria, disfagia, vertigem, paralisia oculomotora, fraqueza, nistagmo, outra anormalidade do nervo craniano) | |||
| Cérebro | Encefalopatia | Nenhuma | Um critério baseado em alterações nas pontuações funcionais cerebrais/sensoriais/piramidais MAIS achados correspondentes na imagem por ressonância magnética do cérebro |
| Disfunção hipotalâmica |
Os pacientes que apresentaram um ataque determinado pelo CA no PCR, ou que concluíram a consulta do Dia 197 sem um ataque, saíram do PCR e tiveram a opção de inclusão em um período de rótulo aberto (PRA) e iniciar ou continuar o tratamento com inebilizumabe.
Um total de 230 pacientes foram incluídos:
- 213 pacientes eram soropositivos para AQP4- IgG e 17 eram soronegativos; 174 pacientes foram tratados com inebilizumabe e 56 foram tratados com placebo no PCR do estudo. Entre os 213 pacientes soropositivos para AQP4- IgG, 161 pacientes foram tratados com inebilizumabe e 52 foram tratados com placebo no PCR do estudo. Os resultados da avaliação inicial e de eficácia são apresentados para os pacientes soropositivos para AQP4-IgG.
Os dados demográficos e as características da doença na avaliação inicial foram equilibrados entre os 2 grupos de tratamento (consulte a Tabela 2).
Tabela 2. Dados demográficos e características da doença na avaliação inicial dos pacientes com DENMO soropositivos para AQP4-IgG
| Característica | Placebo N = 52 | Inebilizumabe N = 161 | Geral N = 213 |
| Idade (anos): média (desvio padrão [DP]) | 42,4 (14,3) | 43,2 (11,6) | 43,0 (12,3) |
| Idade ≥ 65 anos, n (%) | 4 (7,7) | 6 (3,7) | 10 (4,7) |
| Sexo: Masculino, n (%) | 3 (5,8) | 10 (6,2) | 13 (6,1) |
| Sexo: Feminino, n (%) | 49 (94,2) | 151 (93,8) | 200 (93,9) |
| Escala Expandida do Estado de Incapacidade (EDSS): média (DP) | 4,35 (1,63) | 3,81 (1,77) | 3,94 (1,75) |
| Duração da doença (anos): média (DP) | 2,92 (3,54) | 2,49 (3,39) | 2,59 (3,42) |
| Número de recaídas anteriores: ≥ 2, n (%) | 39 (75,0) | 137 (85,1) | 176 (82,6) |
| Taxa de Recaída Anualizada: média (DP) | 1,456 (1,360) | 1,682 (1,490) | 1,627 (1,459) |
A terapia de resgate foi iniciada conforme necessário para os ataques de DENMO. Todos os pacientes foram pré-medicados antes da administração do produto experimental para reduzir o risco de reações relacionadas à infusão.
O desfecho primário de eficácia foi o tempo (dias) desde o Dia 1 até o início de um ataque de DENMO determinado pelo CA em ou antes do Dia 197. As principais medições adicionais do desfecho secundário incluíram piora desde a avaliação inicial na EDSS na última consulta durante o PCR, alteração desde a avaliação inicial na pontuação binocular de acuidade visual de baixo contraste medida pelo Gráfico de Anéis Rompidos de Landolt C de baixo contraste na última consulta durante o PCR, lesões ativas totais cumulativas na imagem por ressonância magnética (novas lesões, ou lesões aumentadas em T2 realçadas por gadolínio) durante o PCR e o número de internações hospitalares relacionadas a DENMO.
Foi considerado que um paciente apresentou piora na pontuação da EDSS se um dos seguintes critérios fosse atendido:
- Piora de 2 ou mais pontos na pontuação da EDSS para pacientes com pontuação 0 na avaliação inicial;
- Piora de 1 ou mais pontos na pontuação da EDSS para pacientes com pontuação de 1 a 5 na avaliação inicial;
- Piora de 0,5 ou mais pontos na pontuação da EDSS para pacientes com pontuação de 5,5 ou mais na avaliação inicial.
Embora nenhum comparador estivesse disponível durante o PRA, a taxa de ataque anualizada em ambos os tratamentos, randomizado e aberto, foi determinada.
Os resultados em pacientes soropositivos para AQP4-IgG são apresentados na Tabela 3 e na Figura 1. Neste estudo, o tratamento com inebilizumabe reduziu de modo estatisticamente significativo o risco de um ataque de DENMO determinado pelo CA em comparação com o tratamento com placebo (taxa de risco: 0,227, p < 0,0001; 77,3% de redução no risco de ataque de DENMO determinado pelo CA) em pacientes soropositivos para AQP4-IgG. Não houve benefício do tratamento observado em pacientes soronegativos para AQP4-IgG.
No grupo inebilizumabe, a piora da EDSS foi significativamente menor do que no grupo placebo (14,9% contra 34,6% dos participantes). Não houve diferenças na pontuação binocular de acuidade visual de baixo contraste entre os braços do estudo. O número cumulativo médio de lesões ativas totais na imagem por ressonância magnética (1,7 contra 2,3) e o número cumulativo médio de internações hospitalares relacionadas a DENMO (1,0 contra 1,4) foram reduzidos no grupo de estudo com inebilizumabe.
Tabela 3. Resultados de eficácia no estudo pivotal em DENMO soropositivo para AQP4-IgG
| - | Grupo de tratamento | |
| Placebo N = 52 | Inebilizumabe N = 161 | |
| Tempo até adjudicação do ataque determinada pelo comitê (desfecho de eficácia primário) | ||
| Número (%) de pacientes com ataque | 22 (42,3%) | 18 (11,2%) |
| Taxa de risco (IC de 95%)a | 0,227 (0,1214, 0,4232) | |
| Valor pa | < 0,0001 | |
a Método de regressão de Cox, com Placebo como grupo de referência.
Figura 1. Gráfico de Kaplan-Meier de tempo até o primeiro ataque de DENMO determinado pelo CA durante o PCR, em pacientes soropositivos para AQP4-IgG
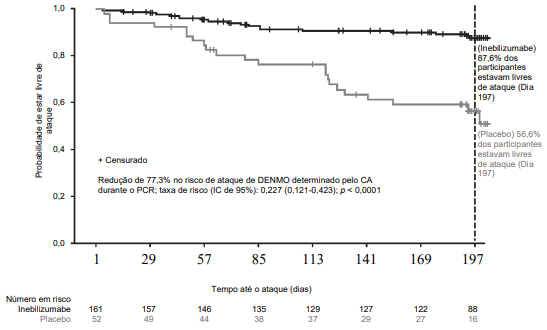
CA = comitê de adjudicação;
AQP4-IgG = imunoglobulina G anti-aquaporina-4;
IC = intervalo de confiança;
DENMO = distúrbios do espectro da neuromielite óptica;
PCR = período de controle randomizado.
Entre o PCR e o PRA, a taxa de ataque de DENMO anualizada determinada pelo CA foi analisada como um desfecho secundário e em pacientes soropositivos para AQP4-IgG tratados com inebilizumabe o resultado foi 0,09.
A Agência Europeia de Medicamentos adiou a obrigação de apresentação dos resultados dos estudos com inebilizumabe em um ou mais subgrupos da população pediátrica em DENMO.
Características Farmacológicas
Propriedades farmacodinâmicas
Grupo farmacoterapêutico: imunossupressores, imunossupressores seletivos, código ATC: L04AA47.
Mecanismo de ação
Inebilizumabe é um anticorpo monoclonal que se liga especificamente ao CD19, um antígeno de superfície celular presente em células pré-B e B maduras, incluindo plasmablastos e algumas células plasmáticas. Após ligação com a superfície celular dos linfócitos B, inebilizumabe apoia a citólise celular dependente de anticorpos (CCDA) e a fagocitose celular dependente de anticorpos (FCDA). Acredita-se que as células B cumpram um papel central na patogênese de DENMO. O mecanismo preciso pelo qual inebilizumabe exerce seus efeitos terapêuticos em DENMO é desconhecido, mas presume-se que envolva a depleção de células B e possa incluir a supressão da secreção de anticorpos, apresentação de antígeno, interação entre célula B e célula T e a produção de mediadores inflamatórios.
Efeitos farmacodinâmicos
A farmacodinâmica de inebilizumabe foi avaliada com um ensaio para células B CD20+, uma vez que inebilizumabe pode interferir no ensaio de células B CD19+. O tratamento com inebilizumabe reduz as contagens de células B CD20+ no sangue em 8 dias após a infusão. Em um estudo clínico com 174 pacientes, as contagens de células B CD20+ foram reduzidas abaixo do limite inferior da normalidade em 4 semanas em 100% dos pacientes tratados com inebilizumabe e permaneceram abaixo do limite inferior da normalidade em 94% dos pacientes por 28 semanas após o início do tratamento. O tempo até a reposição de células B após a administração de inebilizumabe não é conhecido.
No estudo pivotal de pacientes com DENMO, a prevalência de anticorpos antimedicamento (ADA) foi 14,7% no final do PRA; a incidência geral de ADA emergente do tratamento foi 7,1% (16 de 225) e a ocorrência e os momentos de titulação positiva para ADA diminuíram ao longo do tempo com o tratamento com inebilizumabe. O status positivo para ADA pareceu não ter impacto clinicamente relevante nos parâmetros de farmacocinética e farmacodinâmica (células B) e não afetou o perfil de segurança a longo prazo. Não houve efeito aparente do status de ADA no resultado de eficácia; no entanto, o impacto não pode ser totalmente avaliado devido à baixa incidência de ADA associado ao tratamento com inebilizumabe.
Propriedades farmacocinéticas
Absorção
Inebilizumabe é administrado por infusão intravenosa.
Distribuição
Com base na análise da farmacocinética populacional, o volume de distribuição central e periférico típico estimado de inebilizumabe foi 2,95 L e 2,57 L, respectivamente.
Biotransformação
Inebilizumabe é um anticorpo monoclonal humanizado de IgG1 que é degradado por enzimas proteolíticas amplamente distribuídas no corpo.
Eliminação
Em pacientes adultos com DENMO, a meia-vida de eliminação terminal foi aproximadamente 18 dias. Com base na análise da farmacocinética populacional, a depuração sistêmica estimada de inebilizumabe pela via de eliminação de primeira ordem foi 0,19 L/dia. Em baixos níveis de exposição farmacocinética, inebilizumabe foi provavelmente submetido à depuração mediada pelo receptor (CD19), que diminuiu com o tempo, presumivelmente devido à depleção de células B pelo tratamento com inebilizumabe.
Populações especiais
População pediátrica
Inebilizumabe não foi estudado em adolescentes ou crianças.
Idosos
Com base na análise farmacocinética populacional, a idade não afetou a depuração de inebilizumabe.
Gênero, raça
Uma análise farmacocinética populacional indicou que não houve efeito significativo do gênero e da raça na depuração de inebilizumabe.
Insuficiência renal
Não foram realizados estudos clínicos formais para investigar o efeito da insuficiência renal em inebilizumabe. Devido ao grande peso molecular e tamanho hidrodinâmico de um anticorpo monoclonal IgG, não se espera que inebilizumabe seja filtrado via glomérulo. Com base na análise farmacocinética populacional, a depuração de inebilizumabe em pacientes com vários graus de insuficiência renal foi comparável à de pacientes com taxa de filtração glomerular estimada normal.
Insuficiência hepática
Não foram realizados estudos clínicos formais para investigar o efeito da insuficiência hepática em inebilizumabe. Em estudos clínicos, nenhum participante com insuficiência hepática grave foi exposto a inebilizumabe. Os anticorpos monoclonais IgG não são eliminados primariamente pela via hepática; portanto, não se espera que a alteração na função hepática influencie a depuração de inebilizumabe. Com base na análise farmacocinética populacional, os biomarcadores da função hepática na avaliação inicial (AST, ALP e bilirrubina) não tiveram efeito clinicamente relevante na depuração de inebilizumabe.
Dados de segurança pré-clínica
Os dados não clínicos não revelam riscos especiais para humanos, segundo estudos convencionais de farmacologia de segurança, toxicidade de dose repetida, genotoxicidade e potencial carcinogênico.
Inebilizumabe foi avaliado em um estudo combinado de fertilidade e desenvolvimento embriofetal em camundongos machos e fêmeas huCD19 Tg em doses intravenosas de 3 e 30 mg/kg. Não houve efeito no desenvolvimento embriofetal; no entanto, houve uma redução no índice de fertilidade relacionada ao tratamento em ambas as doses testadas.. Uma dose sem efeito para efeitos adversos na fertilidade não foi identificada Além disso, houve uma diminuição nas populações de células B no sítio de desenvolvimento das células B em fetos de camundongos nascidos de animais tratados com inebilizumabe em comparação com a prole de animais de controle, sugerindo que inebilizumabe atravessa a placenta e exaure as células B.
Apenas amostras toxicocinéticas esparsas foram coletadas no estudo combinado de fertilidade e desenvolvimento embriofetal; com base na concentração máxima (Cmax) da primeira dose, os múltiplos de exposição de 3 e 30 mg/kg em camundongos fêmeas huCD19 Tg foram 0,4 vez e 4 vezes, respectivamente, os da dose terapêutica clínica de 300 mg.
Em um estudo de desenvolvimento pré-/pós-natal em camundongos transgênicos, a administração de inebilizumabe a animais maternos do Dia de Gestação 6 ao Dia de Amamentação 20 resultou em populações de células B depletadas na prole no Dia 50 pósnatal. As populações de células B na prole foram recuperadas até o Dia 357 pós-natal. A resposta imune ao neoantígeno na prole de animais tratados com inebilizumabe foi diminuída em relação à prole de animais de controle, sugerindo comprometimento da função normal das células B.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)