Qual a ação da substância do Perjeta?
Resultados da Eficácia
Câncer de mama metastático
Pertuzumabe (substância ativa deste medicamento) em combinação com Herceptin (trastuzumabe) e docetaxel.
CLEOPATRA é um estudo clínico Fase III, multicêntrico, randomizado, duplo-cego e controlado com placebo que incluiu 808 pacientes com câncer de mama HER2-positivo metastático ou localmente recorrente não ressecável, que não receberam tratamento prévio com medicamentos anti-HER2 ou quimioterapia para doença metastática.
Foram solicitadas amostras de tumor mamário para demonstrar a superexpressão de HER2, definida como um escore de 3+ por razão de amplificação IHQ (imunohistoquímica) ou ISH (hibridização in situ) ≥ 2,0, conforme determinação de um laboratório central. Os pacientes foram randomizados 1:1 para receber placebo mais Herceptin (trastuzumabe) e docetaxel ou Pertuzumabe (substância ativa deste medicamento) mais Herceptin (trastuzumabe) e docetaxel.
A randomização foi estratificada por tratamento prévio (terapia de novo ou terapia adjuvante/neoadjuvante prévia) e região geográfica (Europa, América do Norte, América do Sul e Ásia). Pacientes com terapia adjuvante ou neoadjuvante prévia precisavam ter um intervalo livre de doença de pelo menos 12 meses antes da inclusão no estudo.
Pertuzumabe (substância ativa deste medicamento) foi administrado por via intravenosa (IV) em dose inicial de 840 mg, seguida por uma dose de 420 mg. A administração foi feita a cada três semanas. Herceptin (trastuzumabe) foi administrado intravenosamente em dose inicial de 8 mg/kg, seguida por 6 mg/kg, igualmente a cada três semanas. Os pacientes foram tratados com Pertuzumabe (substância ativa deste medicamento) e Herceptin (trastuzumabe) até a progressão da doença, retirada de consentimento ou toxicidade não manejável. O docetaxel foi administrado em uma dose inicial de 75 mg/m2 por infusão IV a cada 3 semanas, durante, pelo menos, 6 ciclos. A dose de docetaxel poderia ser escalonada até 100 mg/m2 a critério do investigador se a dose inicial fosse bem tolerada.
No momento da análise primária, o número médio de ciclos de tratamento em estudo recebidos foi de 16,2 no braço de tratamento com placebo e 19,9 no braço tratado com Pertuzumabe (substância ativa deste medicamento).
O desfecho primário do estudo foi a sobrevida livre de progressão (SLP) de acordo com avaliação de um comitê de revisão independente (CRI) e definido como o tempo desde a data de randomização até a data da progressão de doença ou óbito (por qualquer causa), se ocorrer óbito dentro de 18 semanas da última avaliação tumoral. Desfechos secundários de eficácia foram sobrevida global (SG), avaliação do investigador (SLP), taxa de resposta objetiva (TRO), duração de resposta e tempo até a progressão dos sintomas de acordo com o questionário FACT B QoL.
Dados demográficos foram bem equilibrados [idade mediana de 54 anos, maioria branca (59%) e todos os pacientes do sexo feminino, com exceção de 2]. Aproximadamente metade dos pacientes em cada braço de tratamento apresentava doença positiva para receptor hormonal [definida como receptor de estrógeno (RE) positivo e/ou receptor de progesterona (RPg) positivo] e aproximadamente metade dos pacientes em cada braço de tratamento tinha recebido terapia adjuvante ou neoadjuvante prévia [192 pacientes (47,3%) no braço tratado com placebo vs. 184 pacientes (45,8%) no braço tratado com Pertuzumabe (substância ativa deste medicamento)].
No momento da análise primária da sobrevida livre de progressão, um total de 242 pacientes (59%) no braço tratado com placebo e 191 pacientes (47,5%) no braço tratado com Pertuzumabe (substância ativa deste medicamento) apresentava doença progressiva confirmada pelo CRI ou morreu dentro de 18 semanas a partir da última avaliação tumoral.
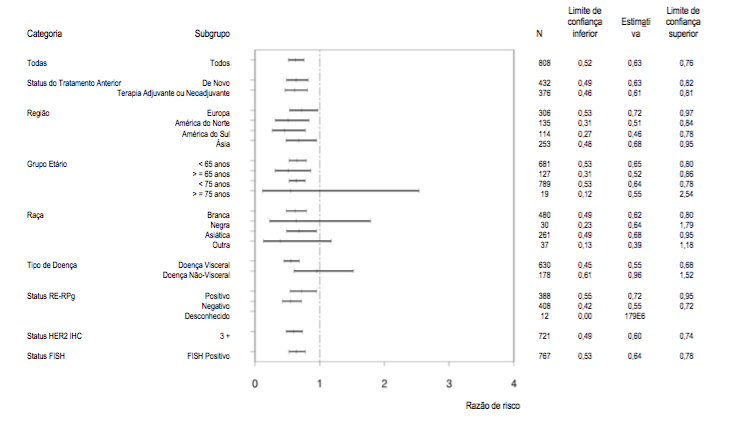
No momento da análise primária, o estudo CLEOPATRA demonstrou aumento estatisticamente significativo da SLP avaliada pelo CRI [razão de risco (HR) = 0,62, IC 95% = 0,51, 0,75, p < 0,0001] no braço tratado com Pertuzumabe (substância ativa deste medicamento) em comparação com o braço tratado com placebo, e um aumento de SLP mediana de 6,1 meses (SLP mediana de 12,4 meses no braço tratado com placebo vs. 18,5 meses no braço tratado com Pertuzumabe (substância ativa deste medicamento)) (vide Figura 1). Os resultados para SLP avaliada pelo investigador foram comparáveis aos observados para SLP avaliada pelo CRI (SLP mediana foi de 12,4 meses para placebo vs. 18,5 meses para Pertuzumabe (substância ativa deste medicamento)) (vide Tabela 1). Resultados compatíveis foram observados entre os subgrupos de pacientes predeterminados, incluindo os subgrupos baseados em fatores de estratificação por região geográfica e terapia adjuvante/neoadjuvante prévia ou câncer de mama metastático de novo (vide Figura 2).
Os resultados de eficácia do estudo CLEOPATRA estão resumidos na Tabela 1:
Tabela 1 - Resumo da eficácia do estudo CLEOPATRA
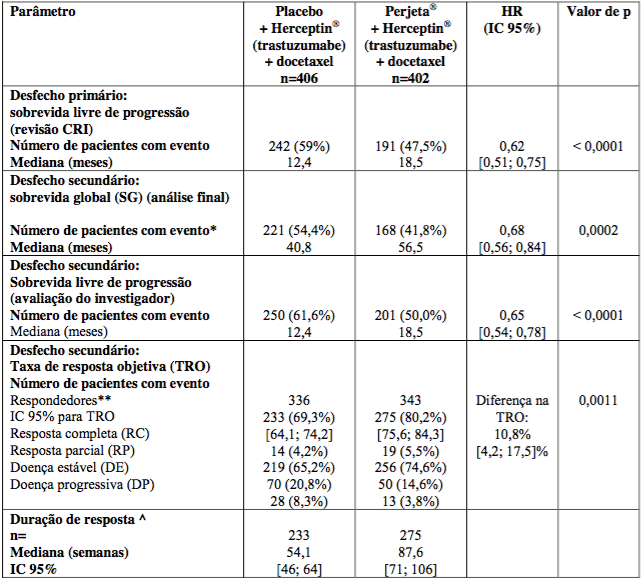
* Análise final de sobrevida global, data de corte 11 de fevereiro de 2014.
** Pacientes com melhor resposta global entre RC ou RP confirmadas por RECIST.
^ Avaliada em pacientes com melhor resposta global entre RC ou RP.
Taxa de resposta objetiva e duração de resposta são baseadas em avaliações tumorais avaliadas por CRI.
Figura 1: Curva de Kaplan-Meier de sobrevida livre de progressão avaliada pelo CRI
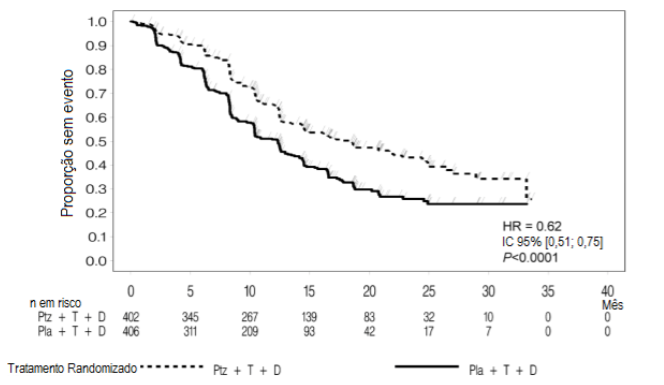
D = docetaxel; HR = hazard ratio; Ptz = pertuzumabe (Pertuzumabe (substância ativa deste medicamento)); T = trastuzumabe (Herceptin); Pla = placebo
Figura 2: SLP avaliada pelo CRI por subgrupo de pacientes
Na análise primária de eficácia, uma análise interina de SG demonstrou uma forte tendência sugestiva de um benefício de sobrevida favorável ao braço tratado com Pertuzumabe (substância ativa deste medicamento).
Uma análise interina de SG realizada um ano depois da análise primária de eficácia demonstrou um benefício de SG estatisticamente significativo favorável ao braço tratado com Pertuzumabe (substância ativa deste medicamento) (HR 0,66, p = 0,0008 em teste de log-rank). O tempo mediano até óbito foi de 37,6 meses no braço tratado com placebo, mas ainda não tinha sido atingido no braço tratado com Pertuzumabe (substância ativa deste medicamento).
A análise final da SG foi realizada quando os 389 pacientes foram a óbito (221 no grupo tratado com placebo e 168 no grupo tratado com Pertuzumabe (substância ativa deste medicamento)). O benefício de SG estatisticamente significativo a favor do grupo tratado com Pertuzumabe (substância ativa deste medicamento) foi mantido (HR 0,68, p = 0,0002 em teste de log-rank). O tempo mediano até óbito foi de 40,8 meses no grupo tratado com placebo e 56,5 meses no grupo tratado com Pertuzumabe (substância ativa deste medicamento) (vide Tabela 2 e Figura 3).
Figura 3: Curva de Kaplan-Meier para sobrevida global
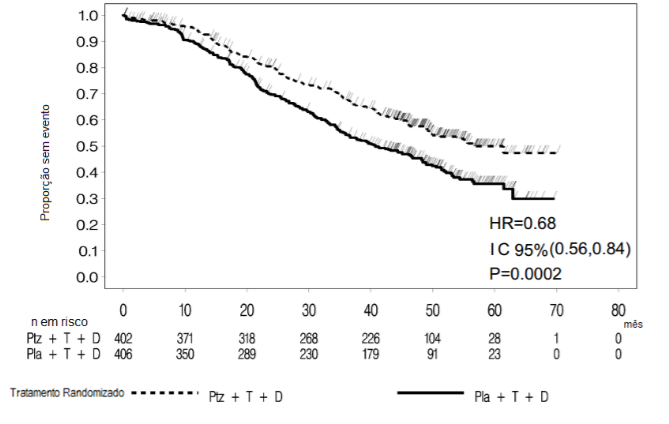
D = docetaxel; HR = hazard ratio; Ptz = pertuzumabe (Pertuzumabe (substância ativa deste medicamento)); T = trastuzumabe (Herceptin); Pla = placebo.
Não houve diferença estatisticamente significativa entre os braços de tratamento quando avaliada Qualidade de Vida Relacionada à Saúde, conforme avaliação pelo tempo até progressão de sintomas sobre a subescala FACT-B TOI-PFB, definida como uma redução de 5 pontos no escore de subescala (HR = 0,97, IC 95% 0,81; 1,16).
Em uma análise exploratória, pacientes tratados com Pertuzumabe (substância ativa deste medicamento) em combinação com Herceptin (trastuzumabe) e docetaxel apresentaram menor risco de progressão sintomática em subescala FACT-B de câncer de mama (definido como uma redução de 2 pontos no escore da subescala) em comparação com os tratados com Herceptin (trastuzumabe) e docetaxel apenas (HR = 0,78, IC 95% = 0,65; 0,94).
BO17929
BO17929 foi um estudo não randomizado Fase II de braço único com Pertuzumabe (substância ativa deste medicamento) e foi conduzido incluindo pacientes com câncer de mama metastático (CMM) HER2-positivo que tinham recebido tratamento prévio com Herceptin (trastuzumabe). O estudo foi dividido em 3 coortes.
Coortes 1 e 2
66 pacientes nas coortes 1 e 2 receberam pelo menos uma dose de Pertuzumabe (substância ativa deste medicamento) e Herceptin (trastuzumabe) (toda população tratada e todos os pacientes tinham recebido tratamento prévio para doença metastática; metade estava recebendo tratamento de segunda linha para doença metastática, enquanto que 35% estavam recebendo tratamento de terceira linha ou posterior. Além disso, 71% tinham recebido quimioterapia neoadjuvante). No momento da análise primária, a duração mediana de tratamento em estudo foi de nove ciclos (27 semanas). No momento da análise primária, TRO e TBC (taxa de benefício clínico) são apresentadas na Tabela 2. A SLP mediana e tempo para progressão (TPP) foram de 24 semanas. O tempo mediano até a resposta foi de 11 semanas e, naqueles pacientes com resposta, a duração mediana de resposta foi de 25 semanas.
Coorte 3:
29 pacientes receberam pelo menos um ciclo de Pertuzumabe (substância ativa deste medicamento). Desses 29 pacientes, 12 participaram apenas da Fase de agente único e 17 prosseguiram para receber Pertuzumabe (substância ativa deste medicamento) e Herceptin (trastuzumabe) quando apresentaram progressão documentada recebendo Pertuzumabe (substância ativa deste medicamento) apenas.
Todos os 29 pacientes progrediram durante terapia de primeira linha no braço metastático e 41,4% também progrediram depois da terapia de segunda linha. Todos os pacientes na Coorte 3 receberam pelo menos uma dose completa de Pertuzumabe (substância ativa deste medicamento). Pacientes em tratamento com Pertuzumabe (substância ativa deste medicamento) e Herceptin (trastuzumabe) receberam uma mediana de 12 ciclos no total.
A Tabela 2 mostra que Pertuzumabe (substância ativa deste medicamento) sozinho apresentou atividade modesta em pacientes depois de falência de Herceptin (trastuzumabe) (coluna do meio). Essas respostas ocorreram em pacientes cuja doença progrediu recentemente com cada anticorpo quando administrado separadamente. Além disso, os 3 pacientes tinham doença estável com seis meses ou mais para uma taxa de benefício clínico total de 35,3%.
Tabela 2 - Estudo BO17929: Dados de eficácia
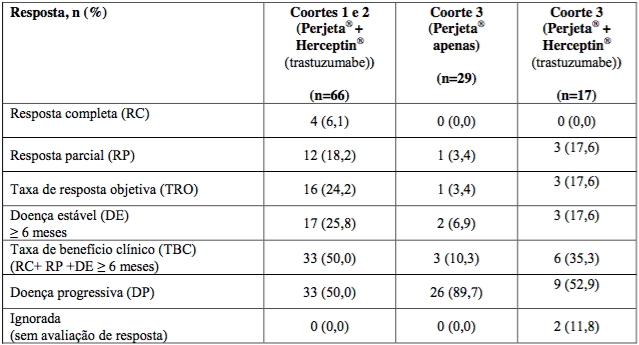
Nota: > 6 meses = 8 ciclos de terapia.
Tratamento Neoadjuvante de Câncer de Mama
A indicação é baseada em dois estudos, NEOSPHERE e TRYPHAENA. Esses dois estudos clínicos Fase II, multicêntricos, randomizados, incluiram pacientes com câncer de mama HER2-positivo ressecável, localmente avançado ou inflamatório (T2-4d) elegíveis para terapia neoadjuvante.
Em pacientes com tratamento neoadjuvante, tumores de mama localmente avançados e inflamatórios são considerados de alto risco, independente do status dos receptores hormonais. No estágio inicial do câncer de mama, o tamanho do tumor, grau, status dos receptores de hormônio e mestástases linfonodais devem ser levados em conta na hora da avaliação de risco.
NEOSPHERE (WO20697)
NEOSPHERE é um estudo clínico Fase II, multicêntrico, randomizado, conduzido com 417 pacientes com câncer de mama HER2-positivo recém diagnosticadas, localmente avançado, ressecável, ou inflamatório (T2-4d; tumor primário > 2 cm em diâmetro), elegíveis para terapia neoadjuvante. Pacientes com mestástases, câncer de mama bilateral, importantes fatores de risco cardíacos ou LVEF < 55% não foram incluídos.
A maioria das pacientes tinha menos de 65 anos de idade. Foram exigidas amostras tumorais para garantir superexpressão de HER2, definida como escore de 3+ por razão de IHQ (imunohistoquímica) ou amplificação através da ISH (hibridização in situ) ≥ 2,0 por laboratório central.
Os pacientes foram randomizados para receber um de quatro esquemas neoadjuvantes antes da cirurgia, como se segue: Herceptin (trastuzumabe) mais docetaxel, Pertuzumabe (substância ativa deste medicamento) mais Herceptin (trastuzumabe) e docetaxel, Pertuzumabe (substância ativa deste medicamento) mais Herceptin (trastuzumabe) ou Pertuzumabe (substância ativa deste medicamento) mais docetaxel. A randomização foi estratificada por tipo de câncer de mama (ressecável, localmente avançado ou inflamatório) e positividade para receptor de estrógeno (RE) ou de progesterona (RP).
Pertuzumabe (substância ativa deste medicamento) foi administrado por via intravenosa em dose inicial de 840 mg, seguida por 420 mg a cada três semanas durante quatro ciclos. Trastuzumabe foi administrado por via intravenosa em dose inicial de 8 mg/kg, seguida por 6 mg/kg a cada três semanas durante quatro ciclos. O docetaxel foi administrado como uma dose inicial de 75 mg/m2 por infusão intravenosa, a cada 3 semanas por 4 ciclos.
A dose de docetaxel pôde ser escalonada até 100 mg/m2, a critério do investigador, se a dose foi bem tolerada. Depois da cirurgia, todos os pacientes receberam três ciclos de 5- fluorouracil (600 mg/m2), epirrubicina (90 mg/m2), ciclofosfamida (600 mg/m2) (FEC) administrados via intravenosa a cada três semanas e Herceptin (trastuzumabe) administrado via intravenosa a cada três semanas até completar um ano de terapia.
Os pacientes no braço Pertuzumabe (substância ativa deste medicamento) mais Herceptin (trastuzumabe) e docetaxel receberam docetaxel a cada três semanas durante quatro ciclos antes do FEC depois da cirurgia, de forma que todos os pacientes receberam doses cumulativas equivalentes de agentes quimioterápicos e Herceptin (trastuzumabe).
O desfecho primário do estudo foi a resposta patológica completa (rPC) na mama (ypT0/is). Os desfechos secundários de eficácia foram porcentagem de resposta clínica, porcentagem de cirurgia conservadora de mama (T2-3 apenas), sobrevida livre de doença (SLD) e sobrevida livre de progressão (SLP). Porcentagens de pCR exploratório adicionais incluíram estado linfonodal (ypT0/isN0 e ypT0N0).
Os dados demográficos foram bem equilibrados (a mediana da idade foi de 49 a 50 anos, a maioria era branca (71%) e todos os pacientes eram do sexo feminino). No total, 7% das pacientes apresentava câncer de mama inflamatório, 32%, câncer de mama localmente avançado e 61%, câncer de mama ressecável. Aproximadamente metade das pacientes em cada grupo de tratamento apresentava doença positiva para receptor de hormônio (definida como RE positivo e/ou RP positivo).
Os resultados de eficácia estão resumidos na Tabela 3. Observou-se ganho estatisticamente significativo e clinicamente relevante no percentual de rPC para pacientes recebendo Pertuzumabe (substância ativa deste medicamento) mais Herceptin (trastuzumabe) e docetaxel em comparação com pacientes recebendo Herceptin (trastuzumabe) e docetaxel (45,8% vs. 29,0%, valor de p = 0,0141). Foi observado um padrão constante de resultados, independentemente da definição de rPC.
Percentuais de resposta patológica completa (rPC), bem como magnitude do ganho com Pertuzumabe (substância ativa deste medicamento), foram menores no subgrupo de pacientes com tumores positivos para receptor hormonal do que em pacientes com tumores negativos para receptor hormonal: 12,0% [IC 95% (4,5%, 24,3%)], 22,0% [IC 95% (11,5%, 36,0%)], 2,0 %[IC 95% (0,1%, 10,5%)], 8,7% [IC 95% (2,4%, 20,8%)], nos tumores positivos para receptor hormonal, e 29,8% [IC 95% (18,4%, 43,4%)], 54,4% [IC 95% (40,7%, 67,6%)], 20,0% [IC 95% (10,4%, 33,0%)], 26,0% [IC 95% (14,6%, 40,3%)], nos tumores negativos para receptor hormonal.
TRYPHAENA (BO22280)
TRYPHAENA é um estudo clínico Fase II, multicêntrico, randomizado, conduzido com 225 pacientes com câncer de mama HER2-positivo localmente avançado, ressecável ou inflamatório (T2-4d; tumor primário > 2 cm em diâmetro), que não receberam tratamento prévio com Herceptin (trastuzumabe), quimioterapia ou radioterapia. Pacientes com mestástases, câncer de mama bilateral, importantes fatores de risco cardíacos ou LVEF < 55% não foram incluídos. Amostras de tumor de mama deveriam apresentar superexpressão de HER2, definida como um escore de 3+ através da IHQ (imunohistoquímica) ou amplificação através de ISH (hibridização in situ) ≥ 2,0 por laboratório central.
Os pacientes foram randomizados para receber um de três esquemas neoadjuvantes antes da cirurgia, como se segue: três ciclos de FEC seguidos por três ciclos de docetaxel, todos em combinação com Pertuzumabe (substância ativa deste medicamento) e Herceptin (trastuzumabe), três ciclos de FEC isoladamente seguidos por três ciclos de docetaxel e Herceptin (trastuzumabe) em combinação com Pertuzumabe (substância ativa deste medicamento) ou seis ciclos de TCH em combinação com Pertuzumabe (substância ativa deste medicamento). A randomização foi estratificada por câncer de mama tipo (ressecável, localmente avançado ou inflamatório) e positividade para RE e/ou RP.
Pertuzumabe (substância ativa deste medicamento) foi administrado por via intravenosa em dose inicial de 840 mg, seguida por 420 mg a cada três semanas. Herceptin (trastuzumabe) foi administrado via intravenosa em dose inicial de 8 mg/kg, seguida por 6 mg/kg a cada três semanas. 5-Fluoruracil (500 mg/m2), epirrubicina (100 mg/m2), ciclofosfamida (600 mg/m2) foram administrados por via intravenosa a cada três semanas durante três ciclos.
Docetaxel foi administrado em dose inicial de 75 mg/m2 em infusão IV a cada três semanas, com a opção de escalonamento para 100 mg/m2 a critério do investigador se a dose inicial for bem tolerada. No entanto, no braço Pertuzumabe (substância ativa deste medicamento) em combinação com TCH, docetaxel foi administrado por via intravenosa na dose de 75 mg/m2, nenhum escalonamento foi permitido e carboplatina (AUC 6) foi administrada a cada três semanas. Depois da cirurgia, todos os pacientes receberam Herceptin (trastuzumabe) para completar um ano de terapia, que foi administrado via intravenosa a cada três semanas.
O desfecho primário deste estudo foi segurança cardíaca durante o período de tratamento neoadjuvante do estudo.
Desfechos secundários de eficácia foram taxa de rPC na mama (ypT0/is), SLD, SLP e SG.
As características demográficas foram bem equilibradas (a mediana da idade foi de 49 a 50 anos, a maioria era branca (77%) e todas eram do sexo feminino). No total, 6% das pacientes apresentavam câncer de mama inflamatório, 25% apresentavam câncer de mama localmente avançado e 69% apresentavam câncer de mama ressecável; aproximadamente metade das pacientes em cada grupo de tratamento apresentava doença RE-positivo e/ou RP-positivo.
Taxas elevadas de rPC foram observadas nos três braços de tratamento (veja Tabela 3). Observou-se um padrão constante de resultados independentemente da definição de rPC. As taxas de rPC foram mais baixas no subgrupo de pacientes com tumores positivos para receptor hormonal do que em pacientes com tumores negativos para este receptor 41,0% [IC 95% (25,6%, 57,9%)], 45,7% [IC 95% (28,8%, 63,4%)], e 47,5% [IC 95% (31,5%, 63,9%)], para tumores positivos para receptor hormonal, e 73,5% [IC 95% (55,6%, 87,1%)], 62,5% [IC 95% (45,8%, 77,3%)] e 81,1% [IC 95% (64,8%, 92,0%)], para tumores negativos para receptor hormonal.
Tabela 3: NEOSPHERE (WO20697) e TRYPHAENA (BO22280): Resumo de eficácia (população ITT)
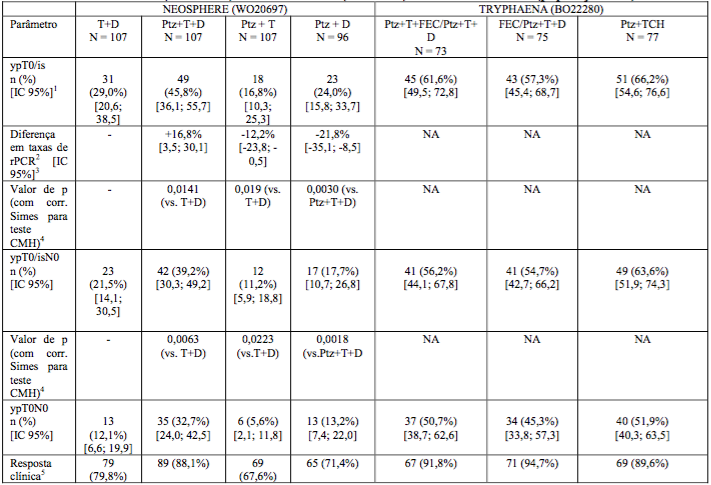
Chaves de abreviações (Tabela 3):
T: Herceptin (trastuzumabe); D: docetaxel; Ptz: Pertuzumabe (substância ativa deste medicamento); FEC: 5-fluorouracil, epirrubicina, ciclofosfamida, TCH: docetaxel, carboplatina e trastuzumabe.
- IC 95% para uma amostra binomial us+.ando método de Pearson-Clopper.
- O tratamento Ptz+T+D e Ptz+T são comparados com T+D enquanto que Ptz+D é comparado com Ptz+T+D.
- IC 95% aproximado para diferença de duas taxas usando método Hauck-Anderson.
- Valor de p pelo teste de Cochran-Mantel-Haenszel com ajuste para multiplicidade Simes.
- 5. Resposta clínica representa pacientes com melhor resposta global incluindo RC ou RP durante o período neoadjuvante (na lesão de mama primária).
Características Farmacológicas
Farmacodinâmica
Mecanismo de ação
Pertuzumabe (substância ativa deste medicamento) é um anticorpo monoclonal recombinante humanizado que age seletivamente sobre o domínio extracelular de dimerização (subdomínio II) do receptor-2 do fator de crescimento epidérmico humano (HER2). Dessa forma, ele bloqueia a heterodimerização ligante dependente do HER2 com outros membros da família HER, incluindo EGFR, HER3 e HER4.
Como resultado, Pertuzumabe (substância ativa deste medicamento) inibe a sinalização intracelular iniciada por ligante, por meio de duas vias de sinais importantes, a de proteína quinase ativada por mitógeno (MAP) e fosfoinositide-3quinase (PI3K). A inibição dessas vias de sinalização pode resultar em parada de crescimento celular e apoptose, respectivamente. Além disso, Pertuzumabe (substância ativa deste medicamento) é o mediador de citotoxicidade celular dependente de anticorpos (CCDA).
Embora Pertuzumabe (substância ativa deste medicamento) isoladamente iniba a proliferação de células tumorais humanas, a combinação de Pertuzumabe (substância ativa deste medicamento) e Herceptin (trastuzumabe) aumentou significativamente a atividade antitumoral em modelos de xenoenxerto com superexpressão de HER2.
Farmacocinética
Em vários estudos clínicos em diversas indicações, não houve alteração no clearance (CL) de pertuzumabe em doses de 2-25 mg/kg. Com base em uma análise farmacocinética (PK) populacional que incluiu 481 pacientes, o clearance mediano de pertuzumabe foi de 0,235 L/dia e a meia-vida mediana foi de 18 dias.
A análise da PK populacional sugeriu que não há diferenças de PK com base na idade, sexo e etnia (japonesa vs. não japonesa). A albumina e peso corpóreo basais foram as covariáveis mais significativas que influenciaram o CL. O clearance diminuiu em pacientes com maiores concentrações basais de albumina e aumentou em pacientes com maior peso corpóreo.
No entanto, análises de sensibilidade realizadas na dose e esquemas recomendados de Pertuzumabe (substância ativa deste medicamento) mostraram que nos valores extremos dessas duas covariáveis não houve nenhum impacto significativo sobre a capacidade de atingir concentrações-alvo em equilíbrio dinâmico identificadas nos modelos pré-clínicos de xenoenxerto tumoral. Portanto, não há necessidade de ajustar a dose de pertuzumabe com base nessas covariáveis.
Os resultados farmacocinéticos do estudo NEOSPHERE foram compatíveis com as previsões do modelo populacional anterior.
Absorção
O pertuzumabe é administrado por infusão intravenosa. Não houve nenhum estudo sobre outras vias de administração.
Distribuição
Em vários estudos clínicos, o volume de distribuição do compartimento central (Vc) e periférico (Vp) em um paciente típico foi de 3,11 L e 2,46 L, respectivamente.
Metabolismo
O metabolismo de pertuzumabe não foi estudado diretamente. Anticorpos são eliminados principalmente por catabolismo.
Eliminação
O clearance mediano de pertuzumabe foi de 0,235 L/dia e a meia-vida mediana foi de 18 dias.
Farmacocinética em situações clínicas especiais
Insuficiência renal
Não foi conduzido nenhum estudo formal de PK em pacientes com insuficiência renal. Com base na análise de PK populacional, não se espera que insuficiência renal influencie a exposição à pertuzumabe; no entanto, apenas dados limitados de pacientes com insuficiência renal moderada e grave foram incluídos na análise de PK populacional.
Idosos
Não foram conduzidos estudos especiais sobre pertuzumabe em pacientes idosos. Em uma análise de PK populacional, não foi demonstrado que a idade afeta significativamente PK de pertuzumabe. Na análise de PK populacional, 32,5% (n=143) pacientes estavam com 65 anos de idade e 9,1% (n=40) estavam com ≥ 75 anos.
Imunogenicidade
Pacientes no estudo pivotal CLEOPATRA foram testados em diversos momentos para a presença de anticorpos antiterapêuticos (ATA) contra Pertuzumabe (substância ativa deste medicamento). Aproximadamente 6,2% (23/372) dos pacientes no braço tratado com placebo e 2,8% (11/386) dos pacientes no braço tratado com Pertuzumabe (substância ativa deste medicamento) tiveram teste positivo para ATA.
Nenhum dos 34 pacientes, apresentou reações anafiláticas/de hipersensibilidade que fossem claramente relacionadas a ATA.
Contudo, reações de hipersensibilidade grau 3 associadas a ATA detectáveis ocorreram em 0,5% (2/366) dos pacientes tratados com Pertuzumabe (substância ativa deste medicamento) em estudos fase I e II. Há poucos dados disponíveis para avaliar os efeitos da ATA na eficácia de Pertuzumabe (substância ativa deste medicamento) em combinação com Herceptin (trastuzumabe) e docetaxel.
Resultados de ensaio de imunogenicidade são altamente dependentes de diversos fatores, incluindo ensaio de sensibilidade e especificidade, metodologia de ensaio, manipulação de amostras, momento da coleta de amostra, medicamentos concomitantes e doença subjacente.
Por essas razões, a comparação de incidência de anticorpos contra Pertuzumabe (substância ativa deste medicamento) com a incidência de anticorpos contra outros produtos pode não ser clara.
Dados de segurança pré-clínica
Carcinogenicidade
Não foram realizados estudos a longo prazo em animais para avaliar o potencial carcinogênico de pertuzumabe.
Mutagenicidade
Não foram realizados estudos para avaliar o potencial mutagênico de pertuzumabe.
Comprometimento da fertilidade
Não foram realizados estudos específicos de fertilidade em animais para avaliar o efeito de pertuzumabe. Nenhum efeito adverso sobre os órgãos reprodutivos masculinos e femininos foi observado em estudos de toxicidade com doses repetidas de até seis meses de duração em macacos cynomolgus.
Teratogenicidade
Estudos de toxicologia reprodutiva foram conduzidos em macacos cynomolgus em doses de ataque de 30 a 150 mg/kg e doses de manutenção de 10 a 100 mg/kg, atingindo exposições clinicamente relevantes.
A administração de pertuzumabe do Dia de Gestação (DG) 19 até o 50 (período de organogênese) demonstrou-se embriotóxico com um aumento dose-dependente dos óbitos embriofetais entre DG 25 e 70. Foram identificados desenvolvimento renal retardado e oligoidrâmnio no DG 100.
Outro
Em macacos cynomolgus, a administração IV semanal de pertuzumabe em doses de até 150 mg/kg/dose foi geralmente bem tolerada. Com doses maiores ou iguais a 15 mg/kg, notou-se diarreia intermitente leve associada a tratamento.
Em um subgrupo de macacos, a administração crônica (7 a 26 doses semanais) resultou em episódios de desidratação relacionada à diarreia que foram tratados com hidratação intravenosa.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)