Quais as reações adversas e os efeitos colaterais do Mibo?
Resumo dos estudos clínicos de Bortezomibe IV em pacientes com mieloma múltiplo recidivado/refratário
A segurança e eficácia de Bortezomibe foi avaliada em 3 estudos com a dose recomendada de 1,3 mg/m2, incluindo um estudo Fase 3, randomizado, comparativo, versus dexametasona de 669 pacientes com mieloma múltiplo refratário ou recidivado que já haviam recebido de 1 a 3 linhas terapêuticas anteriores (M34101-039); um estudo Fase 2, braço único, aberto, multicêntrico com 202 pacientes que haviam recebido pelo menos 2 terapias anteriores e demonstraram progressão da doença na terapia mais recente (M34101-025); e um estudo clínico Fase 2, dose-resposta em mieloma múltiplo recidivado em pacientes que tiveram progressão ou recidiva da doença após terapia de primeira linha com Bortezomibe1,0 mg/m2 ou 1,3 mg/m2 (M34100-024).
Tabela 17: Reações adversas ao medicamento Bortezomibe em estudos de Fase 2 e Fase 3 de mieloma múltiplo refratário/recidivado
N° do estudo
| ||
Classificação de órgãos e sistemas do MedDRA Termo preferencial | M34101-039 (N = 331) | M34100- 024/M34100 - 025 |
Distúrbios do sangue e do sistema linfático | ||
Trombocitopenia | 115 (35%) | 97 (43%) |
Anemia | 87 (26%) | 74 (32%) |
Neutropenia | 62 (19%) | 55 (24%) |
Leucopenia | 24 (7%) | 15 (7%) |
Linfopenia | 15 (5%) | 11 (5%) |
Pancitopenia | 2 (<1%) | 6 (3%) |
Neutropenia febril | 1 (<1%) | 1 (<1%) |
Distúrbios cardíacos | ||
Arritmias | 4 (1%) | 2(<1%) |
Taquicardia | 9 (3%) | 17 (7%) |
Fibriliação atrial | 6 (2%) | 2(<1%) |
Palpitações | 5 (2%) | 4 (2%) |
Desenvolvimento agudo ou exacerbação de insuficiência cardíaca, incluindo insuficiência cardíaca crônica | 7 (2%) | 8 (4%) |
Edema pulmonar | 6 (2%) | 3 (1%) |
Choque cardiogênico* | 1 (< 1%) | - |
Aparecimento de redução da fração de ejeção do ventrículo esquerdo | 1 (< 1%) | - |
“Flutter” atrial | 1 (< 1%) | - |
Bradicardia | 3 (< 1%) | 1(<1%) |
Distúrbios do ouvido e labirinto | ||
Audição prejudicada | 1 (< 1%) | 1 (< 1%) |
Distúrbios oftalmológicos | ||
Visão turva | 9 (3%) | 25 (11%) |
Infecção e irritação conjuntiva | 14 (4%) | 7 (3%) |
Distúrbios gastrintestinais | ||
Constipação | 140 (42%) | 97 (43%) |
Diarreia | 190 (57%) | 116 (51%) |
Náusea | 190 (57%) | 145 (64%) |
Vômito | 117 (35%) | 82 (36%) |
Dor gastrintestinal e abdominal, excluindo dor oral e na garganta | 80 (24%) | 48 (21%) |
Dispepsia | 32 (10%) | 30 (13%) |
Dor faringolaringeal | 25 (8%) | 19 (8%) |
Refluxo gastroesofágico | 10 (3%) | 1 (< 1%) |
Eructação | 2 (< 1%) | 4 (2%) |
Distensão abdominal | 14 (4%) | 13 (6%) |
Estomatite e ulceração da boca | 24 (7%) | 10 (4%) |
Disfagia | 4 (1%) | 5 (2%) |
Hemorragia gastrintestinal (trato gastrintestinal superior e inferior)b | 7 (2%) | 3 (1%) |
Hemorragia retal (incluindo diarreia hemorrágica) | 7 (2%) | 3 (1%) |
Ulceração da língua | 2 (< 1%) | 1 (< 1%) |
Ânsia de vômito | 3 (< 1%) | 2 (< 1%) |
Hemorragia do trato gastrintestinal superior | 1 (< 1%) | - |
Hematemese | 1 (< 1%) | - |
Petéquias da mucosa oral | 3 (< 1%) | - |
Íleo paralítico | 1 (< 1%) | 2 (< 1%) |
Distúrbios gerais e condições no local de administração | ||
Condições astênicas | 201 (61%) | 149 (65%) |
Fraqueza | 40 (12%) | 44 (19%) |
Fadiga | 140 (42%) | 118 (52%) |
Letargia | 12 (4%) | 9 (4%) |
Mal-estar | 13 (4%) | 22 (10%) |
Pirexia | 116 (35%) | 116 (35%) |
Rigidez | 37 (11%) | 27 (12%) |
Edema de extremidades inferiores | 35 (11%) | 27 (12%) |
Neuralgia | 21 (6%) | 5 (2%) |
Dor no peito | 26 (8%) | 16 (7%) |
Irritação e dor no local de administração | 1 (< 1%) | 1 (< 1%) |
Flebite no local de administração | 1 (< 1%) | 1 (< 1%) |
Distúrbios hepatobiliares | ||
Hiperbilirrubinemia | 1 (< 1%) | - |
Testes de função hepática anormais | 3 (< 1%) | 2 (< 1%) |
Hepatite | 2 (< 1%) no estudo M34101-040c | - |
Distúrbios do sistema imunológico | ||
Hipersensibilidade ao medicamento | 1 (< 1%) | 1 (< 1%) |
Infecções e infestações | ||
Infecção do trato respiratório superior | 26 (8%) | 41 (18%) |
Nasofaringite | 45 (14%) | 17 (7%) |
Infecções do trato respiratório inferior e pulmões | 48 (15%) | 29 (13%) |
Pneumoniab | 21 (6%) | 23 (10%) |
Herpes zoster (incluindo forma multidérmica ou disseminada) | 42 (13%) | 26 (11%) |
Herpes simples | 25 (8%) | 13 (6%) |
Bronquite | 26 (8%) | 6 (3%) |
Neuralgia pós-herpética | 4 (1%) | 1 (< 1%) |
Sinusite | 14 (4%) | 15 (7%) |
Faringite | 6 (2%) | 2 (< 1%) |
Candidíase oral | 6 (2%) | 3 (1%) |
Infecção do trato urinário | 13 (4%) | 14 (6%) |
Infecção relacionada ao cateter | 10 (3%) | 6 (3%) |
Sepse e bacteremiab | 9 (3%) | 9 (4%) |
Gastroenterite | 7 (2%) | - |
Lesão, envenenamento e complicações do procedimento | ||
Complicações relacionadas ao cateter | 7 (2%) | 8 (4%) |
Investigações | ||
Aumento de ALT (alanina aminotransferase) | 3 (< 1%) | 10 (4%) |
Aumento de AST (aspartato aminotransferase) | 5 (2%) | 12 (5%) |
Aumento da fosfatase alcalina | 6 (2%) | 8 (4%) |
Aumento de GGT (Gama-glutamiltransferase) | 1 (< 1%) | 4 (2%) |
Distúrbios metabólicos e nutricionais | ||
Redução do apetite e anorexia | 112 (34%) | 99 (43%) |
Desidratação | 24 (7%) | 42 (18%) |
Hiperglicemia | 5 (2%) | 16 (7%) |
Hipoglicemia | 7 (2%) | 4 (2%) |
Hiponatremia | 8 (2%) | 18 (8%) |
Síndrome da lise tumoral | 2 (< 1%) no | - |
Estudo M34101-040c | ||
Distúrbios musculoesqueléticos e do tecido conjuntivo | ||
Dor nos membros | 50 (15%) | 59 (26%) |
Mialgia | 39 (12%) | 32 (14%) |
Artralgia | 45 (14%) | 60 (26%) |
Distúrbios do sistema nervoso | ||
Neuropatia periféricad | 120 (36%) | 84 (37%) |
Parestesia e disestesia | 91 (27%) | 53 (23%) |
Tontura, excluindo vertigem | 45 (14%) | 48 (21%) |
Cefaleia | 85 (26%) | 63 (28%) |
Disgeusia | 17 (5%) | 29 (13%) |
Polineuropatia | 9 (3%) | 1 (< 1%) |
Síncope | 8 (2%) | 17 (7%) |
Convulsões | 4 (1%) | - |
Perda da consciência | 2 (< 1%) | - |
Ageusia | 2 (< 1%) | - |
Distúrbios psiquiátricos | ||
Ansiedade | 31 (9%) | 32 (14%) |
Distúrbios renais e urinários | ||
Insuficiência ou falência renal | 21 (6%) | 21 (9%) |
Dificuldade na micção | 2 (1%) | 3 (1%) |
Hematúria | 5 (2%) | 4 (2%) |
Distúrbios respiratórios, toráxicos e do mediastino | ||
Epistaxe | 21 (6%) | 23 (10%) |
Tosse | 70 (21%) | 39 (17%) |
Dispneia | 65 (20%) | 50 (22%) |
Dispneia do exercício | 21 (6%) | 18 (8%) |
Derrame pleural | 4 (1%) | 9 (4%) |
Rinorreia | 4 (1%) | 14 (6%) |
Hemoptise | 3 (< 1%) | 2 (< 1%) |
Distúrbios da pele e do tecido subcutâneo | ||
Erupção cutânea, que pode ser prurítico, eritematoso, e pode incluir evidência de vasculite leucocitoclástica | 61 (18%) | 47 (21%) |
Urticária | 7 (2%) | 5 (2%) |
Distúrbios vasculares | ||
Hipotensão | 20 (6%) | 27 (12%) |
Hipotensão ortostática/postural | 14 (4%) | 8 (4%) |
Petéquias | 6 (2%) | 7 (3%) |
Hemorragia cerebralb | 1 (< 1%) | - |
a Todos os 228 pacientes receberam Bortezomibe na dose de 1,3 mg/m2.
b Inclui desfecho fatal.
c O estudo de Bortezomibe na dose recomendada de 1,3 mg/m2 em pacientes com mieloma múltiplo que apresentaram progressão da doença após receber pelo menos quatro terapias prévias ou após receber alta dose de dexametasona no Protocolo M34101-039.
d Incluindo todos os termos preferenciais do MedDRA HTL “neuropatia periférica NEC”.
Resumo dos estudos clínicos de Bortezomibe IV versus SC em pacientes com mieloma múltiplo recidivado
A segurança e a eficácia de Bortezomibe SC foram avaliadas em um estudo Fase 3 na dose recomendada de 1,3 mg/m2. Este foi um estudo randomizado, comparativo de Bortezomibe IV vs SC em 222 pacientes com mieloma múltiplo recidivado.
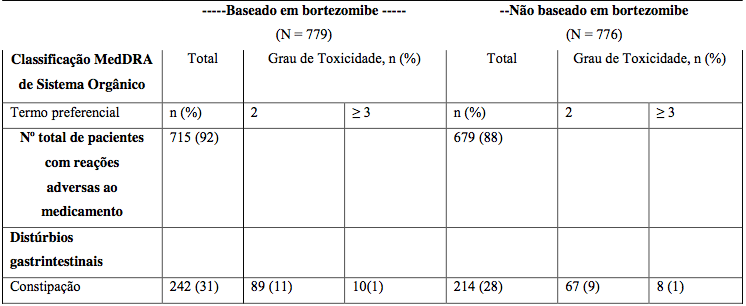
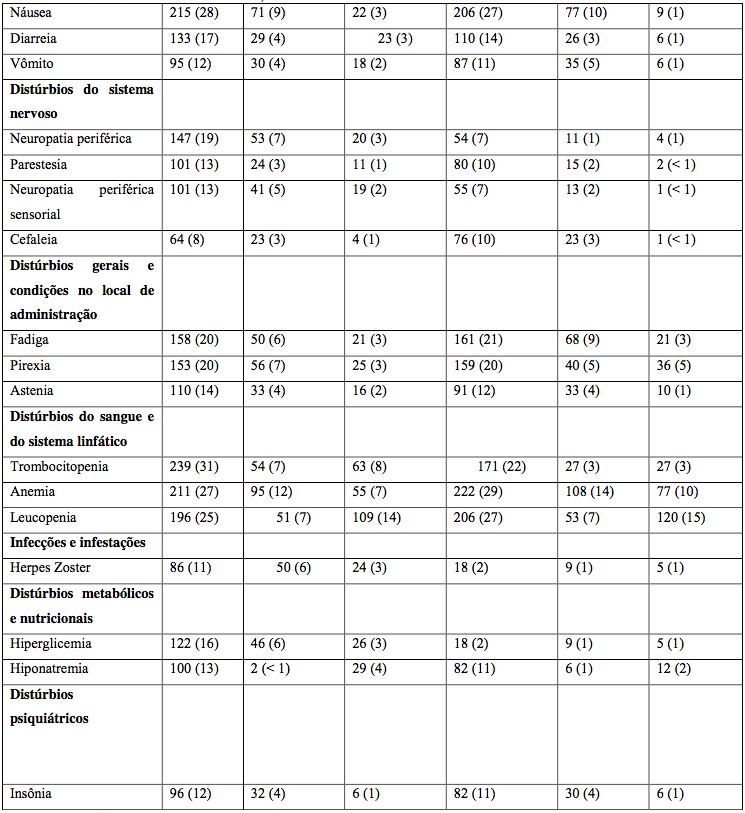
Tabela 18: Incidência de reações adversas ao medicamento Bortezomibe relatadas em ≥ 10% dos pacientes em um estudo Fase 3 mieloma múltiplo recidivado comparando Bortezomibe IV e SC

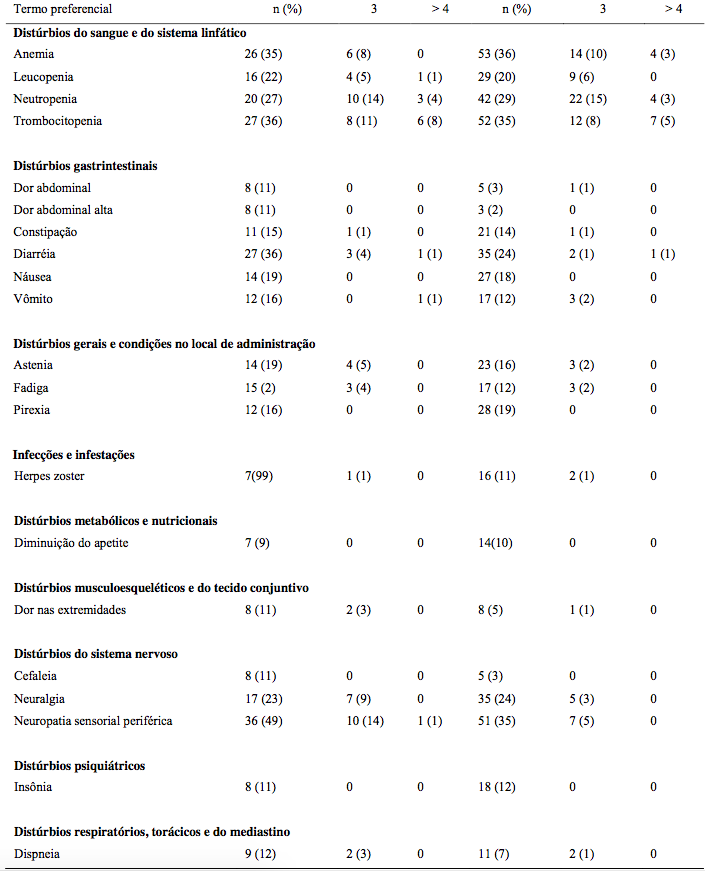
Nota: Porcentagens na coluna “Total” para cada grupo calculadas com o número de pacientes em cada grupo como denominador. Porcentagens dos subgrupos de grau de toxicidade calculadas com o número de pacientes em cada grupo como denominador.
* Graduação da toxicidade tem por base os Critérios de Terminologia Comum para Eventos Adversos do National Cancer Institute (NCI-CTCAE).
Embora geralmente os dados de segurança fossem similares para os grupos de tratamento IV e SC, a seguinte tabela destaca diferenças maiores que 10% na incidência global de reações adversas ao medicamento entre os dois braços do tratamento.
Tabela 19: Incidência de reações adversas ao medicamento com diferença > 10% na incidência geral entre os braços de tratamento no estudo de mieloma múltiplo recidivado Fase 3, comparando Bortezomibe IV e SC, por grau de toxicidade e descontinuação.
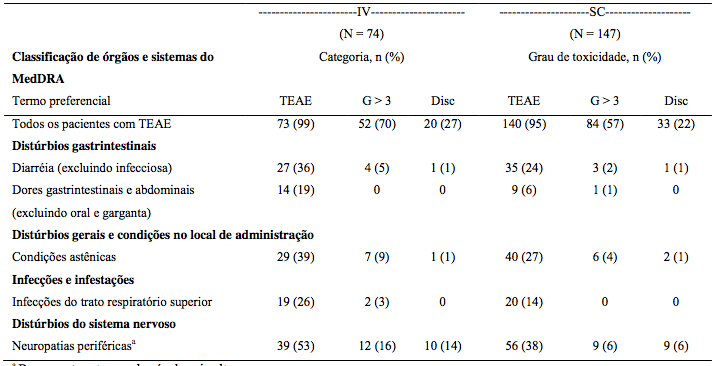
a Representa o termo de nível mais alto.
TEAE = Evento adverso emergente do tratamento.
G > 3 = Grau de toxicidade maior ou igual a 3.
Disc = Descontinuação de qualquer medicamento do estudo.
* Graduação da toxicidade tem por base os Critérios de Terminologia Comum para Eventos Adversos do National Cancer Institute (NCI-CTCAE).
Pacientes que receberam Bortezomibe por via subcutânea comparada à administração intravenosa tiveram uma incidência geral 13% menor de reações adversas grau 3 ou superior relacionadas ao medicamento (57% e 70%, respectivamente) e uma incidência de descontinuação de Bortezomibe 5% menor (22% vs 27%). A incidência geral de diarreia (24% no braço SC vs 36% no braço IV), condições astênicas (27% no braço SC vs 39% no braço IV), infecções do trato respiratório superior (14% no braço SC vs 26% no braço IV) e neuropatia periférica NEC (38% no braço SC vs 53% no braço IV) foi de 12%-15% menor no grupo subcutâneo quando comparado ao grupo intravenoso. Adicionalmente, a incidência de neuropatias periféricas que foram de grau 3 ou maiores em toxicidade foi 10% menor (6% para SC vs 16% para IV), e a taxa de descontinuação devido a neuropatias periféricas foi 8% menor para o grupo subcutâneo (5%) quando comparada ao grupo intravenoso (12%).
Em 6% dos pacientes houve o relato de reação adversa local com a administração SC, principalmente vermelhidão. Apenas em 2 (1%) dos pacientes foram relatadas reações adversas graves. Essas reações locais graves foram 1 caso de prurido e 1 caso de vermelhidão. Essas reações raramente levaram a modificações da dose e todas foram resolvidas em um tempo mediano de 6 dias.
Resumo de estudos clínicos em pacientes com mieloma múltiplo sem tratamento anterior:
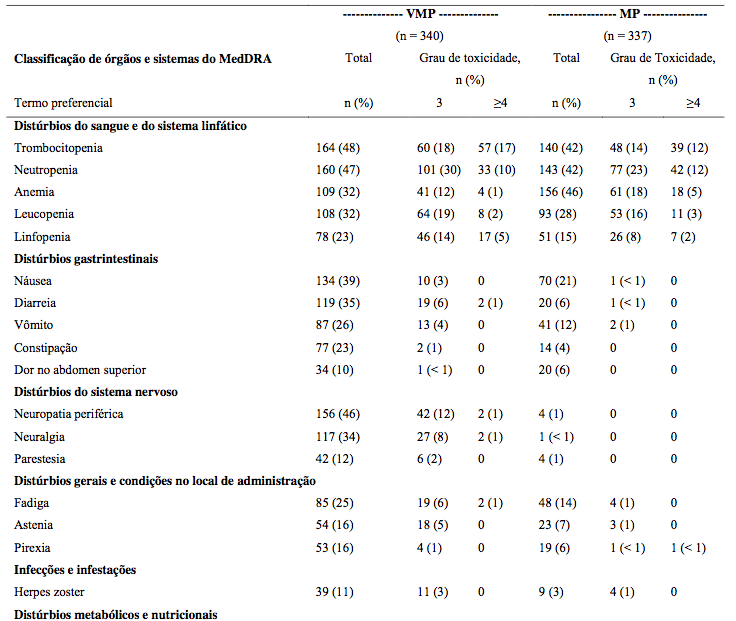
A Tabela 20 a seguir, descreve dados de segurança de 340 pacientes com mieloma múltiplo sem tratamento anterior que receberam Bortezomibe IV (1.3 mg/m2) em combinação com melfalana (9 mg/m2) e prednisona (60 mg/m2) em um estudo prospectivo de Fase 3.
Tabela 18: Reações Adversas relacionadas ao tratamento com o medicamento e relatadas em ≥ 10% dos pacientes tratados com Bortezomibe em combinação com melfalana e prednisona
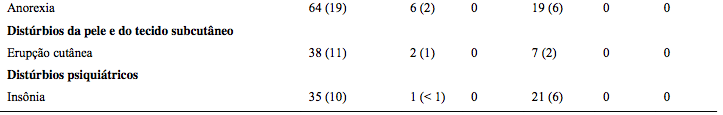
Reativação do vírus herpes zoster
Os médicos devem considerar o uso de profilaxia antiviral em pacientes que forem tratados com Bortezomibe. Nos estudos de Fase 3 em pacientes com mieloma múltiplo sem tratamento prévio, a incidência da reativação do herpes zoster foi mais comum em pacientes tratados com VMP comparado com MP (14% vs 4% respectivamente).
Profilaxia antiviral foi administrada a 26% dos pacientes no grupo VMP. A incidência de herpes zoster entre pacientes sob tratamento com VMP foi de 17% para os pacientes que não receberam profilaxia antiviral comparado com 3% dos pacientes nos quais a profilaxia antiviral foi administrada.
A tabela a seguir descreve as reações adversas consideradas como tendo pelo menos uma possível relação causal com Bortezomibe em pacientes com mieloma múltiplo sem tratamento prévio, elegíveis a transplante de células-tronco hematopoiéticas e que receberam Bortezomibe por via intravenosa (1,3 mg/m2). Quatrocentos e dez (410) pacientes foram tratados com Bortezomibe em combinação com doxorrubicina e dexametasona comparado com 411 pacientes tratados com Bortezomibe em combinação com vincristina, doxorrubicina e dexametasona no estudo MMY-3003, 239 foram tratados com Bortezomibe em combinação com dexametasona isoladamente comparado com 239 pacientes tratados com vincristina, doxorrubicina e dexametasona no estudo IFM 2005-01, e 130 foram tratados com Bortezomibe em combinação com talidomida e dexametasona comparado com 126 pacientes tratados com talidomida e dexametasona no estudo MMY-3010. Para esses 3 estudos conduzidos no cenário de transplante (MMY-3003, IFM 2005-01, MMY-3010), apenas as reações adversas relatadas durante a fase de indução do tratamento são consideradas para a tabela.
Tabela 21: Incidência das reações adversas emergentes mais frequentes (≥ 10% em todos os grupos de tratamento) durante o estágio de indução
 Vc = Bortezomibe.
Vc = Bortezomibe.
Nota: As porcentagens para cada grupo foram calculadas com o número de pacientes em cada grupo como denominador. A incidência é baseada no número de pacientes que apresentaram pelo menos 1 reação adversa, não no número de eventos. Os eventos adversos foram classificados com base no MedDRA 13.1.
Experiência pós-comercialização
Eventos adversos ao medicamento clinicamente significativos estão listados a seguir se não tiverem sido relatados anteriormente.
As frequências apresentadas a seguir refletem as taxas de relatos para reações adversas ao medicamento provenientes da experiência de pós-comercialização mundial de Bortezomibe. As frequências a seguir refletem taxas de relato e estimativas mais precisas da incidência não podem ser feitas. As reações adversas ao medicamento estão listadas por frequência.
Reação incomum (>1/1.000 e ≤1/100):
Distúrbios gastrintestinais:
Obstrução intestinal.
Reação rara (> 1/10.000 e ≤ 1/1.000):
Distúrbios do sangue e sistema linfático:
Coagulação intravascular disseminada.
Distúrbios cardíacos:
Bloqueio completo atrioventricular, tamponamento cardíaco.
Distúrbios do ouvido e labirinto:
Surdez bilateral,
Distúrbios oftalmológicos:
Herpes oftálmica, neuropatia óptica, cegueira.
Distúrbios gastrintetinais:
Colite isquêmica, pancreatite aguda.
Infecções e infestações:
Meningoencefalite herpética, choque séptico.
Distúrbios do sistema imunológico:
Angioedema.
Distúrbios do sistema nervoso:
Encefalopatia, neuropatia autonômica, síndrome de encefalopatia posterior reversível.
Distúrbios respiratórios, torácicos e do mediastino:
Doença pulmonar infiltrativa difusa aguda, hipertensão pulmonar.
Distúrbios da pele e do tecido subcutâneo:
Dermatose neutrofílica febril aguda (Síndrome de Sweet).
Reação muito rara (≤ 1/10.000, incluindo relatos isolados):
Distúrbios da pele e do tecido subcutâneo:
Síndrome de Stevens-Johnson e necrólise epidérmica tóxica.
Infecções e infestações:
Leucoencefalopatia multifocal progressiva a.
Distúrbios do sistema imunológico:
Reação anafilática.
a: Casos muito raros de infecção pelo vírus John Cunningham (JC) com causalidade desconhecida, resultando em LMP (Leucoencefalopatia multifocal progressiva) e morte foram relatados em pacientes tratados com Bortezomibe.
Atenção: este produto é um medicamento que possui nova indicação terapêutica no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique os eventos adversos pelo Sistema de Notificações em Vigilância Sanitária - NOTIVISA ou para a Vigilância Sanitária Estadual ou Municipal.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)