Qual a ação da substância do Lemtrada?
Resultados de Eficácia
A segurança e a eficácia de Alentuzumabe foram avaliadas em pacientes com EM em três estudos clínicos randomizados, avaliador-cego, com comparador ativo e em um estudo de extensão não controlado, avaliador-cego.
Os Estudos 1 e 2 (CAMMS32400507 e CAMMS323) recrutaram pacientes com EM que haviam experimentado pelo menos dois episódios durante os dois anos anteriores. Exames neurológicos foram realizados a cada doze semanas e em tempos de suspeita de recidiva. Avaliações por ressonância magnética foram realizadas anualmente. Os pacientes foram acompanhados por dois anos. Em ambos os estudos, os pacientes foram randomizados para receber Alentuzumabe 12 mg/dia por infusão intravenosa (IV) administrada uma vez ao dia durante cinco dias no Mês 0 e por três dias no Mês 12 (grupo 12 mg) ou 44 mcg de IFNB-1a por injeção subcutânea (SC) administrada três vezes por semana. O estudo 1 também incluiu um braço de dose exploratória para Alentuzumabe 24 mg/dia, administrada uma vez ao dia durante cinco dias no Mês 0 e por três dias no Mês 12 (grupo 24 mg/dia). As medidas do desfecho primário para os Estudos 1 e 2 eram a taxa de recidiva anualizada (TRA) durante dois anos e o tempo para o início da “progressão confirmada da incapacidade” (PCI), definida como um aumento de pelo menos um ponto na escala expandida do estado de incapacidade (EDSS), a partir de uma pontuação de base ≥ 1,0 (aumento de 1,5 pontos para pacientes com a pontuação basal de EDSS igual a 0) que foi mantido por seis meses.
O Estudo 1 (CAMMS32400507) incluiu pacientes com esclerose múltipla recorrente remitente (EMRR) com EDSS de 0-5, com n = 426 no grupo Alentuzumabe 12 mg e n = 202 no grupo IFNB-1a. A média de idade era 35 anos, a duração média da doença era de 4,5 anos e a pontuação média da EDSS era 2,7 no momento basal. Antes do recrutamento, os pacientes experimentaram pelo menos uma recidiva durante o tratamento com betainterferona ou acetato de glatirâmero, depois de terem sido tratados com estas drogas por pelo menos seis meses. No momento basal, a duração média de exposição às terapias anteriores para EM (≥ 1 droga usada) era de 35 meses no grupo Alentuzumabe 12 mg; 29% haviam recebido ≥ 2 terapias anteriores para EM.
A TRA foi reduzida significantemente em 49% nos pacientes no grupo Alentuzumabe 12 mg em comparação com o IFNB1a SC durante dois anos. Além disso, o tratamento com Alentuzumabe reduziu significantemente em 42% o risco de PCI em seis meses versus IFNB-1a SC durante dois anos. Os desfechos secundários principais incluíram a variação no escore de base da EDSS e dos parâmetros da ressonância magnética. A pontuação média da EDSS foi significantemente reduzida em dois anos em pacientes tratados com Alentuzumabe, indicando uma melhora na pontuação da incapacidade, enquanto a pontuação média da EDSS para os pacientes tratados com IFNB-1a aumentou significantemente em relação ao basal. Comparado com os pacientes tratados com IFNB-1a, os pacientes tratados com Alentuzumabe tinham 2,6 vezes mais probabilidade de atingir uma melhora confirmada na incapacidade. Os efeitos do tratamento nos resultados clínicos foram sustentados por efeitos significantes nas medidas da inflamação e progressão da doença por ressonância magnética, incluindo o volume do cérebro. Os resultados são mostrados na Tabela 1 e na Figura 1.
Tabela 1. Principais Desfechos Clínicos e de Ressonância Magnética do Estudo 1:
| Resultado | Alentuzumabe (n=426) | IFNB-1a SC (n=202) |
| Desfechos clínicos | ||
| Taxa de recidiva (desfecho coprimário) | ||
| TRA (95% IC) | 0,26 (0,21; 0,33) | 0,52 (0,41; 0,66) |
| Razão de taxas (95% IC) | 0,51 (0,39; 0,65) | --- |
| Valor-p | <0,0001 | --- |
| Incapacidade (PCI ≥ 6 meses; desfecho coprimário) | ||
| Estimativa de pacientes com PCI em 6 meses (95% IC) | 12,71 (9,89; 16,27) | 21,13 (15,95; 27,68) |
| Razão de risco (95% IC) | 0,58 (0,38; 0,87) | --- |
| Valor-p | 0,0084 | --- |
| Proporção de pacientes sem recidiva no Ano 2 (%) | ||
| Estimativa (95% IC) | 65,38 (60,65; 69,70) | 46,70 (39,53; 53,54) |
| Valor-p | <0,0001 | --- |
| Variação na EDSS de base no Ano 2 | ||
| Estimativa (95% IC) | -0,17 (-0,29; -0,05) | 0,24 (0,07, 0,41) |
| Valor-p | <0,0001 | --- |
| Melhora confirmada na incapacidade (MCI) | ||
| Estimativa de pacientes com RSI aos 6 meses (95% IC) | 28,82 (24,18; 34,13) | 12,93 (8,34; 19,77) |
| Razão de risco (95% IC) | 2,57 (1,57; 4,20) | --- |
| Valor-p | 0,0002 | --- |
| Desfechos de Ressonância Magnética | ||
| Variação no volume da lesão em T2-RM do basal para o Ano 2 (%) | -1,27 | -1,23 |
| Valor-p | 0,1371 | --- |
| Pacientes com lesões novas ou aumentadas em T2 durante o Ano 2 (%) | 46,2 | 67,9 |
| Valor-p | <0,0001 | --- |
| Pacientes com lesões contrastadas com gadolinio durante o Ano 2 (%) | 18,5 | 34,2 |
| Valor-p | <0,0001 | --- |
| Pacientes com lesões novas pouco intensas em T1 durante o Ano 2 (%) | 19,9 | 38,0 |
| Valor-p | <0,0001 | --- |
| Alteração na Fração Parenquimatosa Cerebral basal para o Ano 2 (%) | -0,615 | -0,810 |
| Valor-p | 0,0121 | --- |
Variação média é apresentada para a EDSS usando modelo misto para medidas repetidas. Variação mediana é apresentada para o volume da lesão em T2-RM e para a Fração Parenquimatosa Cerebral.
PCI foi definida como um aumento de pelo menos um ponto na escala expandida do estado de incapacidade (EDSS), a partir de uma pontuação de base ≥ 1 (aumento de 1,5 pontos para pacientes com a pontuação basal igual a 0) que foi mantido por seis meses.
Figura 1. Tempo para a Progressão Confirmada da Incapacidade aos 6 Meses no Estudo 1:
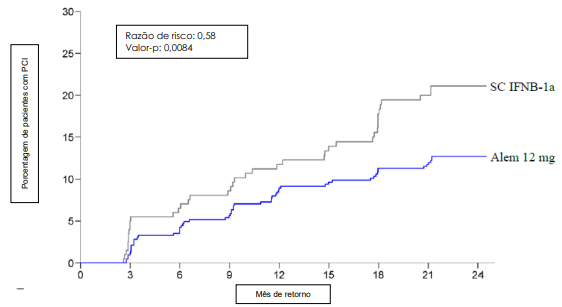
O Estudo 2 (CAMMS323) incluiu pacientes com EMRR, EDSS de 0-3,0, com n = 376 no grupo Alentuzumabe 12 mg e n = 187 no grupo IFNB-1a. A média de idade era de 33 anos, a duração média da doença era de dois anos e a pontuação média da EDSS era de 2,0 no basal. Os pacientes não haviam recebido terapia anterior para EM na entrada do estudo.
A TRA foi significantemente reduzida em 55% nos pacientes tratados com Alentuzumabe comparado com o IFNB-1a SC, em dois anos. Não houve diferença estatística significativa entre os grupos de tratamento na PCI em 6 meses; 8% dos pacientes tratados com Alentuzumabe tinham aumento sustentado na pontuação da EDSS comparados com 11% dos pacientes com IFNB-1a.
Os efeitos do tratamento nos resultados clínicos foram suportados por efeitos significantes nas medidas da inflamação e progressão da doença por ressonância magnética, incluindo volume do cérebro. Os resultados são mostrados na Tabela 2.
Tabela 2. Principais Desfechos Clínicos e de Ressonância Magnética do Estudo 2:
| Desfechos | Alentuzumabe (N=376) | IFNB-1a SC (N=187) |
| Resultados clínicos | ||
| Taxa de recidiva (desfecho coprimário) | ||
| TRA (95% CI) | 0,18 (0,13; 0,23) | 0,39 (0,29; 0,53) |
| Razão de taxas (95% IC) | 0,45 (0,32; 0,63) | --- |
| Valor-p | <0,0001 | --- |
| Incapacidade (PCI ≥ 6 meses; desfecho coprimário) | ||
| Estimativa de pacientes com ASI em 6 meses (95% IC) | 8,00 (5,66; 11,24) | 11,12 (7,32; 16,71) |
| Razão de risco (95% IC) | 0,70 (0,40; 1,23) | --- |
| Valor-p | 0,2173 | --- |
| Proporção de pacientes sem recidiva no Ano 2 (%) | ||
| Estimativa (95% IC) | 77,59 (72,87; 81,60) | 58,69 (51,12; 65,50) |
| Valor-p | <0,0001 | --- |
| Variação na EDSS do basal para o Ano 2 | ||
| (95% IC) | -0,14 (-0,25; -0,02) | -0,14 (-0,29; 0,01) |
| Valor-p | 0,4188 | --- |
| Resultados da Ressonância Magnética | ||
| Variação no volume da lesão em T2-RM do basal para o Ano 2 (%) | -9,3 (-19,6; -0,2) | -6.5 (-20,7; 2,5) |
| Valor-p | 0,3080 | --- |
| Pacientes com lesões novas ou aumentadas em T2 durante o Ano 2 (%) | 48,5 | 57,6 |
| Valor-p | 0,0352 | --- |
Pacientes com lesões contrastadas com gadolinio durante o Ano 2 (%) | 15,4 | 27,0 |
| Valor-p | 0,0008 | --- |
| Pacientes com lesões novas pouco intensas em T1 durante o Ano 2 (%) | 24,0 | 31,4 |
| Valor-p | 0,0545 | --- |
| Variação na Fração Parenquimatosa Cerebral do basal para o Ano 2 (%) | -0,867 | -1,488 |
| Valor-p | <0,0001 | --- |
Variação média é apresentada para a EDSS usando modelo misto para medidas repetidas. Variação mediana é apresentada para o volume da lesão em T2-RM e para a Fração Parenquimatosa Cerebral.
PCI foi definida como um aumento de pelo menos um ponto na escala expandida do estado de incapacidade (EDSS), a partir de uma pontuação de base ≥ 1 (aumento de 1,5 pontos para pacientes com a pontuação basal igual a 0) que foi mantido por seis meses.
O Estudo 3 (CAMMS223) avaliou a segurança e a eficácia de Alentuzumabe em pacientes com EMRR durante o curso de três anos. Os pacientes tinham um EDSS de 0-3,0, pelo menos dois episódios clínicos de EM nos dois anos anteriores e ≥ 1 lesão contrastada por gadolínio na entrada no estudo. Os pacientes foram tratados com Alentuzumabe 12 mg/dia (n = 108) ou 24 mg/dia (n = 108), administrado uma vez por dia durante cinco dias no Mês 0 e durante três dias no Mês 12 ou 44 mcg de IFNB-1a SC, administrado três vezes por semana durante três anos. Quarenta e seis pacientes receberam um terceiro ciclo planejado de tratamento com 12 mg/dia ou 24 mg/dia de Alentuzumabe durante três dias no Mês 24.
Em três anos, Alentuzumabe 12 mg reduziu o risco de PCI em seis meses em 76% (razão de risco 0,24 [95% IC: 0,110; 0,545], p > 0,0006) e reduziu a TRA em 67% (razão de risco 0,33 [95% IC: 0,196, 0,552], p < 0,0001) comparado com o IFNB-1a SC.
No subgrupo de pacientes com esclerose múltipla remitente-recorrente (EMRR) com 2 ou mais recidivas no ano anterior e pelo menos 1 lesão contrastada por gadolínio em T1 no início do estudo, a taxa de recidivas anualizada foi de 0,26 (IC de 95%: 0,20, 0,34) no grupo tratado com Alentuzumabe (n = 205) e 0,51 (IC de 95%: 0,40, 0,64) no grupo IFNB-1a (n = 102) (p <0,0001). Essa análise inclui apenas dados dos estudos de Fase 3 (CAMMS324 e CAMMS323) devido a diferenças nos algoritmos de aquisição de imagem por ressonância magnética entre os estudos de Fase 2 e Fase 3. Estes resultados foram obtidos a partir de uma análise post hoc e devem ser interpretados com cautela.
Dados de eficácia em longo prazo
O Estudo 4 forneceu dados de eficácia por até 6 anos desde o início dos Estudos 1 e 2. Dos pacientes tratados com 12 mg de Alentuzumabe nos Estudos 1 e 2, 91,8% participaram do Estudo 4.
A Tabela 3 apresenta os principais desfechos clínicos e desfechos de Ressonância Magnética no Estudo 4 para pacientes dos Estudos 1 e 2 que receberam 12 mg de Alentuzumabe.
Tabela 3. Principais desfechos clínicos e de Ressonância Magnética do Estudo 4 para pacientes que receberam 12 mg de Alentuzumabe e participaram dos Estudos 1 e 2:
| --- | Pacientes do Estudo 1 que participaram do Estudo 4 | Pacientes do Estudo 2 que participaram do Estudo 4 |
| Desfechos clínicos | ||
| Taxa de recidiva anualizada (TRA) Variação, anos individuais 3-6 | 0,12 – 0,19 | 0,16 – 0,24 |
| Pacientes sem recidivas Variação, anos individuais 3-6 | 83,2% - 88,3% | 78,9% - 86,1% |
| Incapacidade (Progressão Confirmada da Incapacidade [PCI]) 1 Pacientes com PCI após 6 meses, anos acumulados 0- 6 (95% CI) | 22,3% (18,3%, 27,1%) | 29,7% (25,4%, 34,5%) |
| Mudança de pontuação basal em EDSS2 Variação, anos individuais 3-6 | -0,08 – 0,09 | -0,02 – 0,18 |
| Desfechos de Ressonância Magnética | ||
| Pacientes com lesões novas ou aumentadas em T2, % Variação, anos individuais 3-6 | 27,4% - 33,2% | 29,8% - 33,0% |
| Pacientes com novas lesões contrastadas com gadolínio, % Variação, anos individuais 3-6 | 9,4% - 13,3% | 10,0% - 13,5% |
| Mediana anual da variação no volume em T2-MR, % Variação, anos individuais 3-6 | 0,7% - 1,5% | -0,6% - 0,5% |
| Mediana anual da alteração na fração parenquimatosa cerebral, % Variação, anos individuais 3-6 | -0,19% - -0,17% | -0,19% - -0,09% |
1 PCI foi definida como um aumento de pelo menos um ponto na escala expandida do estado de incapacidade (EDSS), a partir de uma pontuação de base ≥ 1,0 (aumento de 1,5 pontos para pacientes com a pontuação basal igual a 0) que foi mantido por seis meses.
2 Estimativa usando modelo misto para medidas repetidas.
A TRA de pacientes originalmente tratados com Alentuzumabe permaneceu baixa ao longo do Estudo 4 (Tabela 3), com uma alta porcentagem de pacientes sem recidivas em cada ano do acompanhamento. A maioria dos pacientes nunca sofreu progressão confirmada da incapacidade. A média de pontuação de incapacidade foi estável ou melhorada na maioria dos anos. Durante 6 anos desde o primeiro tratamento com Alentuzumabe, 32,7% e 42,5% dos pacientes dos Estudos 1 e 2, respectivamente, atingiram MCI.
Pacientestambém continuaram a mostrar um risco menor de formação de novas lesões em T2 ou novas lesões contrastadas com gadolínio em cada ano do acompanhamento. O volume de lesões em T2 permaneceu menor ao longo do período de tratamento em comparação com o tratamento inicial com Alentuzumabe (mediana da alteração em porcentagem no Ano 6, -8,5 e -0,1 para as populações dos Estudos 1 e 2, respectivamente), com apenas uma pequena variação de ano para ano. A mediana anual da alteração (redução) na fração parenquimatosa cerebral foi menor durante o período de extensão quando comparada com os estudos anteriores. Aproximadamente metade (51,2%) dos pacientes inicialmente tratados com 12 mg de Alentuzumabe/dia nos Estudos 1 e 2 que participaram do Estudo 4, receberam apenas dois ciclos de tratamento com Alentuzumabe e nenhum outro tratamento modificador da doença ao longo dos 6 anos de acompanhamento.
Esses resultados demonstram a eficácia duradoura de Alentuzumabe na redução do risco de recidivas de EM, na supressão da formação de novas lesões de EM, na diminuição da perda de volume cerebral (atrofia) e da piora da incapacidade na ausência de tratamento contínuo.
Ciclos de tratamento adicionais conforme necessidade
No estudo 4, 40% dos pacientes inicialmente tratados com Alentuzumabe 12 mg/dia nos Estudos 1 e 2 receberam ciclos de tratamento adicionais mediante evidência documentada de EM ativa (recidivas e/ou desfechos de ressonância magnética) e decisão do médico pelo retratamento. Ciclos adicionais de tratamento foram administrados na dose de 12 mg/dia, durante três dias consecutivos (dose total de 36 mg), pelo menos 12 meses depois do tratamento anterior. Os resultados de eficácia para esses pacientes, por ciclo de tratamento, estão apresentados na Tabela 4.
Tabela 4. Principais desfechos clínicos e de Ressonância Magnética antes e depois de ciclos adicionais de tratamento no Estudo 4 para pacientes que receberam inicialmente 12 mg de Alentuzumabe nos Estudos 1 e 2 (amostra da população)
| --- | Terceiro ciclo de tratamento (n = 321) | Quarto ciclo de tratamento (n = 120) | ||
| Média de tempo para atingir o critério para retratamento, em anos desde o ciclo anterior (DP) | 2,4 (1,34) | 2,1 (1,13) | ||
| Desfechos clínicos | Ano antes do 3° ciclo | Ano após 3° ciclo | Ano antes do 4° ciclo | Ano após 4° ciclo |
| Taxa de recidiva anualizada (TRA) (95% IC) | 0,79 (0,73; 0,87) | 0,18 (0,14; 0,24) | 0,83 (0,73; 0,95) | 0,25 (0,17; 0,36) |
| Pontuação basal em EDSS observado (DP) | 2,89 (1,514) | 2,69 (1,628) | 3,39 (1,533) | 2,97 (1,694) |
| Desfechos de Ressonância Magnética | ||||
| Pacientes com lesões contrastadas com gadolínio | 32,2% | 11,9%35,9% | 33,3% | 18,9% |
| Pacientes com lesões novas ou aumentadas em T2 | 50,8% | 35,9% | 49,6% | 35,8% |
A taxa de recidiva, atividade em Ressonância Magnética e pontuação média de EDSS melhoraram no ano seguinte ao terceiro e quarto ciclo de tratamento com Alentuzumabe quando comparados com os desfechos no ano anterior (vide Tabela 4).
Esses resultados demonstram que pacientes com EM ativa, após ciclo de tratamento prévio com Alentuzumabe, podem atingir melhora nos resultados clínicos e de Ressonância Magnética (TRA reduzida, redução das lesões e estabilização da incapacidade) após ciclos de tratamento adicionais com Alentuzumabe.
Os benefícios e riscos de 5 ou mais ciclos de tratamento não foram totalmente estabelecidos, porém os resultados sugerem que o perfil de segurança não é alterado com ciclos adicionais. Se ciclos adicionais forem indicados estes devem ser administrados pelo menos 12 meses depois do ciclo anterior.
Características Farmacológicas
Mecanismo de ação
Alentuzumabe liga-se ao CD52, um antígeno da superfície celular presente em níveis altos em linfócitos T e B e em níveis menores em “células matadoras” (“killer cells”) naturais, monócitos e macrófagos. Há pouco ou nenhum CD52 detectado em neutrófilos, células plasmáticas ou células-tronco da medula óssea. Alentuzumabe atua através da citólise celular dependente de anticorpo e lise mediada por complemento, depois da ligação à superfície celular de linfócitos T e B.
O mecanismo pelo qual Alentuzumabe exerce seu efeito terapêutico na esclerose múltipla é desconhecido, mas pode envolver a imunomodulação através da depleção e repopulação de linfócitos. As pesquisas sugerem que os efeitos imunomoduladores potenciais na EM podem incluir alterações no número, proporções e propriedades de alguns subgrupos de linfócitos pós-tratamento.
Farmacodinâmica
Alentuzumabe causa depleção de linfócitos T e B circulantes depois de cada ciclo de tratamento, com os menores níveis observados um mês após um ciclo de tratamento. A repopulação de linfócitos ocorre com o tempo, com recuperação completa das células B, geralmente dentro de seis meses. As contagens de linfócitos T aumentam mais lentamente em direção ao normal, mas geralmente não retornam ao valor de base, até doze meses pós-tratamento. Aproximadamente 40% dos pacientes tinham contagens totais de linfócitos atingindo o limite inferior da normalidade em seis meses depois de cada ciclo de tratamento, e aproximadamente 80% dos pacientes apresentavam contagem total de linfócitos atingindo o limite inferior da normalidade até doze meses depois de cada ciclo de tratamento. Neutrófilos, monócitos, eosinófilos, basófilos e células matadoras naturais são afetados apenas transitoriamente por Alentuzumabe.
Fertilidade em pacientes do sexo masculino
Os dados em um pequeno número (N = 13) de pacientes do sexo masculino em dois ensaios clínicos sugerem que o tratamento com alentuzumabe não tem um impacto adverso na qualidade, quantidade ou motilidade dos espermatozoides.
Farmacocinética
A farmacocinética de Alentuzumabe foi avaliada em um total de duzentos e dezesseis pacientes com EMRR, que receberam infusões IV de 12 mg/dia ou 24 mg/dia por cinco dias consecutivos, seguido por três dias consecutivos, doze meses após o ciclo inicial de tratamento. As concentrações séricas aumentaram com cada dose consecutiva dentro de um ciclo de tratamento, com as maiores concentrações ocorrendo depois da última infusão do ciclo. A administração de 12 mg/dia resultou em uma Cmáx de 3014 ng/mL no Dia 5 do ciclo inicial de tratamento e 2276 ng/mL no Dia 3 do segundo ciclo de tratamento. A meia-vida alfa foi próxima de dois dias e comparável entre os ciclos, levando a concentrações séricas baixas ou não detectáveis dentro de aproximadamente trinta dias depois de cada ciclo de tratamento.
A farmacocinética da população de Alentuzumabe foi melhor descrita por um modelo linear de dois compartimentos. A depuração sistêmica diminuiu com a contagem de linfócitos devido à perda do antígeno CD52 na periferia; entretanto, a diminuição do Ciclo 1 para o Ciclo 2 foi menos de 20%. O volume de distribuição central foi proporcional ao peso corporal e estava próximo do volume do líquido extracelular (14,1 L), sugerindo que Alentuzumabe está amplamente confinado ao sangue e ao espaço intersticial. Não foi observado efeito da idade, raça ou gênero na farmacocinética de Alentuzumabe.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)