Qual a ação da substância do Jemperli?
Resultados de Eficácia
Câncer endometrial com deficiência de enzimas de reparo (dMMR) ou alta instabilidade de microssatélite (MSI-H)
A eficácia e a segurança de Dostarlimabe foram investigadas no estudo GARNET, um estudo de fase 1 de escalonamento de dose, multicêntrico, aberto, realizado em pacientes com câncer endometrial recorrente ou avançado que progrediram durante ou após tratamento à base de platina.
O estudo GARNET incluiu coortes de expansão em indivíduos com tumores sólidos recorrentes ou avançados que têm opções de tratamento disponíveis limitadas. A Coorte A1 recrutou pacientes com câncer endometrial com deficiência de enzimas de reparo (dMMR) ou alta instabilidade de microssatélite (MSI-H), que progrediu durante ou após tratamento à base de platina.
Os pacientes receberam 500 mg de Dostarlimabe a cada 3 semanas por 4 ciclos, seguidos por 1000 mg a cada 6 semanas. O tratamento continuou até a toxicidade inaceitável ou até que a progressão da doença - sintomática, rapidamente progressiva - exigisse intervenção urgente ou que ocorresse um declínio no performance status (PS). Dostarlimabe foi administrado por no máximo 220 semanas (51 meses) de tratamento e 24% dos indivíduos que receberam qualquer quantidade de Dostarlimabe receberam tratamento > 102 semanas (2 anos). As principais medidas de resultado primário de eficácia foram taxa de resposta objetiva (ORR) e duração da resposta (DOR), avaliadas pela revisão cega de radiologistas centrais independentes (BICR), conforme o RECIST v1.1. Os desfechos secundários incluíram taxa de controle da doença (DCR) e sobrevida livre de progressão (PFS), ambos avaliados pela revisão BICR de acordo com RECIST v1.1; e sobrevida global (OS).
Todos os pacientes incluídos no conjunto de análises de eficácia primária e secundária tiveram um período mínimo de acompanhamento de 24 semanas a partir da primeira dose, independentemente de terem realizado um exame pós-tratamento.
Um total de 143 pacientes com câncer de endométrio dMMR/MSI-H foram avaliados quanto à eficácia no estudo GARNET.
Entre esses 143 pacientes, as características basais foram:
- Média de idade de 65 anos (52% com 65 anos ou mais); 77% branco, 3% asiático, 3% preto; e performance status (PS) do ECOG (Grupo de Oncologia Cooperativa Oriental) 0 (39%) ou PS 1 (61%).
O número mediano de linhas anteriores de terapias foi um:
- 63% das pacientes tiveram uma linha anterior, 37% tiveram duas ou mais linhas anteriores. Quarenta e nove pacientes (34%) receberam tratamento apenas no cenário neoadjuvante ou adjuvante antes de participar do estudo.
A identificação da situação do tumor dMMR/MSI-H foi determinada prospectivamente com base em testes locais.
Os ensaios de diagnóstico (IHQ [imuno-histoquímica], PCR [reação em cadeia da polimerase] ou NGS [sequenciamento de nova geração]) disponíveis foram usados para a detecção da expressão de dMMR / MSI-H em material tumoral. A maioria usou IHQ, por ser o ensaio mais comum disponível.
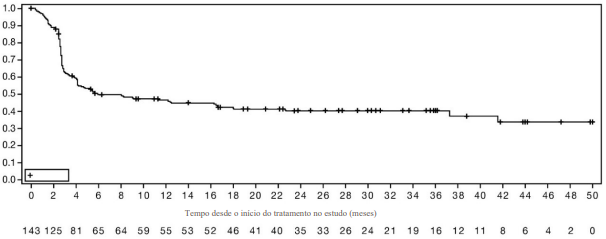
Os resultados da eficácia são mostrados na Tabela 1 e Figura 1.
Tabela 1: Resultados de eficácia em GARNET para pacientes com câncer de endométrio dMMR/MSI-H
| Desfecho | Dostarlimabe (N=143)a |
| Desfechos primários | |
| Taxa de resposta objetiva (ORR) | |
| ORR n (%) (95% CI) | 65 (45,5) (37,1, 54,0) |
| Taxa de resposta completa, n (%) | 23 (16,1) |
| Taxa de resposta parcial, n (%) | 42 (29,4) |
| Duração da resposta (DOR)b | |
| Mediana em meses | Não alcançado |
| Pacientes com duração ≥ 12 meses, n (%) | 52 (80,0) |
| Pacientes com duração ≥ 24 meses, n (%) | 29 (44,6) |
| Desfechos secundários | |
| Sobrevida livre de progressão (PFS) | |
| Mediana em meses (95% CI)c | 6,0 (4,1; 18,0) |
| Número (%) de pacientes com o evento | 83 (58.0) |
| Probabilidade de 6-meses de PFS, (95% CI)c | 49,5% (41,0; 57,5) |
| Probabilidade de 9-meses de PFS, (95% CI)c | 48,0% (39,4; 56,0) |
| Probabilidade de 12-meses de PFS, (95% CI)c | 46,4% (37,8; 54,5) |
| Sobrevida Global (OS) | |
| Mediana em meses | Não alcançado |
| Número (%) de pacientes com o evento | 55 (38,5) |
| Taxa de controle de doença (DCR)d | |
| DCR n (%) (95% CI) | 86 (60,1) (51,6, 68.2) |
CI: intervalo de confiança a Dados de eficácia com acompanhamento médio de 27,6 meses (data limite 01 de novembro de 2021).
b Para pacientes com resposta parcial ou completa.
c Pelo método de Kaplan-Meier.
d Inclui paciente com resposta completa, resposta parcial e doença estável por pelo menos 12 semanas.
Figura 1: Curva de Kaplan-Meier de sobrevida livre de progressão por RECIST v1.1, BICR, em pacientes com CE dMMR/MSIH (N=143)
Pacientes idosos
Dos 515 pacientes tratados com Dostarlimabe em monoterapia (população GARNET AI1 no momento do corte de dados 01 de Março de 2020), 51% tinham menos de 65 anos, 38% tinham 65-75 anos e 12% tinham 75 anos ou mais. Não se observou aumento nos riscos de segurança em sujeitos mais velhos em comparação com indivíduos mais jovens.
Nos 72 pacientes com CE dMMR/MSI-H (população IA1 no momento do corte de dados 01 de março de 2020) na análise de eficácia, a ORR por BICR (IC 95%) foi de 43,2% (27,1%, 60,5%) em pacientes com menos de 65 anos e 48,6% (31,4%, 66,0%) em pacientes com 65 anos ou mais.
Nos 105 pacientes com CE dMMR/MSI-H (população IA2 no momento do corte de dados em 01 de março de 2020) na análise de eficácia, a ORR por BICR (95% CI) foi de 45,3% (31,6%, 59,6%) em pacientes com menos de 65 anos e 44,2% (30,5%, 58,7%) em pacientes com 65 anos ou mais.
População pediátrica
A segurança e eficácia de Dostarlimabe em crianças e adolescentes com menos de 18 anos de idade não foram estabelecidas.
Características Farmacológicas
Grupo farmacoterapêutico: agente antineoplásico, anticorpo monoclonal e conjugado anticorpo medicamento.
Código ATC: L01FF07.
Mecanismo de ação
Dostarlimabe é um anticorpo monoclonal humanizado (mAb) imunoglobulina G4 (IgG4) contra proteína de morte celular programada 1 (PD-1), derivado de uma linhagem celular estável do ovário de hamster chinês (CHO).
A interação dos ligantes de PD-1, PD-L1 e PD-L2, ao receptor PD-1 encontrado nas células T inibe a proliferação de células T e a produção de citocinas. A regulação positiva dos ligantes PD-1 ocorre em alguns tumores e a sinalização por essa via pode contribuir para a inibição da vigilância imune ativa de tumores por células T. O Dostarlimabe é um anticorpo monoclonal humanizado (mAb) do isótipo imunoglobulina G4 (IgG4) que se liga à PD-1, resultando em inibição da ligação com PD-L1 e PD-L2, liberando a inibição da resposta imune mediada por PD-1, incluindo a resposta imune antitumoral. Nos modelos de tumor singênico de camundongos, o bloqueio da atividade da PD-1 resultou em crescimento reduzido do tumor.
Efeitos farmacodinâmicos
Com base nas relações de eficácia e segurança na exposição, não há diferenças clinicamente significativas em eficácia e segurança ao dobrar a exposição ao Dostarlimabe. A ocupação total do receptor, medida tanto pela ligação direta ao PD-1 quanto pelo ensaio funcional de produção de IL-2, foi mantida durante todo o intervalo de administração na dose terapêutica recomendada.
Farmacocinética
A farmacocinética de Dostarlimabe foi caracterizada usando análise farmacocinética da população de 546 pacientes com vários tumores sólidos, incluindo 288 pacientes com câncer endometrial. A farmacocinética de Dostarlimabe é proporcional à dose. O Dostarlimabe mostra um acúmulo de aproximadamente 2 vezes (Cmín) quando administrado na dose terapêutica pretendida (500 mg administrados por via intravenosa a cada 3 semanas por 4 ciclos, seguidos por 1000 mg a cada 6 semanas), iniciando no ciclo 4 até o ciclo 12, consistente com a meia-vida terminal.
Absorção
Dostarlimabe é administrado por via intravenosa e, portanto, as estimativas de absorção não são aplicáveis.
Distribuição
O volume de distribuição médio geométrico do Dostarlimabe no estado estacionário é de aproximadamente 5,26 L (CV% de 14,2%).
Metabolismo
O Dostarlimabe é um mAb IgG4 terapêutico que espera-se ser catabolizado em pequenos peptídeos, aminoácidos e pequenos carboidratos pelo lisossomo através da endocitose por fase líquida ou mediada por receptor. Os produtos de degradação são eliminados por excreção renal ou devolvidos ao pool de nutrientes sem efeitos biológicos.
Eliminação
A depuração média geométrica é de 0,00682 L/h (CV% de 30,2%) no estado estacionário. A média geométrica da meia-vida terminal (t1/2) no estado estacionário é de 23,5 dias (CV% de 22,4%).
Linearidade/não linearidade
A exposição (concentração máxima [Cmáx] e a área sob a curva de concentração-tempo [AUC0-tau] e [AUC0-inf]), foi aproximadamente proporcional à dose.
Populações especiais de pacientes
Uma análise populacional da farmacocinética dos dados dos pacientes indica que não há efeitos clinicamente importantes de idade (faixa: 24 a 86 anos), sexo ou raça, etnia ou tipo de tumor na depuração do Dostarlimabe. Esse modelo de farmacocinética populacional também indica que alterações na função renal (normal a moderada) e hepática (normal a comprometimento leve) não alteram a disposição do Dostarlimabe.
Carcinogênese/mutagênese
Não foram realizados estudos para avaliar o potencial do Dostarlimabe para carcinogenicidade ou genotoxicidade.
Toxicologia Reprodutiva
Não foram realizados estudos de reprodução animal com Dostarlimabe. Acredita-se que a via PD-1/PD-L1 esteja envolvida na manutenção da tolerância ao feto durante a gravidez. Foi demonstrado que o bloqueio da sinalização do PD-L1 em modelos murinos de gravidez interrompe a tolerância ao feto e resulta em aumento na perda fetal.
Fertilidade
Não foram realizados estudos de fertilidade animal com Dostarlimabe. Nos estudos toxicológicos de dose repetida de 1 e 3 meses em macacos, não houve efeitos notáveis nos órgãos reprodutores masculino e feminino; no entanto, muitos animais nesses estudos não estavam sexualmente maduros.
Toxicologia e/ou farmacologia animal
A segurança não clínica do Dostarlimabe foi avaliada em estudos de toxicidade de dose repetida de 1 e 3 meses em macacos Cynomolgus, administrados com doses intravenosas de 10, 30 ou 100 mg/kg/semana. Nenhuma descoberta de significância toxicológica foi observada em ambos os estudos, exceto que um macaco macho recebendo 10 mg/kg/semana foi sacrificado devido a achados cutâneos crônicos e generalizados não resolvidos no estudo de três meses. O nível de efeito adverso não observado (NOAEL) foi ≥100 mg/kg no estudo de 1 mês, correspondendo a múltiplas exposições de 35 e 28 vezes a exposição em humanos em doses de 500 e 1000 mg, respectivamente. O NOAEL não foi determinado no estudo de três meses, pois a relação entre a eutanásia prematura do animal e Dostarlimabe não pôde ser descartada.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)