Qual a ação da substância do Fuzeon?
Resultados de Eficácia
Estudos com pacientes submetidos ao tratamento antirretroviral prévio
Os estudos clínicos T20-301 (TORO-1) e T20-302 (TORO-2), randomizados, controlados, abertos e multicêntricos foram conduzidos com pacientes infectados com HIV-1, com, pelo menos, três a seis meses de tratamento prévio com inibidores de transcriptase reversa nucleosídeos (ITRN) e não nucleosídeos (ITRNN) e inibidores da protease (IP). Todos os pacientes receberam regime otimizado de base (OB), consistindo em três a cinco agentes antirretrovirais selecionados com base no histórico do paciente e também nas avaliações basais de resistência viral genotípica e fenotípica.
Os pacientes foram randomizados na proporção de 2:1 para Enfuvirtida (90 mg, SC, duas vezes ao dia) + OB ou somente OB.
Os estudos TORO-1 e TORO-2 foram bastante similares em população de pacientes estudada, desenho, critérios de seleção de pacientes (com exceção da duração prévia de exposição aos antirretrovirais e do número de inibidores de protease), condução, monitoramento e planejamento das análises. Por isso, foi programada prospectivamente a análise conjunta dos dados dos dois estudos. Portanto, são apresentados resultados da análise de 48 semanas, de forma combinada, possibilitando a análise de uma amostra maior e uma estimativa mais precisa das diferenças entre tratamentos do grupo com e sem Enfuvirtida.
As características demográficas combinadas da população de intenção de tratamento (ITT) dos estudos TORO-1 e TORO-2 são apresentadas na Tabela 1. Os pacientes foram previamente expostos a uma mediana de 12 antirretrovirais, pelo tempo mediano de sete anos.
Tabela 1. Estudo TORO-1 e TORO-2 – Demografia combinada dos pacientes (ITT):
| - | Enfuvirtida + OB n = 661 | OB |
Sexo | - | - |
| Masculino | 90% | 90% |
| Feminino | 10% | 10% |
| Etnia | - | - |
| Branca | 89% | 89% |
| Negra | 8% | 7% |
| Idade média (anos) | 42 (16 – 67) | 44 (24 – 82) |
| Mediana basal do HIV-1 RNA (log10 cópias/mL) | 5,2 (3,5 – 6,7) | 5,1 (3,7 – 7,1) |
| Mediana basal do número de células CD4 (células / mm3) | 88 (1 – 994) | 97 (1 – 847) |
As mudanças na semana 48 em relação ao basal dos estudos TORO-1 e TORO-2 combinados estão resumidas na Tabela 2, e todas foram significativamente maiores no grupo de tratamento com Enfuvirtida .
Tabela 2. Estudos TORO-1 e TORO-2 – Resultados combinados do tratamento controlado e randomizado na semana 48 (ITT†):
Resultados | Enfuvirtida + OB (n = 661) | OB |
Redução do HIV-1 RNA | -1,5 | -0,6* |
Pacientes com diminuição > 1 log de HIV RNA em relação ao valor basal § | 247 (37%) | 57 (17%)* |
Pacientes com HIV RNA < 400 cópias/mL§ | 201 (30%) | 40 (12%)* |
Pacientes com HIV RNA < 50 cópias/mL§ | 121 (18%) | 26 (8%)* |
Aumento do número de células CD4+ em relação ao valor basal (células/mm3)‡ | +91 | +45* |
†ITT – Recebeu tratamento e teve pelo menos um acompanhamento pós-RNA basal.
* Estatisticamente significativo p < 0,05.
‡ Último valor observado.
§ Descontinuação e falha virológica = falha. Duas visitas consecutivas para confirmar a resposta virológica.
A porcentagem de pacientes que alcançaram carga viral menor que 400 cópias/mL até a semana 48 foi 30% entre os pacientes com o regime com Enfuvirtida + OB, em comparação com 12% entre os pacientes que receberam apenas regime otimizado (Tabela 2).
A análise do tempo até a falha virológica é apresentada na Figura 1. O tempo médio até a falha virológica no grupo com Enfuvirtida + OB foi de 32 semanas, significativamente maior que no grupo com OB apenas (11 semanas).
Figura 1 – Análise do tempo até a falha virológica nos estudos TORO-1 e 2 combinados até a semana 48 (população intenção de tratamento – ITT):
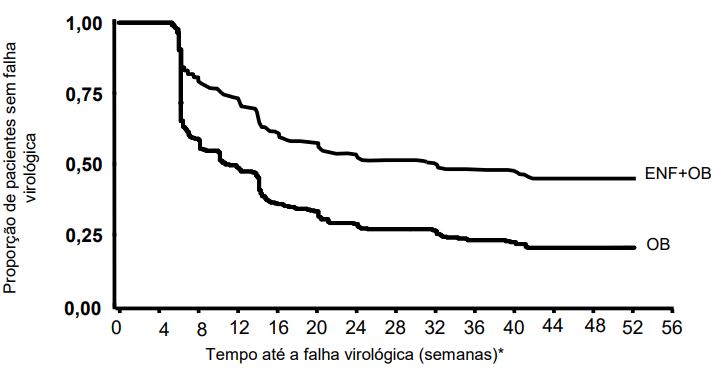
* Definição de falha virológica pelo protocolo (baseada em duas medidas consecutivas): redução menor que 0,5 log10 HIV-1 RNA do período basal até a semana 8; redução menor que 1,0 log10 HIV-1 RNA até a semana 16; aumento maior ou igual a 1,0 log10 HIV-1 RNA após resposta de, pelo menos, 2,0 log10 HIV-1 RNA.
Os resultados dos estudos também foram analisados em subgrupos, e a terapia com Enfuvirtida foi associada à maior porcentagem de pacientes que atingiram HIV-1 RNA menor que 400 cópias/mL em todos os subgrupos, baseando-se no número de células CD4+ no período basal, no valor basal de HIV-1 RNA, no número prévio de antirretrovirais e no número de antirretrovirais ativos no regime otimizado. No entanto, pacientes com CD4+ > 100 células/mL, HIV-1 RNA inicial < 5,0 log10 cópias/mL, experiência com menos de 10 antirretrovirais prévios e um ou mais fármacos ativos no regime antirretroviral, tiveram maior chance de atingir carga viral menor que 400 cópias/mL com os dois tratamentos (Tabela 3).
Tabela 3. Proporção de pacientes que atingiram HIV-1 RNA menor que 400 cópias/mL na semana 48 por subgrupo (estudos TORO-1 e TORO-2, ITT*):
Resultados | Enfuvirtida + OB (n = 661) | OB |
HIV-1 RNA basal < 5,0 log10§ cópias/mL | 118/269 (44%) | 26/144 (18%) |
HIV-1 RNA basal > 5,0 log10§ cópias/mL | 83/392 (21%) | 14/190 (7%) |
Exposição a < 10 antirretrovirais prévios§ | 100/215 (47%) | 29/120 (24%) |
Exposição a > 10 antirretrovirais prévios§ | 101/446 (23%) | 11/214 (5%) |
0 fármaco ativo no regime antirretroviral§‡ | 9/112 (8%) | 0/53 (0%) |
1 fármaco ativo no regime antirretroviral§‡ | 56/194 (29%) | 7/95 (7%) |
2 fármacos ativos no regime antirretroviral§‡ | 130/344 (38%) | 32/183 (18%) |
CD4+ basal </= 50 células/mm3 | 46/270 (17%) | 6/122 (5%) |
CD4+ basal 51-100 células/mm3 | 20/77 (26%) | 6/47 (13%) |
CD4+ basal 101-200 células/mm3 | 57/135 (42%) | 12/88 (13%) |
CD4+ basal > 200 células/mm3 | 79/179 (44%) | 17/74 (23%) |
* ITT – Recebeu tratamento e teve, pelo menos, um acompanhamento pós-RNA basal.
§ Descontinuação e falha virológica = falha. Duas visitas consecutivas para confirmar a resposta virológica.
‡ Baseado no escore GSS.
Uso pediátrico
Existem dados limitados de eficácia de Enfuvirtida para crianças acima de três anos de idade.
O estudo T20-204 é aberto e multicêntrico, que avalia a atividade antiviral, a segurança e a farmacocinética de Enfuvirtida em 14 pacientes pediátricos com idade de 3 à 12 anos e com experiência com, pelo menos, duas classes de antirretrovirais registrados(1) .
No estudo T20-204, os pacientes receberam 30 ou 60 mg/m2/dose de Enfuvirtida, duas vezes ao dia, associados ao seu regime antirretroviral de base. Após sete dias, seus regimes de tratamento de base foram alterados para três antirretrovirais novos ou sensíveis e a dose de Enfuvirtida foi mantida. Os pacientes tinham idade mediana de oito anos (variando de 3,7 a 11,9 anos). O valor basal mediano do número de células CD4 foi 523 células/μL, e o valor basal mediano de RNA HIV-1 foi 4,4 log10 c/mL. Segundo análise da atividade antiviral, farmacocinética e segurança no dia 7, todos os pacientes, com exceção de um, mudaram para uma dose de Enfuvirtida de 60 mg/m2/dose. A alteração mediana de RNA HIV-1 em relação ao valor basal dentro de sete dias foi – 1,15 log10 cópias/mL para 10 crianças recebendo a dose de 60 mg/m2. 1, 2
Todos os pacientes, com exceção de três, completaram 48 semanas de terapia crônica. Na semana 48, 6/14 (43%) dos pacientes apresentaram declínio na RNA HIV-1 > 1 log10 e 4/14 (29%) dos pacientes estavam abaixo de 400 cópias/mL de RNA HIV-1. As alterações medianas em relação ao valor basal do número de células CD4 e RNA HIV-1 (para a população considerada tratada) foram 237 células/μL e – 1,24 log10 c/mL, respectivamente3.
Referências bibliográficas:
1Carlyon T. Paediatric Use summary of T-20 / Ro 29-9800. Research Report No. 1008730. 2002. MRN 9015.
2Roberts N. Final Study Report - Preclinical virology / Pharmacology summary for Enfuvirtide. Research Report No. 1007534. 2002. MRN 9009.
3Chen J, Hughes M. PACTG 1005: A Phase I/II Study of T-20, a Fusion Inhibitor, in HIV-1 Infected Children. Part B. Dose-escalating Chronic Dosing study. Final Statistical Report of Safety and Activity Data. Statistical and Data Management Center, Pediatric AIDS Clinical Trials Group. July 29, 2003; pp. 14- 20.
Características Farmacológicas
Farmacodinâmica
Enfuvirtida é o primeiro membro da classe terapêutica denominada inibidores de fusão. Trata-se de um peptídeo de 36 aminoácidos que se liga especificamente à cadeia de repetição heptavalente (HR1) da glicoproteína gp41 do HIV fora da célula, inibindo seu rearranjo estrutural e, dessa forma, bloqueando a entrada do vírus na célula. Enfuvirtida não requer ativação intracelular.
Atividade antiviral in vitro
A atividade antiviral in vitro de Enfuvirtida foi demonstrada em infecção aguda de linhagens celulares T linfoblastoides, monócitos, macrófagos e células mononucleares primárias do sangue periférico (PBMC) através de isolados HIV-1 laboratoriais e clínicos. Enfuvirtida demonstrou atividade seletiva anti-HIV-1 contra os dois isolados virais – o prototípico e o primário. A susceptibilidade dos isolados do vírus 130 PBMC à enfuvirtida no período basal de pacientes tratados com Enfuvirtida foi determinada em um ensaio cMAGI (estudos clínicos fase II). Enfuvirtida apresentou média geométrica de EC50 de 0,016 mcg/mL (DP = 0,057) e variação de < 0,001 a 0,480 mcg/mL contra os isolados virais. Enfuvirtida também inibiu a fusão célula–célula mediada pelo envelope HIV-1. Os estudos de combinação de Enfuvirtida com membros representativos das diversas classes antirretrovirais (inibidores de transcriptase reversa nucleosídeos, inibidores de transcriptase reversa não nucleosídeos e inibidores da protease), incluindo zidovudina, lamivudina, nelfinavir, indinavir e efavirenz, demonstraram efeitos sinérgicos aditivos e ausência de antagonismo. A relação entre a susceptibilidade in vitro do HIV-1 para Enfuvirtida e a inibição da replicação do HIV-1 em humanos não foram estabelecidas. Por causa dos diferentes alvos enzimáticos e, como se pode deduzir, pela atividade de Enfuvirtida contra as cepas HIV que apresentam resistência a outras classes de antirretrovirais, os isolados HIV resistentes à enfuvirtida permanecerão sensíveis aos inibidores de transcriptase reversa (nucleosídeos e não nucleosídeos) e aos inibidores da protease.
Resistência in vitro
Foram selecionados isolados HIV-1 com susceptibilidade reduzida a Enfuvirtida in vitro. Esses isolados virais apresentavam substituições nos aminoácidos 36-38 do ectodomínio da gp41. Essas substituições foram correlacionadas com níveis variáveis de redução da susceptibilidade a Enfuvirtida em HIV mutantes.
Resistência in vivo
O aparecimento de resistência a Enfuvirtida é influenciado pela eficácia de todo o regime do tratamento. As substituições nos aminoácidos 36-45 da gp41 foram observadas em vírus de pacientes recebendo Enfuvirtida em estudos clínicos Fase II e III. Em ordem decrescente, as substituições observadas encontravam-se nas posições 38, 43, 36, 40, 42 e 45. Não foi estabelecida a relação dessas substituições com a eficácia in vivo.
Geralmente, as substituições em aminoácidos 36-45 da gp41 durante o tratamento implicaram redução da susceptibilidade fenotípica in vitro a Enfuvirtida em isolados de vírus do paciente.
Resistência cruzada
Enfuvirtida é igualmente ativo in vitro contra os isolados laboratoriais e clínicos do tipo selvagem e contra aqueles com resistência genotípica a 0, 1, 2 ou 3 classes de antirretrovirais (inibidores de transcriptase reversa nucleosídeos, inibidores de transcriptase reversa não nucleosídeos e inibidores da protease). Esses isolados tiveram resistência genotípica identificada especificamente para: zidovudina, lamivudina, estavudina, didanosina, zalcitabina, abacavir, nevirapina, delavirdina, efavirenz, indinavir, saquinavir, nelfinavir, ritonavir e amprenavir. Todos esses foram sensíveis a Enfuvirtida . Não se espera, entretanto, que mutações que induzam resistência a Enfuvirtida apresentem resistência cruzada a outras classes de antirretrovirais.
Farmacocinética
Absorção
As propriedades farmacocinéticas da enfuvirtida foram avaliadas em adultos e em pacientes pediátricos infectados por HIV-1. Após uma dose subcutânea única de 90 mg de Enfuvirtida no abdome de 12 pacientes infectados por HIV-1, a média de Cmáx foi de 4,59 mcg/mL ± 1,5 mcg/mL, a ASC (área sob a curva) foi de 55,8 mcg/mL ± 12,1 mcg.h/mL, e a biodisponibilidade absoluta foi de 84,3% ± 15,5%, usando a dose intravenosa de 90 mg como referência. A absorção subcutânea de Enfuvirtida é proporcional à dose administrada, na faixa de 45 a 180 mg. A absorção subcutânea com a dose de 90 mg é comparável quando injetada em abdome, coxa ou braço. As concentrações plasmáticas médias em estado de equilíbrio (steady state) de enfuvirtida 90 mg em 11 pacientes estão representadas na Figura 2.
Figura 2. Concentrações plasmáticas de enfuvirtida* 90 mg, duas vezes ao dia, em estado de equilíbrio dinâmico (steady state):
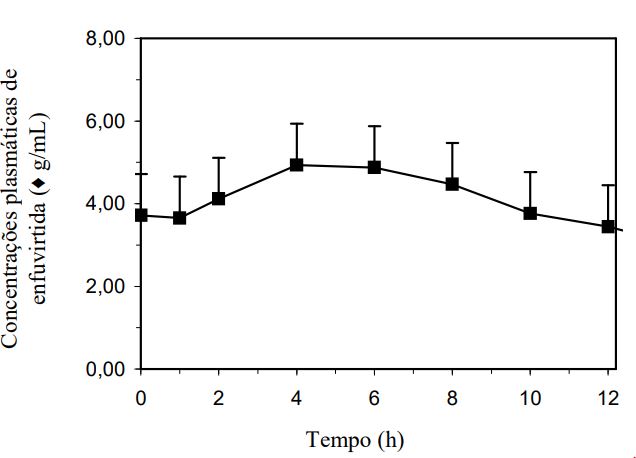
* Barra de erros = desvio padrão.
Em quatro estudos diferentes (n = 9 a 12), as concentrações plasmáticas médias de vale, em estado de equilíbrio (steady state), variaram de 2,6 a 3,4 mcg/mL.
Distribuição
A média do volume de distribuição no estado de equilíbrio (steady state), após administração de uma dose de 90 mg de Enfuvirtida (n = 12), foi de 5,5 ± 1,1 L. Enfuvirtida está 92% ligado às proteínas em plasma infectado por HIV para uma faixa de concentração de 2 a 10 mcg/mL. Enfuvirtida se liga predominantemente à albumina e, em menor extensão, à a-1-glicoproteína ácida. Enfuvirtida não foi deslocado de seus sítios de ligação pelo saquinavir, nelfinavir, lopinavir, efavirenz, nevirapina, amprenavir, itraconazol, midazolam ou varfarina. Enfuvirtida não deslocou a varfarina, midazolam, amprenavir ou efavirenz de seus sítios de ligação.
Os níveis de enfuvirtida no fluido cerebroespinal, medidos em um pequeno número de pacientes infectados por HIV, mostraram-se insignificantes. A molécula pode ser grande demais para atravessar a barreira hematoencefálica.
Metabolismo
Por tratar-se de um peptídeo, espera-se que Enfuvirtida sofra catabolismo de seus aminoácidos constituintes, com a subsequente reciclagem dos aminoácidos no estoque de aminoácidos do corpo como um todo. Estudos in vitro em microssomos humanos indicam que Enfuvirtida não é um inibidor das enzimas do citocromo P450 (CYP). Observou-se em estudos microssomais e em hepatócitos humanos realizados in vitro, que a hidrólise do grupo amido do aminoácido C-terminal fenilalanina resultou em um metabólito desamidado, e a formação desse metabólito não é NADPH dependente. Esse metabólito (M3) é detectado no plasma humano após administração de Enfuvirtida com uma ASC, variando entre 2,4 e 15% da ASC de Enfuvirtida .
Eliminação
Os estudos de balanço de massa para determinar a(s) via(s) de eliminação de enfuvirtida não foram realizados em humanos. Porém, estudos realizados em roedores usando 3H-enfuvirtida indicaram recuperação incompleta da radioatividade administrada, sete dias após a dose, em urina e fezes. Houve retenção da radioatividade nos músculos esqueléticos. Após uma dose subcutânea de 90 mg (n = 12), a média da meia-vida de eliminação de Enfuvirtida foi de 3,8 ± 0,6 horas, e a média da depuração foi de 1,7 ± 0,4 L/h.
Farmacocinética em situações clínicas especiais
Insuficiência hepática
A farmacocinética de Enfuvirtida não foi estudada em pacientes com insuficiência hepática.
Insuficiência renal
Análises dos dados de concentração plasmática dos pacientes dos estudos clínicos indicaram que a depuração de Enfuvirtida não é afetada de forma clinicamente relevante em pacientes com clearance de creatinina superior a 35 mL/min. Os resultados de um estudo de insuficiência renal indicaram que a depuração da enfuvirtida foi reduzida em, aproximadamente, 38% em pacientes com insuficiência renal grave e em, aproximadamente, 14 – 28% em pacientes com doença renal terminal em diálise comparados a pacientes com função renal normal. Os resultados estavam dentro da faixa observada em pacientes com função renal normal nos estudos principais. A hemodiálise não alterou significativamente a depuração da enfuvirtida. Portanto, não são necessários ajustes de doses para pacientes com insuficiência renal.
Sexo e peso
As análises dos dados de concentração plasmática de pacientes dos estudos clínicos indicaram que a depuração de enfuvirtida é 20% mais lenta nas mulheres que nos homens. O aumento de peso, independentemente do sexo, está relacionado à maior depuração de enfuvirtida (20% maior em paciente com peso corpóreo de 100 kg e 20% mais lento em paciente com peso corpóreo de 40 kg, em relação a um paciente de referência pesando 70 kg). Porém, essas mudanças não são clinicamente significativas e não exigem ajuste de dose.
Etnia
As análises dos dados de concentração plasmática de pacientes dos estudos clínicos indicaram que a depuração de Enfuvirtida não foi diferente em negros em relação aos brancos. Outros estudos de farmacocinética sugerem que não há diferença entre amarelos (asiáticos) e brancos (caucasianos), após o ajuste da exposição de acordo com o peso corpóreo.
Idosos
Estudos clínicos de Enfuvirtida não incluíram um número suficiente de pacientes com 65 anos de idade ou mais para determinar se eles respondem de maneira diferente dos pacientes mais jovens.
Pacientes pediátricos
A farmacocinética da enfuvirtida foi estudada em 32 pacientes com idade de três a 16 anos, com doses variando de 0,5 a 2,5 mg/kg. A dose de 2 mg/kg, duas vezes ao dia (no máximo 90 mg, duas vezes ao dia), levou a concentrações plasmáticas de enfuvirtida similares às obtidas em pacientes adultos que receberam dose de 90 mg, duas vezes ao dia.
Em 25 pacientes, variando em idade de 5 a 16 anos e recebendo dose de 2 mg/kg duas vezes ao dia, a média de ASC foi de 54,3 ± 23,5 mcg.h/mL, Cmáx foi 6,14 ± 2,48 mcg/mL e Cvale foi 2,93 ± 1,55 mcg/mL.
Segurança pré-clínica
Carcinogênese
Não foram realizados estudos de carcinogenicidade a longo prazo de Enfuvirtida em animais.
Mutagênese
Enfuvirtida não foi mutagênico nem clastogênico em uma série de ensaios in vivo e in vitro, incluindo o ensaio de mutação reversa bacteriana de Ames, um ensaio de mutação genética sobre células de mamífero em células do ovário do Hamster Chinês AS52 ou em um ensaio de micronúcleos murinos in vivo.
Comprometimento da fertilidade
Enfuvirtida não causou efeitos adversos sobre a fertilidade de ratos machos e fêmeas, com doses de enfuvirtida de 0,7; 2,5; e 8,3 vezes a dose diária máxima recomendada para humanos adultos, com base em mg/Kg, administrada através de injeção subcutânea.
Reações no local de aplicação da injeção
Em macacos cynomolgus tratados com doses de enfuvirtida de 5 e 10 mg/kg duas vezes ao dia, durante nove meses, foram observadas alterações no local de aplicação da injeção, que incluíram inchaço, edema e formação de abscesso, aparecendo, geralmente, no mês 5. Por ocasião da necropsia, foram observados com destaque manchas, espessamento e cistos nos locais de aplicação da injeção de Enfuvirtida .
Observados ao microscópio, esses achados estão correlacionados com hemorragia subcutânea, edema e infiltrado inflamatório e se encontravam com incidência e severidade significativamente maiores nos locais de aplicação da injeção de Enfuvirtida . O infiltrado inflamatório misto foi predominantemente linfocítico e formado, frequentemente, por folículos linfoides. Foi observado um componente substancial de plasmócitos, compatível com a observação de produção crônica de anticorpos antienfuvirtida e um componente eosinofílico polimorfonuclear do infiltrado, sugestivo de reação de hipersensibilidade. Em cobaias tratadas até duas semanas com Enfuvirtida (com quatro injeções/dia de 50 mg/mL ou duas injeções/dia de 100 mg/mL), foram observadas massas subcutâneas no prazo de oito dias de injeções diárias repetidas. As observações ao microscópio de biópsias por punção coletadas nos locais de aplicação da injeção nos dias 8 e 15, incluíram edema, inflamação aguda e/ou crônica, necrose, fibrose e degeneração do colágeno na derme. Foram observadas mudanças significativas da derme e do subcutâneo, incluindo a presença de células gigantes e granulomas tipo corpo estranho.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)