Qual a ação da substância do Firialta?
Resultados de Eficácia
Eficácia clínica e segurança
Doença renal crônica e diabetes tipo 2
O estudo FIDELIO-DKD foi um estudo randomizado, duplo-cego, controlado por placebo, multicêntrico de Fase III que investigou o efeito de Finerenona em comparação com o placebo nos desfechos renais e cardiovasculares em pacientes adultos com doença renal crônica e diabetes tipo 2. Os pacientes eram elegíveis com base na evidência de albuminúria persistente (> 30 mg/g a 5.000 mg/g), TFGe de 25 a 75 mL/min/ 1,73m2, potássio sérico ≤ 4,8 mmol/L na randomização e deveriam estar recebendo tratamento padrão, incluindo uma dose máxima tolerada aprovada de um inibidor da enzima de conversão da angiotensina (iECA) ou bloqueador do receptor da angiotensina (BRA). Pacientes com diagnóstico de insuficiência cardíaca com fração de ejeção reduzida e New York Heart Association II-IV foram excluídos devido à recomendação classe 1A para terapia de ARM.
O desfecho primário no estudo FIDELIO-DKD foi um composto de tempo até a primeira ocorrência de falência renal (definida como diálise crônica ou transplante renal, ou uma diminuição sustentada na TFGe para <15 mL/min/1,73m2 em pelo menos 4 semanas), um declínio sustentado na TFGe de 40% ou mais em comparação com o basal ao longo de pelo menos 4 semanas, ou morte renal. O desfecho secundário principal foi um composto de tempo até a primeira ocorrência de morte cardiovascular (CV), infarto do miocárdio (IM) não-fatal, acidente vascular cerebral não-fatal ou hospitalização por insuficiência cardíaca.
O estudo analisou 5.674 pacientes selecionados randomicamente para receber Finerenona 10 mg ou 20 mg uma vez ao dia (N = 2833), ou placebo (N = 2841), com uma duração média de acompanhamento de 2,6 anos. Após a notificação de término do estudo, o estado vital foi obtido para 99,7% dos pacientes. A população do estudo foi de 63% brancos, 25% asiáticos e 5% negros. A idade média na inclusão era de 66 anos e 70% dos pacientes eram do sexo masculino. Na linha de base a TFGe média foi de 44,3 mL/min /1,73m2, com 55% dos pacientes tendo uma TFGe <45 mL/min/1,73m2 a razão albumina/ creatinina mediana na urina (RACU) foi de 852 mg/g, e a hemoglobina glicada A1c média (HbA1c) foi de 7,7%, 46% tinham histórico de doença cardiovascular aterosclerótica, 30% tinham histórico de doença arterial coronariana, 8% tinham histórico de insuficiência cardíaca e a pressão arterial média era 138/76 mmHg. A duração média do diabetes tipo 2 na linha de base era de 16,6 anos e um histórico de retinopatia diabética e neuropatia diabética foi relatado em 47% e 26% dos pacientes, respectivamente, na linha de base. Na linha de base, quase todos os pacientes estavam com iECA (34%) ou BRA (66%), e 97% dos pacientes usavam um ou mais medicamentos antidiabéticos (insulina [64%], biguanidas [44%], agonistas do receptor peptídeo-1 semelhante ao glucagon [GLP-1] [7%], inibidores do cotransportador sódio-glicose 2 [SGLT2] [5%]). Os outros medicamentos mais frequentemente tomados na linha de base foram estatinas (74%) e bloqueadores dos canais de cálcio (63%).
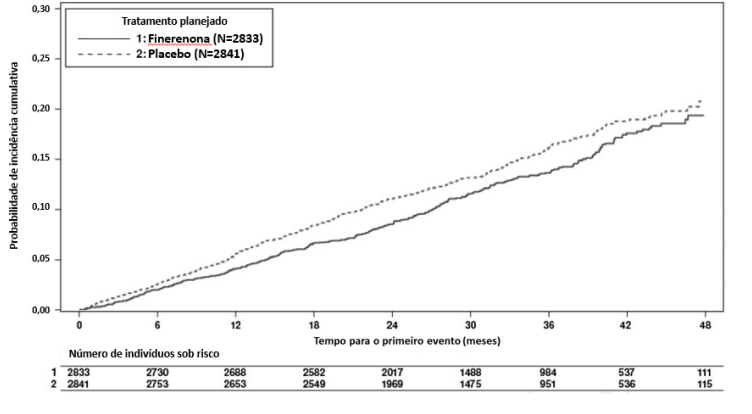
Finerenona demonstrou superioridade em relação ao placebo reduzindo significativamente o risco do desfecho composto primário em comparação com o placebo em uma análise de tempo até o evento usando o modelo de riscos proporcionais Cox e teste log-rank (HR 0,82, IC 95% 0,73-0,93, p = 0,0014). Vide Figura 1/ Tabela 1 abaixo.
Finerenona também reduziu significativamente o risco do desfecho composto secundário principal de tempo para a primeira ocorrência de morte CV, IM não-fatal, acidente vascular cerebral não-fatal ou hospitalização por insuficiência cardíaca em comparação com placebo (HR 0,86, IC 95% 0,75-0,99, p = 0,0339). Vide Figura 2. Os desfechos secundários pré-especificados de tempo até o evento estão incluídos na Tabela 1.
Para o desfecho secundário de mudança na RACU da linha de base até o mês 4, uma redução relativa de 31,2% foi observada no grupo Finerenona em comparação com o placebo. O efeito do tratamento para os desfechos primários e secundários principais foi geralmente consistente ao longo de todos os subgrupos, incluindo região, TFGe, RACU, pressão arterial sistólica (PA) e HbA1c na linha de base.
No estudo FIDELIO-DKD, eventos de diminuição da taxa de filtração glomerular foram relatados em 6,3% dos pacientes tratados com Finerenona em comparação com 4,7% dos pacientes tratados com placebo, e aqueles que levaram à descontinuação permanente em pacientes que receberam Finerenona foram 0,2% versus 0,3% no grupo placebo. Os pacientes em uso de Finerenona experienciaram uma diminuição inicial na TFGe (média 2 mL/min/1,73m2) que foi atenuada ao longo do tempo em comparação com o placebo. Esta diminuição demonstrou ser reversível após a descontinuação do tratamento. A diminuição inicial da TFGe foi associada à preservação a longo prazo da função renal.
Tabela 1: Análise dos desfechos primários e secundários de tempo até o evento (e seus componentes individuais) no Estudo de Fase III FIDELIO-DKD
| - | Indivíduos com Doença Renal Crônica e Diabetes Tipo 2 | |||||
| Finerenona* 10 ou 20 mg uma vez ao dia N=2833 | Placebo* N=2841 | Efeito do tratamento Finerenona / Placebo | ||||
| Desfechos primário e secundário de tempo para o evento: | n (%) | Taxa do evento (100 paciente s -ano) | n (%) | Taxa do evento (100 paciente s -ano) | Razão de risco (Hazard Ratio) (IC 95%) | Valor-p |
| Composto primário de falência renal, declínio sustentado da TFGe ≥40% ou morte renal | 504 (17,8%) | 7,59 | 600 (21,1%) | 9,08 | 0,82 [0,73;0,9 3] | 0,0014 |
| Falência renal | 208 (7,3%) | 2,99 | 235 (8,3%) | 3,39 | 0,87 [0,72;1,0 5] | --- |
| Declínio sustentado da TFGe ≥40% | 479 (16,9%) | 7,21 | 577 (20,3%) | 8,73 | 0,81 [0,72;0,9 2] | --- |
| Morte renal | 2 (<0,1%) | --- | 2 (<0,1%) | --- | --- | --- |
| Composto secundário de morte CV, IM não-fatal, acidente vascular cerebral não fatal ou hospitalização por insuficiência cardíaca | 367 (13,0%) | 5,11 | 420 (14,8%) | 5,92 | 0,86 [0,75;0,9 9] | 0,0339 |
| Morte CV | 128 (4,5%) | 1,69 | 150 (5,3%) | 1,99 | 0,86 [0,68;1,0 8] | --- |
| IM não-fatal | 70 (2,5%) | 0,94 | 87 (3,1%) | 1,17 | 0,80 [0,58;1,0 9] | --- |
| Acidente vascular cerebral não-fatal | 90 (3,2%) | 1,21 | 87 (3,1%) | 1,18 | 1,03 [0,76;1,3 8] | --- |
| Hospitalização por insuficiência cardíaca | 139 (4,9%) | 1,89 | 162 (5,7%) | 2,21 | 0,86 [0,68;1,0 8] | --- |
| Mortalidade por todas as causas | 219 (7,7%) | 2,90 | 244 (8,6%) | 3,23 | 0,90 [0,75; 1,07] | 0,2348** |
| Hospitalização por todas as causas | 1263 (44,6%) | 22,56 | 1321 (46,5%) | 23,87 | 0,95 [0,88; 1,02] | --- |
| Falência renal, declínio sustentado da TFGe ≥ 57% ou morte renal | 252 (8,9%) | 3,64 | 326 (11,5%) | 4,74 | 0,76 [0,65; 0,90] | --- |
* Tratamento adicional à dose máxima tolerada aprovada de iECA ou BRA.
** Não significativo.
Figura 1: Tempo para a primeira ocorrência de falência renal, declínio sustentado da TFGe ≥ 40% da linha de base ou morte renal no estudo FIDELIO-DKD
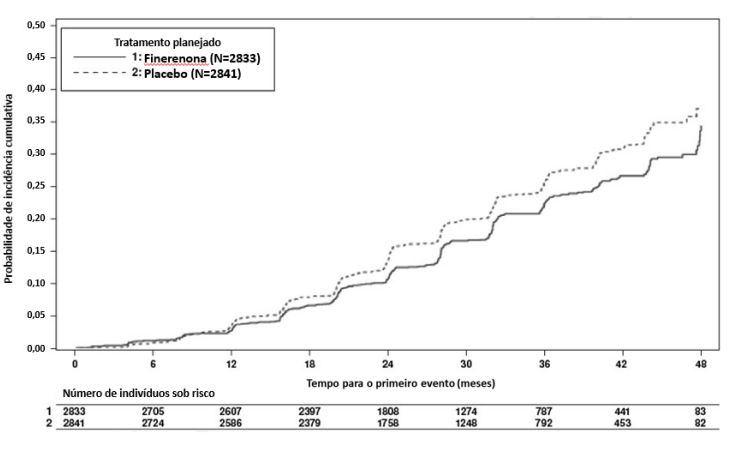
Figura 2: Tempo para a primeira ocorrência de morte CV, infarto do miocárdio nãofatal, acidente vascular cerebral não-fatal ou hospitalização por insuficiência cardíaca no estudo FIDELIO-DKD
Características Farmacológicas
Mecanismo de ação
A finerenona é um antagonista não esteroidal seletivo do receptor mineralocorticoide (RM) que atenua potentemente a inflamação e a fibrose mediadas pela superativação do RM. O RM é expresso nos rins, coração e vasos sanguíneos, onde a finerenona também neutraliza a retenção de sódio e os processos hipertróficos. A finerenona tem uma alta potência e seletividade para o RM devido à sua estrutura não esteroidal e modo de ligação volumoso.
A finerenona não tem afinidade relevante a receptores de androgênio, de progesterona, de estrogênio e de glicocorticoides e, portanto, não causa eventos adversos relacionados ao hormônio sexual (por exemplo, ginecomastia). Sua ligação ao RM leva a um complexo de ligação receptor específico que bloqueia o restabelecimento de coativadores transcricionais envolvidos na expressão de mediadores pró-inflamatórios e pró-fibróticos.
Efeitos farmacodinâmicos
No FIDELIO DKD, um estudo de fase III randomizado, duplo-cego, controlado por placebo, multicêntrico em pacientes adultos com DRC e DM2, a redução relativa, corrigida por placebo, na razão albumina/creatinina urinária (RACU) em pacientes randomizados para Finerenona foi de 31% no mês 4.
No ARTS DN, um estudo de fase IIb multicêntrico, randomizado, duplo-cego, controlado por placebo em pacientes adultos com DRC e DM2, a redução relativa corrigida por placebo na RACU no Dia 90 foi de 25% e 38% em pacientes tratados com Finerenona 10 mg e 20 mg uma vez ao dia, respectivamente.
Propriedades farmacocinéticas
Relação Farmacocinética/ Farmacodinâmica
A relação concentração-efeito ao longo do tempo para RACU foi caracterizada por um modelo de efeito máximo indicando saturação em altas exposições. O tempo previsto pelo modelo para atingir o estado estacionário completo (99%) do efeito do medicamento na RACU foi de 138 dias. A meia-vida farmacocinética (PK) foi de 2-3 horas e o estado estacionário de PK foi alcançado após 2 dias, indicando um efeito indireto e retardado nas respostas farmacodinâmicas.
Efeito dos alimentos
A ingestão de alimentos com alto teor de gordura e alto teor calórico aumentou a AUC da exposição à finerenona em 21%, reduziu o Cₘₐₓ em 19% e prolongou o tempo para atingir o Cₘₐₓ para 2,5 horas. Como isso não é considerado clinicamente relevante, a finerenona pode ser tomada com ou sem alimentos.
Absorção
A finerenona é quase completamente absorvida após administração oral. A absorção é rápida com as concentrações plasmáticas máximas (Cmáx) aparecendo entre 0,5 e 1,25 horas após a ingestão do comprimido em jejum. A biodisponibilidade absoluta da finerenona é de 43,5% devido ao metabolismo de primeira passagem na parede intestinal e no fígado. A finerenona é um substrato do transportador de efluxo P-gp in vitro, no entanto, não é considerado relevante para sua absorção in vivo devido à alta permeabilidade da finerenona.
Distribuição
O volume de distribuição no estado de equilíbrio (Vss) da finerenona é de 52,6 L. A ligação da finerenona à proteína plasmática humana in vitro é de 91,7%, sendo a albumina sérica a principal proteína de ligação.
Metabolismo/ Biotransformação
Aproximadamente 90% do metabolismo da finerenona é mediado pelo CYP3A4 e 10% pelo CYP2C8. Quatro metabólitos principais foram encontrados no plasma. Todos os metabólitos são farmacologicamente inativos.
Eliminação/ Excreção
A eliminação da finerenona do plasma é rápida, com uma meia-vida de eliminação (t1/2) de cerca de 2 a 3 horas. A excreção de finerenona inalterada representa uma via secundária (<1% da dose na urina devido à filtração glomerular, <0,2% nas fezes). Cerca de 80% da dose administrada foi excretada pela urina e aproximadamente 20% da dose foi excretada pelas fezes, quase exclusivamente na forma de metabólitos. Com uma depuração sanguínea sistêmica de cerca de 25 L/h, a finerenona pode ser classificada como um fármaco de depuração baixa.
Linearidade/ Não-linearidade
A farmacocinética da finerenona é linear ao longo do intervalo de dose investigado de 1,25 a 80 mg
Informações adicionais para populações especiais
Pacientes com insuficiência renal
A insuficiência renal leve (CLCR 60 - <90 mL/ min) não afetou a AUC e Cmáx da finerenona. Em comparação com indivíduos com função renal normal (CLCR ≥ 90 mL/ min), o efeito do comprometimento renal moderado (CLCR 30 - <60 mL / min) ou grave (CLCR <30 mL/ min) na AUC da finerenona foi semelhante com aumentos de 34-36%. A insuficiência renal moderada ou grave não teve efeito sobre a Cmáx.
Devido à elevada ligação às proteínas plasmáticas, não se prevê que a finerenona seja dialisável.
Pacientes com insuficiência hepática
Não houve alteração na exposição à finerenona em indivíduos cirróticos com insuficiência hepática leve.
Em indivíduos cirróticos com insuficiência hepática moderada , a AUC média da finerenona foi aumentada em 38% e 55%, respectivamente, enquanto não se observou alteração na Cmáx que permaneceu inalterada em comparação com indivíduos de controle saudáveis.
Não existem dados em pacientes com insuficiência hepática grave.
Pacientes geriátricos
Dos 2.827 pacientes que receberam Finerenona no estudo FIDELIO-DKD, 58% dos pacientes tinham 65 anos ou mais e 15% tinham 75 anos ou mais. Nenhuma diferença geral de segurança ou eficácia foi observada entre esses pacientes e os pacientes mais jovens.
Em um estudo de fase I (N=48) pacientes idosos (≥ 65 anos de idade) exibiram concentrações plasmáticas de finerenona mais elevadas do que os indivíduos mais jovens (≤ 45 anos de idade), com valores médios de AUC e Cmáx sendo 34% e 51% mais elevados nos idosos.
As análises farmacocinéticas populacionais não identificaram a idade como uma covariável para a AUC ou Cmáx da finerenona.
Gênero
O gênero não teve efeito sobre a farmacocinética da finerenona.
Peso corpóreo
As análises farmacocinéticas da população identificaram o peso corporal como uma covariável para a Cmáx da finerenona. A Cmáx de um indivíduo com peso corpóreo de 50 kg foi estimada em 43% a 51% maior em comparação com um indivíduo de 100 kg. A adaptação da dose com base no peso corpóreo não é garantida.
Diferenças étnicas
As análises farmacocinéticas da população em pacientes não demonstraram nenhuma diferença clinicamente relevante na exposição à finerenona entre pacientes asiáticos e caucasianos.
Tabagismo
A finerenona não é metabolizada por uma enzima que é induzida pela fumaça do tabaco.
Dados pré-clínicos de segurança
Os dados não-clínicos não revelam riscos especiais para humanos com base em estudos convencionais de farmacologia de segurança, toxicidade de dose única, toxicidade de dose repetida genotoxicidade, fototoxicidade, carcinogenicidade e fertilidade masculina e feminina.
Toxicidade de dose repetida
Em cães, um peso e tamanho reduzidos da próstata foram encontrados em uma AUC não ligada de cerca de 10 a 60 vezes a dos humanos. A dose livre de achados fornece uma margem de segurança de cerca de 2.
Toxicidade sistêmica
Nos estudos de toxicidade em animais, a finerenona causou prejuízo no equilíbrio hidroeletrolítico com uma resposta secundária nas suprarrenais, conforme esperado pelo modo de ação. Nos estudos de curto prazo em ratos, alterações secundárias adicionais foram encontradas nos rins e na bexiga urinária que não foram reproduzidas no estudo crônico. Além disso, foram encontradas alterações atróficas no trato genital feminino de ratas em estudos de curto prazo em exposições que representam uma AUC não-ligada de 19 vezes que em humanos a uma dose de 20 mg, indicando pouca relevância clínica. Em cães, uma redução no peso e tamanho da próstata foram encontrados em uma AUC nãoligada de cerca de 10 a 60 vezes que a em humanos, indicando pouca relevância clínica.
Embriotoxicidade/ Teratogenicidade
No estudo detoxicidade embriofetal em ratos, a finerenona resultou em pesos placentários reduzidos e sinais de toxicidade fetal, incluindo pesos fetais reduzidos e ossificação retardada na dose materna tóxica de 10 mg/kg/dia correspondendo a uma AUC não-ligada de 19 vezes que em humanos. Com 30 mg/kg/dia, a incidência de variações viscerais e esqueléticas aumentou (edema leve, cordão umbilical encurtado, fontanela ligeiramente aumentada) e um feto apresentou malformações complexas, incluindo uma malformação rara (arco aórtico duplo) em uma AUC não-ligada de cerca de 25 vezes que em humanos. As doses livres de quaisquer achados (dose baixa em ratos, dose alta em coelhos) forneceram margens de segurança de 10 a 13 vezes para a AUC não-ligada. Portanto, os achados em ratos não indicam um aumento da preocupação com danos fetais.
Quando os ratos foram expostos durante a gravidez e lactação no estudo de toxicidade de desenvolvimento pré e pós-natal, um aumento da mortalidade das crias e outros efeitos adversos (peso inferior das crias, desdobramento tardio do pavilhão auricular) foram observados com a AUC não-ligada em cerca de 4 vezes a esperada em humanos. Além disso, a prole mostrou atividade locomotora ligeiramente aumentada, mas nenhuma outra alteração neurocomportamental começando em cerca de 4 vezes a AUC não-ligada esperada em humanos. A dose livre de achados forneceu uma margem de segurança de cerca de 2 para AUC não-ligada. O aumento da atividade locomotora na prole pode indicar um risco potencial para o feto. Além disso, devido aos resultados em filhotes, um risco para um recém-nascido/ lactente não pode ser excluído.
Toxicidade reprodutiva
A fertilidade masculina não foi afetada por Finerenona.
A finerenona causou redução da fertilidade feminina (diminuição do número de corpos lúteos e locais de implantação), bem como sinais de toxicidade embrionária precoce (aumento da perda pós-implantação e diminuição do número de fetos viáveis) em cerca de 21 vezes a AUC não-ligada humana. Além disso, os pesos ovarianos reduzidos foram encontrados em cerca de 17 vezes a AUC não ligada humana. Nenhum efeito na fertilidade feminina e no desenvolvimento embrionário inicial foi encontrado em 10 vezes a AUC não ligada humana. Portanto, os achados em ratas fêmeas são de pouca relevância clínica.
Genotoxicidade e pontencial carcinogenico
A finerenona é não-genotóxica.
Em estudos de carcinogenicidade de 2 anos, a finerenona não mostrou um potencial carcinogênico em ratos machos e fêmeas, bem como em camundongos fêmeas. Em camundongos machos, a finerenona resultou em um aumento no adenoma de células de Leydig em doses que representam 26 vezes a AUC não-ligada em humanos. Uma dose que representa 17 vezes a AUC não-ligada em humanos não causou nenhum tumor. Com base na sensibilidade conhecida dos roedores para desenvolver esses tumores e no mecanismo baseado na farmacologia em doses supraterapêuticas, bem como nas margens de segurança adequadas, o aumento dos tumores de células de Leydig em camundongos machos não é clinicamente relevante.
Farmacologia de segurança
Nos estudos de farmacologia de segurança que avaliaram a função nervosa, respiratória e cardiovascular, o único achado foi um ligeiro encurtamento do intervalo PQ em cães em concentrações plasmáticas livres de cerca de 6 vezes a concentração terapêutica humana. Portanto, nenhuma relevância clínica é esperada.
Avaliação de risco ambiental
Consulte a seção “Como usar o Finerenona? - Instruções de uso / manuseio” para o descarte de qualquer produto não utilizado.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)