Qual a ação da substância do Fabrazyme?
Resultados de Eficácia
A eficácia de Betagalsidase foi avaliada em sete estudos clínicos (Fase I/II, Extensão de Fase I/II, Fase III Duplo-Cego, Extensão de Fase III, Fase II no Japão, Fase IV Duplo-Cego e Extensão de Fase IV), envolvendo um total de 165 pacientes únicos.
A eficácia de Betagalsidase foi avaliada em um estudo de determinação de dose em 15 pacientes analisados em cinco regimes de dose: 0,3, 1,0 ou 3,0 mg/kg a cada duas semanas e 1,0 ou 3,0 mg / kg a cada dois dias. A administração de Betagalsidase conseguiu uma rápida e acentuada redução de globotriaosilceramida (GL-3) no plasma e tecidos, observada bioquimicamente e histologicamente por microscopia óptica e eletrônica, nas doses de 0,3, 1,0 e 3,0 mg/kg. Os pacientes relataram diminuição da dor, aumento da capacidade de perspirar e melhoria da qualidade de vida. A dose de 1,0 mg/kg a cada duas semanas mostrou o perfil de segurança e eficácia mais favorável ao final deste estudo de determinação de dose. Quatorze pacientes que participaram do estudo de determinação de dose foram incluídos em um estudo aberto de extensão com Betagalsidase para receber a dose de 1,0 mg/kg a cada duas semanas.
A eficácia de Betagalsidase foi ainda avaliada em um estudo fase III, randomizado, duplo-cego e controlado por placebo, em 58 pacientes com doença de Fabry (56 homens e 2 mulheres). Os pacientes receberam a dose de 1,0 mg/kg de Betagalsidase ou placebo a cada 2 semanas durante cinco meses (20 semanas). O objetivo principal de eficácia foi a depuração das inclusões de GL-3 nas células capilares endoteliais intersticiais renais. Uma pontuação 0 (normal ou próximo do normal) de inclusão de GL-3 foi alcançada em 20 dos 29 (69%) pacientes tratados com Betagalsidase comparado a 0 (nenhum) de 29 pacientes tratados com placebo (p<0,001). Reduções similares de GL-3 foram observadas no endotélio capilar do coração e da pele.
Todos os 58 pacientes do estudo de Fase III randomizado participaram da extensão do estudo de fase III aberto de Betagalsidase na dose de 1,0 mg/kg a cada duas semanas, que continuou por mais 54 meses. Ao final de seis meses de tratamento do estudo aberto, a maioria dos pacientes obteve uma pontuação 0 de inclusão de GL-3 no endotélio capilar intersticial renal (Ver tabela a seguir). A GL-3 foi reduzida para níveis normais ou quase normais em células mesangiais, endotélio glomerular, células intersticiais e endotélio não-capilar. A deposição de GL-3 ainda ficou presente nas células do músculo liso vascular, epitélio tubular e podócitos, em níveis reduzidos de forma variável. Em 54 meses, uma pontuação zero foi atingida no endotélio capilar, células mesangiais, endotélio glomerular, endotélio não-capilar e túbulos convolutos distais (epitélio tubular) em todos os pacientes testados.
Redução das Inclusões de GL-3 a níveis normais ou quase normais (Pontuação 0) no endotélio capilar do rim, coração e pele
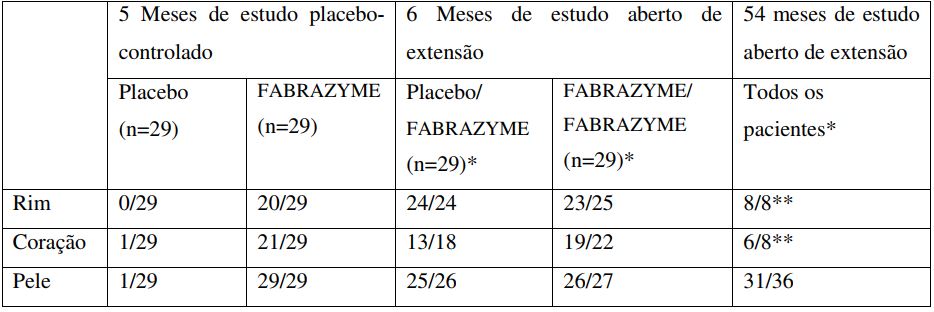
* Resultados relatados quando as biópsias eram disponíveis.
** As biópsias após os 54 meses de estudo foram opcionais.
A função renal, medida através da taxa de filtração glomerular estimada e a creatinina sérica, mantiveram-se estáveis e normais até 54 meses, na maioria dos pacientes. No entanto, o efeito do tratamento com Betagalsidase sobre a função renal foi limitado em alguns pacientes com doença renal avançada. Os níveis plasmáticos médios de GL-3 mostraram uma rápida diminuição e retorno aos níveis normais (ou seja, ≤ 7,03 µg / mL) dentro de 6 meses (ou seja, primeiro período testado) de tratamento com Betagalsidase. Importante ressaltar que os níveis plasmáticos médios de GL-3 permaneceram normais por 54 meses.
A eficácia de Betagalsidase também foi avaliada em um estudo aberto de fase II com 13 pacientes japoneses que foram tratados com 1 mg / kg de Betagalsidase a cada duas semanas por 20 semanas. Os resultados do estudo de Fase II no Japão foram semelhantes aos resultados do estudo duplo-cego de fase III.
A eficácia clínica de Betagalsidase foi avaliada em um estudo randomizado (2:1), de fase IV, duplocego e controlado por placebo, de 82 pacientes com doença de Fabry (72 homens e 10 mulheres). Os pacientes receberam 1,0 mg / kg de Betagalsidase ou placebo a cada duas semanas por até um máximo de 35 meses. O parâmetro principal de eficácia foi o tempo para a progressão clinicamente significativa da combinação de resultados renais, cardíacos e doença vascular cerebral e/ou de morte e foi avaliado por um teste log-rank comparando os grupos tratados com Betagalsidase e placebo. Entre os 82 pacientes incluídos, 13 pacientes (42%) do grupo placebo e 14 pacientes (27%) do grupo Betagalsidase satisfizeram o ponto final clínico pré-definido (progressão dos sintomas clínicos).
Para corrigir um desequilíbrio na proteinúria basal entre os grupos Betagalsidase e placebo, um modelo de riscos proporcionais de Cox foi utilizado, com o grupo de tratamento e a proteinúria basal como covariável no modelo. Esta análise demonstrou uma redução do risco de 53% para a população com intenção de tratar (ITT) (Risco relativo 0,47, IC 95% 0,21, 1,03, p = 0,0577) (ver a Figura 1). Na população por protocolo (PP) (n = 74), Betagalsidase demonstrou uma redução de risco de 61% (Risco relativo 0,39; IC 95% 0,16, 0,93, p = 0,0341).
Figura 1: Proporção de Proteinúria - Probabilidade Prevista Ajustada de um Ponto Final Principal: População com intenção de tratar
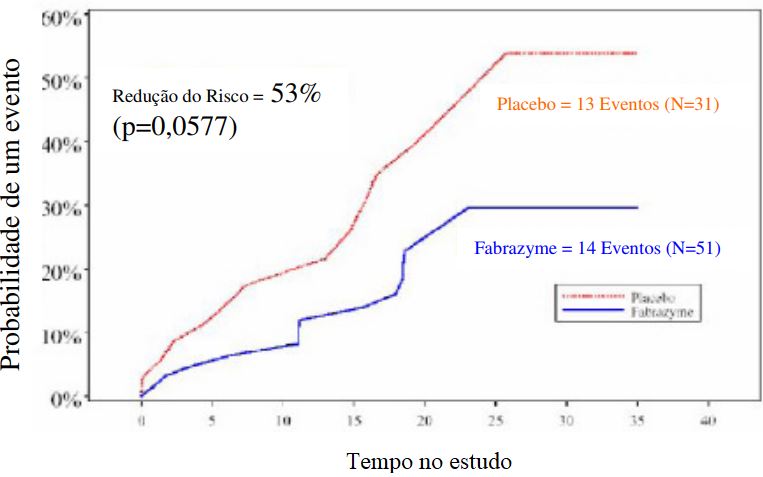
Os resultados deste estudo demonstram que a terapia com Betagalsidase administrada na dose de 1mg/kg diminui a taxa de progressão clínica da doença de Fabry, conforme evidenciado pelos resultados renais, cardíacos e cerebrovasculares. Um total de 67 pacientes que participaram do estudo duplo-cego de Fase IV foram incluídos em uma extensão de estudo aberto de Betagalsidase, para receber 1,0 mg/kg a cada duas semanas por mais 18 meses. Embora tenha sido demonstrado benefício em pacientes com diferentes gravidades da doença, o benefício mais pronunciado foi observado entre os pacientes que apresentam doença renal menos grave no início do estudo.
Características farmacológicas
Propriedades Farmacodinâmicas
A doença de Fabry é caracterizada pela deficiência da α-galactosidase A, uma hidrolase lisossômica que catalisa a hidrólise dos glicoesfingolipídeos, especialmente do globotriaosilceramida (GL-3), em galactose terminal e ceramida di-hexosídeo. A atividade reduzida ou ausente da α-galactosidase resulta no acúmulo de GL-3 em muitos tipos de células, incluindo as células endoteliais e parenquimais. A base racional para a terapêutica de reposição enzimática é restabelecer um nível de atividade enzimática suficiente para hidrolisar o substrato acumulado. Após a infusão intravenosa, Betagalsidase é rapidamente removido da circulação e captado pelo endotélio vascular e pelas células parenquimais para o interior dos lisossomos, provavelmente através dos receptores da manose- 6-fosfato, da manose e da asialoglicoproteína.
Propriedades farmacocinéticas
Os perfis plasmáticos de Betagalsidase foram estudados nas doses de 0,3, 1,0 e 3,0 mg/kg em 15 pacientes adultos com doença de Fabry. A área sob a curva (AUC) de tempo versus concentração plasmática e a depuração (clearance) não aumentaram proporcionalmente com o aumento das doses, demonstrando que a enzima segue um padrão farmacocinético não-linear. A meia-vida terminal foi independente da dose e variou entre 45 e 102 minutos.
A farmacocinética de Betagalsidase foi avaliada em 11 pacientes adultos com doença de Fabry na Europa. Após uma infusão intravenosa de 1 mg/kg de Betagalsidase por um período médio de 280 a 300 minutos, as médias das concentrações plasmáticas máximas (Cmax) variaram de 2,09 a 3,49 µg/mL. A AUC média variou de 372 a 784 µg/mL•min. O volume médio de distribuição (Vz) foi de 0,23 a 0,49 L/kg e o volume médio de distribuição no estado de equilíbrio (steady state - Vss) variou 6 de 0,12 a 0,57 L/kg. A depuração plasmática média variou de 1,75 a 4,87 mL/min/kg e a meia-vida de eliminação média (t ½) variou de 82,3 a 119 minutos.
A farmacocinética de Betagalsidase também foi avaliada em 13 pacientes com a doença de Fabry no Japão. Os resultados desta avaliação mostraram que a farmacocinética de Betagalsidase é comparável em pacientes caucasianos e japoneses com doença de Fabry.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)