Qual a ação da substância do Erbitux?
Resultados de Eficácia
Câncer colorretal
Um ensaio diagnóstico (EGFR pharmDx™) foi utilizado para a detecção imunohistoquímica da expressão de EGFR em material tumoral. Aproximadamente 75% dos pacientes com carcinoma colorretal metastático selecionados para os estudos clínicos possuíam tumor com expressão de EGFR e, portanto, foram considerados elegíveis ao tratamento com cetuximabe.
Dados de estudos demonstram que pacientes portadores de câncer colorretal com RAS não-mutado têm uma chance significativamente maior de se beneficiarem do tratamento com cetuximabe ou da combinação de cetuximabe com quimioterapia.
O cetuximabe foi investigado como agente isolado ou em combinação com agentes antineoplásicos em 6 estudos clínicos controlados randomizados e em diversos estudos complementares. Cinco estudos randomizados investigaram um total de 3.734 pacientes com câncer colorretal metastático, nos quais a expressão de EGFR era detectável e que apresentavam status de desempenho ECOG ≤ 2. A maior parte dos pacientes incluídos possuía status de desempenho ECOG ≤ 1. O sexto estudo investigou 665 pacientes com mutações BRAF V600E. Em todos os estudos, o cetuximabe foi administrado conforme descrito na seção “Como usar o Cetuximabe?”.
O status do gene KRAS foi reconhecido como um fator preditivo para o tratamento com cetuximabe em 4 dos estudos controlados randomizados. O status de mutação do KRAS foi avaliado em 2.072 pacientes. Foram realizadas análises adicionais para o estudo EMR 62 202- 047, nas quais também foram determinadas mutações nos genes RAS (NRAS e KRAS), além da mutação KRAS no exon 2. Somente no estudo EMR 62 202-007, não foi possível uma análise.
FIRE-3, um estudo clínico fase III patrocinado pelo investigador, comparou o tratamento de FOLFIRI em combinação com cetuximabe ou bevacizumabe no tratamento de primeira linha de pacientes com CCRm KRAS selvagem no exon 2. Outras análises post-hoc sobre mutações em outros genes RAS além do exon 2 de KRAS foram avaliadas.
O cetuximabe em combinação com quimioterapia
EMR 62 202-013
Este estudo randomizado em pacientes com câncer colorretal metastático que não receberam tratamento prévio para doença metastática comparou a combinação de cetuximabe e irinotecano mais 5-fluorouracil/ácido folínico (FOLFIRI) infusional (599 pacientes) versus mesma quimioterapia isolada (599 pacientes). A proporção de pacientes com tumores KRAS não-mutados compreendeu 63% da população de pacientes avaliável para o status do KRAS. Para a avaliação do status de RAS foram determinadas outras mutações, além das mutações no exon 2, do gene KRAS, em todas as amostras de tumores avaliáveis na população com KRAS não mutado. A população com RAS mutado consiste de pacientes com mutações conhecidas de KRAS, assim como outras mutações de RAS identificadas.
Os dados de eficácia gerados neste estudo estão resumidos na tabela abaixo:
| --- | População RAS não-mutado | População RAS mutado | ||
| Variável/estatística | Cetuximabe + FOLFIRI | FOLFIRI | Cetuximabe + FOLFIRI | FOLFIRI |
| (N=178) | (N=189) | (N=246) | (N=214) | |
| OS | ||||
| Meses, mediana (IC95%) | 28,4 (24,7; 31,6) | 20,2 (17,0; 24,5) | 16,4 (14,9; 18,4) | 17,7 (15,4; 19,6) |
| Hazard Ratio (IC95%) | 0,691 (0,543; 0,879) | 1,049 (0,860; 1,281) | ||
| Valor p | 0,0024 | 0,6355 | ||
| PFS | ||||
| Meses, mediana (IC95%) | 11,4 (10,0; 14,6) | 8,4 (7,4; 9,4) | 7,4 (6,4; 8,0) | 7,5 (7,2; 8,5) |
| Hazard Ratio (IC95%) | 0,556 (0,406; 0,761) | 1,098 (0,852; 1,415) | ||
| Valor p | 0,0002 | 0,4696 | ||
| ORR | ||||
| % (IC95%) | 66,3 (58,8; 73,2) | 38,6 (31,7; 46,0) | 31,7 (25,9; 37,9) | 36,0 (29,6; 42,8) |
| Odds ratio (IC95%) | 3,1145 (2,0279; 4,7835) | 0,8478 (0,5767; 1,2462) | ||
| Valor p | < 0,0001 | 0,3970 | ||
IC = intervalo de confiança, FOLFIRI = irinotecano + 5-fluorouracila/ácido folínico infusional, ORR = taxa de resposta objetiva (pacientes com resposta completa ou parcial), OS = sobrevida global, PFS = tempo de sobrevida sem progressão.
Na população geral com RAS não mutado, a adição de cetuximabe a irinotecano + 5- fluorouracil/ácido folínico infusional (FOLFIRI) melhorou significativamente o tempo de sobrevida global, sobrevida livre de progressão e taxa de resposta objetiva.
EMR 62 202-047
Este estudo randomizado em pacientes com câncer colorretal metastático que não receberam tratamento prévio para doença metastática comparou a combinação de cetuximabe e oxaliplatina + infusão contínua de 5-fluorouracil/ácido folínico (FOLFOX4) (169 pacientes) versus a mesma quimioterapia isolada (168 pacientes). A proporção de pacientes com tumores KRAS não-mutados compreendeu 57% da população de pacientes avaliável para o status do KRAS. Para a avaliação do status de RAS foram determinadas outras mutações, além das mutações no exon 2, do gene KRAS, em todas as amostras de tumores avaliáveis na população com KRAS não mutado. A população com RAS mutado consiste de pacientes com mutações conhecidas de KRAS, assim como outras mutações de RAS identificadas.
Os dados de eficácia gerados neste estudo estão resumidos na tabela abaixo:
| --- | População RAS não-mutado | População RAS mutado | ||
| Variável/estatística | Cetuximabe + FOLFOX | FOLFOX4 | Cetuximabe + FOLFOX | FOLFOX |
| (N=38) | (N=49) | (N=92) | (N= 75) | |
| OS | ||||
| Meses, mediana (IC95%) | 19,8 (16,6; 25,4) | 17,8 (13,8; 23,9) | 13,5 (12,1; 17,7) | 17,8 (15,9; 23,6) |
| Hazard Ratio (IC95%) | 0,937 (0,563; 1,558) | 1,291 (0,905; 1,842) | ||
| Valor p | 0,8002 | 0,1573 | ||
| PFS | ||||
| Meses, mediana (IC95%) | 12,0 (5,8; NE) | 5,8 (4,7; 7,9) | 5,6 (4,4; 7,5) | 7,8 (6,7; 9,3) |
| Hazard Ratio (IC95%) | 0,533 (0,272; 1,042) | 1,541 (1,037; 2,289) | ||
| Valor p | 0,0615 | 0,0309 | ||
| ORR | ||||
| % (IC95%) | 57,9 (40,8; 73,7) | 28,6 (16,6; 43,3) | 37,0 (27,1; 47,7) | 50,7 (38,9; 62,4) |
| Odds ratio (IC95%) | 3,302 (1,375; 8,172) | 0,508 (0,311; 1,080) | ||
| Valor p | 0,0084 | 0,0865 | ||
IC =intervalo de confiança, FOLFOX4 = oxaliplatina + 5-fluorouracila/ácido folínico em infusão contínua, ORR = taxa de resposta objetiva (pacientes com resposta completa ou parcial), OS = sobrevida global, PFS = tempo de sobrevida livre de progressão. NE = não estimável.
FIRE-3
Combinação em primeira linha de cetuximabe com FOLFIRI. O estudo FIRE-3 é um estudo fase III multicêntrico randomizado head-to-head com 5-fluorouracil, ácido folínico e irinotecano (FOLFIRI) combinado com cetuximabe ou bevacizumabe em pacientes com câncer colorretal metastático (CCRm) KRAS exon-2 não mutado. Foi realizada análise retrospectiva de subgrupo de 592 pacientes com CCRm KRAS exon-2 não mutado. Nesta análise, amostras de tumores de 407 pacientes com status KRAS exon-2 não mutado (códons 12/13) puderam ser testadas por pirosequenciamento para mutações adicionais RAS em KRAS exon-3 (códons 59/61) e exon-4 (códons 117/146) e NRAS exon2 (códons 12/13), exon-3 (códons 59/61) e exon-4 (códons 117/146), de forma a avaliar o efeito sobre a taxa de resposta objetiva (ORR), o tempo de sobrevida livre de progressão (PFS) e a sobrevida global (OS) em ambos os braços de tratamento.
Os 342 pacientes dentro do subgrupo com RAS não-mutado apresentou ORR maior com cetuximabe + FOLFIRI em relação aos pacientes que receberam bevacizumabe + FOLFIRI. A OS foi prolongada no braço cetuximabe no subgrupo RAS não-mutado. A PFS mostrou ligeiramente também mais benefícios nos indivíduos com RAS não-mutado sob tratatamento com cetuximabe+FOLFIRI.
Nenhum benefício foi observado sobre todos os endpoints de eficácia nos indivíduos com tumores RAS mutados no braço cetuximabe+FOLFIRI. Estes dados sugerem ser improvável que indivíduos com mutações NRAS/KRAS além de KRAS exon-2 se beneficiem a partir de tratamento anti-EGFR.
Os dados de eficácia deste estudo são resumidos na tabela abaixo:
| Variável/estatística | População RAS não-mutado | População RAS mutado | ||
| Cetuximabe + FOLFIRI | Bevacizumabe + FOLFIRI | Cetuximabe + FOLFIRI | Bevacizumabe + FOLFIRI | |
| (N=171) | (N=171) | (N=92) | (N=86) | |
| OS | ||||
| Meses, mediana (IC95%) | 33,1 (24,5; 39,4) | 25,6 (22,7; 28,6) | 20,3 (16,4; 23,4) | 20,6 (17,0; 26,7) |
| Hazard Ratio (IC95%) | 0,70 (0,53; 0,92) | 1,09 (0,78; 1,52) | ||
| Valor p | 0,011 | 0,60 | ||
| PFS | ||||
| Meses, mediana (IC95%) | 10,4 (9,5; 12,2) | 10,2 (9,3; 11,5) | 7,5 (6,1; 9,0) | 10,1 (8,9; 12,2) |
| Hazard Ratio (IC95%) | 0,93 (0,74; 1,17) | 1,31 (0,98; 1,78) | ||
| Valor p | 0,54 | 0,085 | ||
| ORR | ||||
| % (IC95%) | 65,5 (57,9; 72,6) | 59,6 (51,9; 67,1) | 38,0 (28,1; 48,8) | 51,2 (40,1; 62,1) |
| Odds Ratio (IC95%) | 1,28 (0,83; 1,99) | 0,59 (0,32; 1,06) | ||
| Valor p | 0,32 | 0,097 | ||
IC = intervalo de confiança, FOLFIRI = irinotecano + 5-fluorouracila/ácido folínico infusional, ORR = taxa de resposta objetiva (pacientes com resposta completa ou parcial), OS = sobrevida global, PFS = tempo de sobrevida livre de progressão.
CA225006
Este estudo randomizado em pacientes com câncer colorretal metastático que receberam tratamento inicial associado com oxaliplatina + fluoropirimidina para doença metastática comparou a combinação de cetuximabe e irinotecano (648 pacientes) com irinotecano como agente isolado (650 pacientes). A proporção de pacientes com tumores KRAS não-mutados compreendeu 64% da população de pacientes avaliável para o status do KRAS.
Não pôde ser demonstrada diferença significativa no tempo total de sobrevida neste estudo. Seguindo a progressão da doença, o tratamento com agentes anti-EGFR foi iniciado em 50% dos pacientes do braço irinotecano-isolado, o que impactou principalmente em resultados de sobrevida. A taxa de resposta objetiva e o tempo de sobrevida livre de progressão melhoraram significativamente com cetuximabe. Entretanto, como não foi conduzida uma revisão independente dos dados de imagem, estes resultados devem ser interpretados com cautela.
EMR 62 202-007
Este estudo randomizado em pacientes com câncer colorretal metastático após falha no tratamento baseado em irinotecano para doença metastática como último tratamento antes do início do estudo comparou a combinação de cetuximabe + irinotecano (218 pacientes) versus a monoterapia com cetuximabe (111 pacientes). A combinação de cetuximabe com irinotecano comparada ao cetuximabe isolado reduziu o risco total de progressão da doença em 46% e aumentou significativamente a taxa de resposta. No estudo randomizado, o aumento do tempo total de sobrevida não foi estatisticamente significativo; entretanto, no tratamento de acompanhamento, aproximadamente 50% dos pacientes do tratamento do braço cetuximabe-isolado receberam uma combinação de cetuximabe + irinotecano após a progressão da doença, que pode ter influenciado o tempo total de sobrevida.
O Cetuximabe como agente isolado
CA225025
Este estudo randomizado em pacientes com câncer colorretal metastático que receberam tratamento prévio baseado em oxaliplatina, irinotecano e fluoropirimidina para doença metastática comparou a adição de cetuximabe como agente isolado em combinação ao melhor tratamento de suporte (best supportive care - BSC) (287 pacientes) versus o melhor tratamento de suporte (285 pacientes). A proporção de pacientes com tumores KRAS não-mutado compreendeu 58% da população de pacientes avaliável para o status do KRAS.
Os dados de eficácia deste estudo são resumidos na tabela abaixo:
| Variável/estatística | População KRAS não-mutado | População KRAS mutado | ||
| Cetuximabe + BSC | BSC | Cetuximabe + BSC | BSC | |
| (N=117) | (N=113) | (N=81) | (N=83) | |
| OS | ||||
| Meses, mediana (IC95%) | 9,5 (7,7; 10,3) | 4,8 (4,2; 5,5) | 4,5 (3,8; 5,6) | 4,6 (3,6; 5,5) |
| Hazard Ratio (IC95%) | 0,552 (0,408; 0,748) | 0,990 (0,705; 1,389) | ||
| Valor p | < 0,0001 | 0,9522 | ||
| PFS | ||||
| Meses, mediana (IC95%) | 3,7 (3,1; 5,1) | 1,9 (1,8; 2,0) | 1,8 (1,7; 1,8) | 1,8 (1,7; 1,8) |
| Hazard Ratio (IC95%) | 0,401 (0,299; 0,536) | 1,002 (0,732; 1,371) | ||
| Valor p | < 0,0001 | 0,9895 | ||
| ORR | ||||
| % (IC95%) | 12,8 (7,4; 20,3) | 0 (-) | 1,2 (0,0; 6,7) | 0 (-) |
| Valor p | < 0,001 | 0,314 | ||
BSC = melhor terapia de suporte, IC = intervalo de confiança, ORR = taxa de resposta objetiva (pacientes com resposta completa ou parcial), OS = sobrevida global, PFS = tempo de sobrevida livre de progressão.
O cetuximabe em combinação com encorafenibe
Cetuximabe, em combinação com encorafenibe, foi avaliado em um estudo multicêntrico randomizado, controlado por comparador ativo, aberto (ARRAY 818-302 BEACON CCR). Os pacientes elegíveis apresentavam obrigatoriamente câncer colorretal metastático com mutação BRAF V600E que tivesse progredido após 1 ou 2 regimes anteriores. Os pacientes admitidos eram elegíveis para receber cetuximabe de acordo com a indicação aprovada localmente em relação ao status RAS do tumor.
Foi vetado o uso prévio de inibidores de RAF, inibidores de MEK ou inibidores de EGFR. A randomização foi estratificada pelo status de desempenho do Eastern Cooperative Oncology Group (ECOG), uso anterior de irinotecano e cetuximabe.
Um total de 665 pacientes foram randomizados (1:1:1) para receber cetuximabe em combinação com encorafenibe 300 mg por via oral diariamente (n = 220), ou cetuximabe em combinação com encorafenibe 300 mg por via oral diariamente e binimetinibe 45 mg por via oral duas vezes ao dia (n = 224) ou controle (cetuximabe com irinotecano ou cetuximabe com irinotecano/5- fluorouracil/ácido folínico (FOLFIRI), n = 221). O tratamento foi mantido até a progressão da doença ou toxicidade inaceitável.
Os objetivos primários de eficácia foram a sobrevida global (OS) e a taxa de resposta global (ORR), avaliadas por um comitê de revisão central independente e cego (BIRC), comparando cetuximabe em combinação com encorafenibe 300 mg versus controle. Outras medidas de eficácia estão resumidas na tabela abaixo.
A idade mediana dos pacientes foi de 61 anos (intervalo: 26 a 91), 47% eram do sexo masculino e 83% eram brancos. 51% dos pacientes apresentavam status de desempenho ECOG basal de 0 e 51% receberam irinotecano anteriormente. 46,8% dos pacientes tinham pelo menos 3 órgãos com comprometimento tumoral na linha de base.
A duração mediana da exposição foi de 3,2 meses em pacientes tratados com cetuximabe em combinação com encorafenibe 300 mg, e 1,4 meses em pacientes tratados com cetuximabe/irinotecano ou cetuximabe/FOLFIRI (braço controle). Em pacientes tratados com a combinação cetuximabe e encorafenibe 300 mg, a intensidade da dose relativa mediana (IDR) foi de 98% para encorafenibe e 93,5% para cetuximabe. No braço controle, a IDR mediana foi de 85,4% para cetuximabe, 75,7% para irinotecano e no grupo de pacientes que receberam ácido folínico e 5-FU, a IDR mediana foi de 75,2% e 75%, respectivamente.
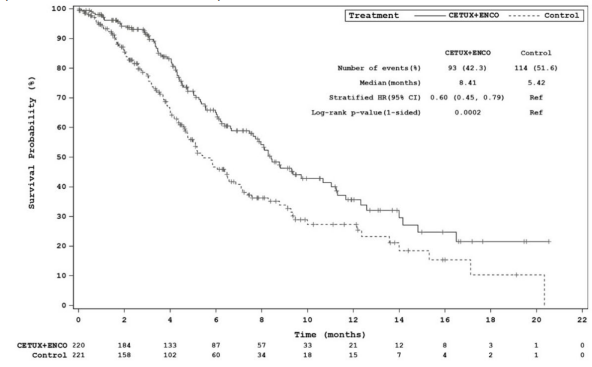
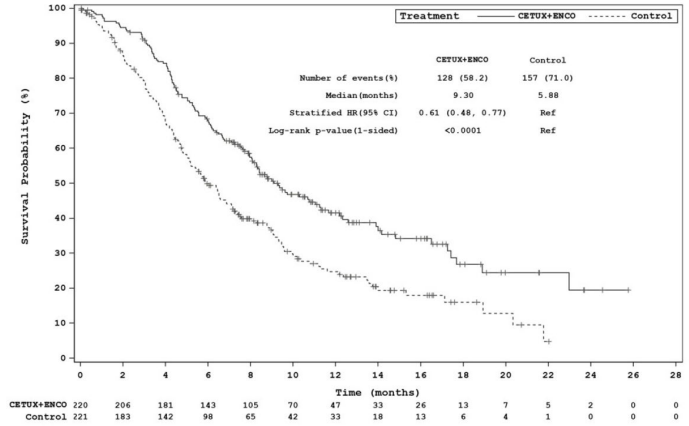
Cetuximabe, em combinação com encorafenibe 300 mg, demonstrou uma melhora estatisticamente significativa na OS, ORR e PFS em comparação com o controle. Os resultados de eficácia estão resumidos na tabela e figuras abaixo.
Estudo ARRAY-818-302 BEACON CCR: Dados de eficácia:
| --- | Cetuximabe com encorafenibe | Cetuximabe com irinotecano ou cetuximabe com FOLFIRI (Controle) |
| Data do cut-off: 11 fevereiro 2019 (Análise primária) | ||
| OS | ||
| Número de pacientesa | 220 | 221 |
| Número de eventos (%) | 93 (42,3) | 114 (51,6) |
| Mediana, meses (IC 95%) | 8,4 (7,5-11,0) | 5,4 (4,8; 6,6) |
| Hazard Ratio (IC 95%)b,c (vs controle) | 0,60 (0,41-0,88) | --- |
| Valor pb,c | 0,0002 | --- |
| Duração mediana de acompanhamento, meses (IC 95%) | 7,6 (6,4; 9,20) | 7,2 (6,1; 8,1) |
| ORR (pelo BIRC) | ||
| Número de pacientese | 113 | 107 |
| ORR n (%) (IC 95%)f | 23 (20,4) (13,4; 29.0) | 2 (1,9) (0,2; 6,6) |
| Valor pb,d,g | <0.0001 | --- |
| CR, n (%) | 6 (5,3) | 0 |
| PR, n (%) | 17 (15,0) | 2 (1,9) |
| SD, n (%) | 57 (50,4) | 26 (24,3) |
| DCR, n (%) (IC 95%)f | 84 (74.3) (65.3, 82.1) | 33 (30.8) (22.3, 40.5) |
| PFS (pelo BIRC) | ||
| Número de pacientesa | 220 | 221 |
| Número de eventos (%) | 133 (60,5) | 128 (57,9) |
| PFS mediana, meses (IC 95%) | 4,2 (37; 5,4) | 1,5 (1,5; 1,7) |
| HR (IC 95%)b,c | 0,40 (0,30; 0,55 | --- |
| Valor pb,d | < 0.0001 | --- |
| Análise atualizada, cut-off: 15 agosto 2019 | ||
| OS | ||
| Número de pacientesa | 220 | 221 |
| Número de eventos (%) | 128 (58,2) | 157 (71,0) |
| Mediana, meses (IC 95%) | 9,3 (8,0; 11,3) | 5,9 (5,1; 7.1) |
| HR (IC 95%)b (vs controle) | 0,61 (0,48; 0,77) | --- |
| Valor pb,d,h | < 0.0001 | --- |
| Duração média de acompanhamento, meses (IC 95%) | 12.3 (11,1; 14,1) | 12.9 (10,9; 14,6) |
| ORR (pelo BIRC) | ||
| Número de pacientesa | 220 | 221 |
| ORR n (%) (IC 95%)f | 43 (19,5) (14,5; 25,4) | 4 (1,8) (0,5; 4,6) |
| Valor pb,d,g,h | <0.0001 | --- |
| CR, n (%) | 7 (3,2) | 0 |
| PR, n (%) | 36 (16,4) | 4 (1,8) |
| SD, n (%) | 117 (53,2) | 59 (26,7) |
| DCR, n (%) (95% CI)f | 167 (75,9) (69,7; 81,4) | 69 (31,2) (25,2; 37,8) |
| PFS (pelo BIRC) | ||
| Número de pacientesa | 220 | 221 |
| Número de eventos (%) | 167 (75,9) | 147 (66,5) |
| PFS mediana, meses (IC 95%) | 4,3 (4,1; 5,5) | 1,5 (1,5; 1,9) |
| HR (IC 95%)b Valor pb,d, h | 0,44 (0,35; 0,55) < 0.0001 | --- |
IC = intervalo de confiança; CR = resposta completa; HR = Hazard ratio; ORR = taxa de resposta objetiva; OS = sobrevida global; PR = resposta parcial; SD = doença estável, DCR: taxa de controle da doença (CR+PR+SD+Não-CR/Não-PD; Não-CR/Não-PD aplicável somente a pacientes com uma doença não mensurável que não alcançaram CR ou tiveram PD);
a Fase randomizada 3, Conjunto completo de análise.
b Estratificado por ECOG PS, fonte de cetuximabe, e uso anterior de irinotecano na randomização.
c Intervalo de confiança repetido derivado usando limites Lan DeMets O’Brien-Fleming associados à fração de informação observada na análise interina.
d Unilateral.
e Entre os primeiros 331 pacientes randomizados.
f Método de Clopper-Pearson.
g Teste Cochran Mantel-Haenszel
h Valor p nominal.
Estudo ARRAY-818-302 BEACON CCR: gráfico de Kaplan-Meier de sobrevida global (cut-off: 11 de fevereiro de 2019):
Estudo ARRAY-818-302 BEACON CCR: gráfico de Kaplan-Meier de sobrevida global (cut-off: 15 de agosto de 2019):
Carcinoma de células escamosas de cabeça e pescoço
Não se efetuou a detecção imunohistoquímica da expressão do EGFR, já que mais de 90% dos pacientes com carcinoma de células escamosas de cabeça e pescoço têm tumores que expressam o EGFR.
O cetuximabe em combinação com radioterapia para doença localmente avançada
EMR 62 202-006
Este estudo randomizado comparou a combinação de cetuximabe + radioterapia (211 pacientes) com radioterapia isoladamente (213 pacientes) em pacientes com carcinoma de células escamosas de cabeça e pescoço localmente avançado. O cetuximabe foi iniciado uma semana antes da radioterapia e administrado até ao fim do período de radioterapia.
Os dados de eficácia gerados por este estudo estão resumidos na tabela abaixo:
| Variável / estatística | Radioterapia + cetuximabe | Radioterapia isolada | ||
| --- | (N=211) | (N=213) | ||
| Controle locorregional | ||||
| Meses, mediana (IC95%) | 24,4 | (15,7; 45,1) | 14,9 | (11,8; 19,9) |
| Hazard Ratio (IC95%) | 0,68 (0,52; 0,89) | |||
| Valor p | 0,005 | |||
| OS | ||||
| Meses, mediana (IC95%) | 49,0 | (32,8; 62,6+) | 29,3 | (20,6; 42,8) |
| Hazard Ratio (IC95%) | 0,74 (0,56; 0,97) | |||
| Valor p | 0,032 | |||
IC = intervalo de confiança; OS = sobrevida global; um ‘+’ denota que o limite superior não foi atingido no ponto de cut-off.
Pacientes com bom prognóstico, como indicado pelo estágio do tumor, pelo nível de desempenho de Karnofsky (KPS) e pela idade, tiveram um benefício mais pronunciado quando cetuximabe foi associado à radioterapia. Não pôde ser demonstrado nenhum benefício clínico em pacientes com KPS ≤ 80 e idade ≥ 65.
O uso de cetuximabe em combinação à quimioradioterapia ainda não foi adequadamente investigado. Deste modo, o balanço risco/benefício não foi determinado.
O cetuximabe em combinação com quimioterapia baseada em platina em doença recorrente e/ou metastática
EMR 62 202 002
Este estudo randomizado em pacientes com câncer de células escamosas de cabeça e pescoço que não receberam tratamento anterior com quimioterapia comparou a combinação de cetuximabe e cisplatina ou carboplatina + 5-fluorouracil infusional (222 pacientes) à mesma terapia isolada (220 pacientes). O braço tratado com cetuximabe consistiu de até 6 ciclos de quimioterapia baseada em platina + cetuximabe, seguido de cetuximabe como terapia de manutenção, até a progressão da doença.
Os dados de eficácia gerados neste estudo estão resumidos na tabela apresentada abaixo:
| Variável / estatística | Cetuximabe + CTX (N=222) | CTX (N=220) |
| OS | ||
| Meses, mediana (IC 95%) | 10,1 (8,6; 11,2) | 7,4 (6,4; 8,3) |
| Hazard Ratio (IC 95%) | 0,797 (0,644; 0,986) | |
| Valor p | 0,0362 | |
| PFS | ||
| Meses, mediana (IC 95%) | 5,6 (5,0; 6,0) | 3,3 (2,9; 4,3) |
| Hazard Ratio (IC 95%) | 0,538 (0,431; 0,672) | |
| Valor p | <0,0001 | |
| ORR | ||
| % (IC 95%) | 35,6 (29,3; 42,3) | 19,5 (14,5; 25,4) |
| Valor p | 0,0001 | |
IC = intervalo de confiança, CTX = quimioterapia baseada em platina, ORR = taxa de resposta objetiva, OS = sobrevida global, PFS = tempo de sobrevida livre de progressão.
Pacientes com bom prognóstico, de acordo com o indicado pelo estágio do tumor, KPS (Karnofsky performance status) e idade, tiveram um benefício mais pronunciado quando cetuximabe foi adicionado à quimioterapia baseada em platina. Em contraste ao tempo de sobrevida livre de progressão, não pôde ser demonstrado benefício no tempo de sobrevida global em pacientes com KPS ≤ 80 e idade ≥ 65.
Imunogenicidade
O desenvolvimento de anticorpos humanos antiquiméricos (HACA) é um efeito classe-específico dos anticorpos monoclonais quiméricos. Valores mensuráveis de HACA foram desenvolvidos em 3,4% dos pacientes estudados. Até hoje, não existem dados conclusivos sobre o efeito neutralizante sobre o cetuximabe. O aparecimento de HACA não está relacionado à ocorrência de reações de hipersensibilidade ou qualquer outro efeito indesejável relacionado ao cetuximabe.
Referências Bibliográficas:
Bokemeyer C, Bondarenko I, Makhson A, Hartmann JT, Aparicio J, de Braud F, et al. Fluorouracil, leucovorin, and oxaliplatin with and without cetuximab in the first-line treatment of metastatic colorectal cancer. J Clin Oncol. 2009;27(5):663-71.
Cunningham D, Humblet Y, Siena S, Khayat D, Bleiberg H, Santoro A, et al. Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N Engl J Med. 2004; 351:337–345.
Heinemann V, von Weikersthal LF, Decker T, Kiani A, Vehling-Kaiser U, Al-Batran SE, et al. FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer (FIRE-3): a randomised, open-label, phase 3 trial. Lancet Oncol. 2014;15(10):1065-75.
Bonner JA, Harari PM, Giralt J, Azarnia N, Shin DM, Cohen RB, et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med. 2006; 354(6):567- 78.
Jonker DJ, O'Callaghan CJ, Karapetis CS, Zalcberg JR, Tu D, Au HJ, et al. Cetuximab for the treatment of colorectal cancer. N Engl J Med. 2007;357(20):2040-8.
Maughan TS, Adams RA, Smith CG, Meade AM, Seymour MT, Wilson RH, et al. Addition of cetuximab to oxaliplatin-based first-line combination chemotherapy for treatment of advanced colorectal cancer: results of the randomised phase 3 MRC COIN trial. Lancet. 2011;377(9783):2103-14.
Sobrero AF, Maurel J, Fehrenbacher L, et al. EPIC: Phase III trial of cetuximab plus irinotecan after fluoropyrimidine and oxaliplatin failure in patients with metastatic colorectal cancer. J Clin Oncol. 2008; 26:2311–9.
Van Cutsem E, Köhne CH, Hitre E, Zaluski J, Chang Chien CR, Makhson A, et al. Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med. 2009;360(14):1408-17.
Venook AP, Blanke CD, Niedzwiecki D, Lenz HJ, Taylor JR, Hollis DR, et al. Cancer and Leukemia Group B/Southwest Oncology Group trial 80405: a phase III trial of chemotherapy and biologics for patients with untreated advanced colorectal adenocarcinoma. Clin Colorectal Cancer. 2005;5(4):292-4.
Vermorken JB, Mesia R, Rivera F, Remenar E, Kawecki A, Rottey S, et al. Platinum-based chemotherapy plus cetuximab in head and neck cancer. N Engl J Med. 2008;359(11):1116-27.
Kopetz S, Grothey A, Yaeger R, Van Cutsem E, Desai J, Yoshino T, et al. Encorafenib, Binimetinib, and Cetuximab in BRAF V600E-Mutated Colorectal Cancer. N Engl J Med. 2019;381(17):1632-1643.
Características Farmacológicas
Grupo farmacoterapêutico: Agente antineoplásico, anticorpo monoclonal.
Código ATC: L01FE01.
Mecanismo de ação
O receptor do fator de crescimento epidérmico (EGFR – Epidermal Growth Factor Receptor -, em inglês) faz parte da via de sinalização envolvida no controle de sobrevivência da célula, progressão do ciclo celular, angiogênese, migração celular e invasão celular/metástase. O cetuximabe é um anticorpo monoclonal quimérico IgG1 especificamente direcionado ao receptor do fator de crescimento epidérmico (EGFR). Ele se liga ao EGFR com uma afinidade que é aproximadamente 5 a 10 vezes maior do que o ligante endógeno e bloqueia a ligação de ligantes endógenos do EGFR, resultando em uma inibição da função do receptor. O cetuximabe induz a internalização do EGFR, o que pode levar a uma redução da regulação do EGFR. O cetuximabe também envia células imunoefetoras citotóxicas na direção de células tumorais que expressam EGFR (Toxicidade Celular Dependente de Anticorpos (ADCC)).
O Cetuximabe não se liga a outros receptores pertencentes à família HER.
O produto proteico do proto-oncogene RAS (sarcoma de rato) é um transdutor de sinal central downstream do EGFR. Em tumores, a ativação do RAS por EGFR contribui para o aumento da proliferação EGFR-mediada, sobrevivência e produção de fatores pró-angiogênicos.
RAS é uma das famílias de oncogenes mais frequentemente ativadas em carcinomas humanos. Mutações dos genes RAS em certos pontos preferenciais nos exons 2, 3 e 4 resultam em ativação constitutiva das proteinas RAS, independente da sinalização do EFGR.
No cenário de CCR BRAF mutante, a indução da ativação da via MAPK mediada por EGFR foi identificada como um mecanismo de resistência aos inibidores de BRAF. Combinações de um inibidor de BRAF e agentes direcionados ao EGFR demonstraram superar esse mecanismo de resistência em modelos não clínicos. A coadministração de cetuximabe e encorafenibe demonstrou melhorar a eficácia anti-tumoral em modelos não clínicos.
Farmacodinâmica
O cetuximabe inibe a proliferação e induz a apoptose de células tumorais humanas que expressam EGFR. O cetuximabe também inibe a produção de fator angiogênico por células tumorais, bloqueia a migração celular endotelial e provoca uma redução da revascularização tumoral e da metástase.
Farmacocinética
Administração
O cetuximabe é administrado por via intravenosa.
Distribuição
Observou-se que a farmacocinética das infusões endovenosas de cetuximabe é dose-dependente, quando administrado em doses semanais que variaram entre 5 e 500 mg/m2 de superfície corporal.
Quando cetuximabe foi administrado a uma dose inicial de 400 mg/m2 de superfície corporal, o volume médio de distribuição foi aproximadamente equivalente ao espaço vascular (2,9 L/m2 numa faixa entre 1,5 e 6,2 L/m2).
O valor médio de Cmax foi de 185 ± 55 mcg/mL. O clearance médio foi de 0,022 L/h por m2 de superfície corporal. A meia-vida de eliminação foi longa, com valores na faixa de 70 a 100 horas na dose-alvo.
A concentração no soro sanguíneo alcançou níveis estáveis após 3 semanas de monoterapia com Cetuximabe. As concentrações máximas médias de Cetuximabe foram de 155,8 mcg/mL por m2 de superfície corporal na semana 3 e 151,6 mcg/mL na semana 8, ao passo que as concentrações mínimas médias foram de 41,3 e 55,4 mcg/mL, respectivamente.
Em um estudo de Cetuximabe administrado em combinação ao irinotecano, os níveis mínimos médios de Cetuximabe foram de 50 mcg/mL na semana 12 e 49,4 mcg/mL na semana 36.
Metabolismo/Eliminação
Diversas vias foram descritas como contribuintes do metabolismo de anticorpos. Todas estas vias envolvem a biodegradação do anticorpo a moléculas menores, tais como peptídeos pequenos ou aminoácidos.
Uma análise integrada de todos os estudos clínicos demonstrou que as características farmacocinéticas de cetuximabe não são influenciadas por raça, idade, sexo ou por função renal/hepática alterada.
Dados não-clínicos de segurança
Alterações de pele dose-dependentes foram os mais importantes dados encontrados em estudos de toxicidade animal, iniciando-se em níveis de dose equivalentes aos utilizados em humanos. Um estudo embrio-fetal de toxicidade em macacos Cynomolgus não revelou sinais de teratogenicidade. Entretanto, dependendo da dose, foi observada uma maior incidência de abortos.
Dados não-clínicos de genotoxicidade e tolerância local, incluindo vias acidentais de administração, revelaram que não há perigo específico para humanos.
Não foram realizados estudos formais em animais para estabelecer o potencial carcinogênico de cetuximabe ou para determinar seus efeitos na fertilidade masculina ou feminina.
Não foram realizados estudos de toxicidade com a coadministração de cetuximabe e agentes quimioterápicos.
Não se dispõe, até o momento, de dados não-clínicos sobre o efeito de cetuximabe na cicatrização de feridas. Entretanto, em modelos pré-clínicos de cicatrização de feridas, inibidores EGFR seletivos da tirosina-quinase demonstraram retardar a cicatrização de feridas.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)