Para que serve o Cloreto de Potássio 19,1% Farmarin?
Essa solução injetável repõe potássio no sangue quando os níveis estão baixos (hipocalemia), usado em terapia venosa para equilíbrio de líquidos.
Como funciona o Cloreto de Potássio 19,1% Farmarin?
Repõe o potássio, mineral essencial dentro das células. Mantém o volume celular e ajuda no metabolismo.
Quem não pode usar o Cloreto de Potássio 19,1% Farmarin?
Não use se tiver potássio alto no sangue (hipercalemia), problemas renais graves, insuficiência adrenal ou acidose grave.
Como usar o Cloreto de Potássio 19,1% Farmarin?
Deve ser diluído e aplicado lentamente na veia. Nunca aplicar direto na veia sem diluir.
Não usar injeção direta na veia.
Descartar o que não for usado após abrir.
Uso sob supervisão médica com exames de sangue e acompanhamento cardíaco.
Concentração máxima: 4g/L. Infusão lenta (12 a 24 horas).
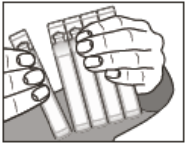
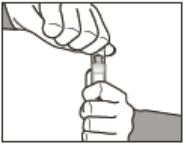
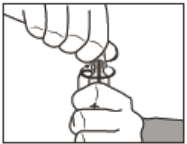
Como abrir a ampola
- Dobre a ampola do bico para a base.
- Segure na vertical e gire as aletas laterais.
- Gire no sentido horário para abrir.
- Remova as aletas.
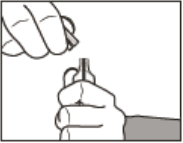
*Aletas laterais.
Aplicado por profissionais de saúde.
Dose varia conforme idade, peso e exames.
Adultos
Dose diária: 0,8 a 2 mmol de potássio por kg de peso.
1g de cloreto de potássio = 13,4 mmol de potássio.
Crianças
Dose máxima: 3 mmol de potássio por kg de peso por dia. Sempre diluído na veia.
Siga exatamente as orientações médicas. Não pare sem autorização.
O que fazer se esquecer de usar?
Aplicado em hospitais por profissionais. O paciente não controla a aplicação.
Em dúvidas, consulte médico ou farmacêutico.
Cuidados ao usar o Cloreto de Potássio 19,1% Farmarin
Sempre diluir antes de usar.
Aplicar lentamente.
Verificar compatibilidade com outros medicamentos.
Parar se surgir hipercalemia (potássio alto).
Risco maior se tiver problemas renais ou urina reduzida.
Pode ser necessário em diabéticos com cetoacidose.
Monitorar eletrólitos no sangue e coração durante o uso.
Grávidas
Usar só se necessário. Categoria C: risco não descartado.
Grávidas só devem usar com orientação médica.
Amamentação
Evitar amamentar durante o tratamento.
Quais os efeitos colaterais?
Pode causar irritação no local da injeção, diarreia, dor de barriga, arritmia, náusea, vômito e gases.
Informe ao médico qualquer reação adversa.
Embalagens disponíveis
Solução injetável concentrada
Caixas com 50, 60, 80, 100, 150 ou 200 ampolas plásticas de 10 mL.
Uso intravenoso lento após diluição. Adultos e crianças.
Composição do Cloreto de Potássio 19,1% Farmarin
Cada mL da ampola contém:
Cloreto de potássio | 191 mg |
Água para injetáveis q.s.p. | 1 mL |
Eletrólitos
Potássio | 2,56 mEq/mL |
Cloreto | 2,56 mEq/mL |
Osmolaridade: 5124 mOsmol/L.
O que acontece em caso de dose maior?
Excesso causa hipercalemia (potássio alto) com sintomas:
- Confusão, paralisia, fraqueza, arritmia, pressão baixa, falta de ar, cansaço, formigamento ou parada cardíaca.
Procure ajuda médica imediata mesmo sem sintomas.
Em caso de superdose, vá ao hospital com a embalagem. Ligue 0800 722 6001.
Interações com outros remédios
Medicamentos que aumentam risco de potássio alto:
- Diuréticos poupadores de potássio, IECA, anti-inflamatórios, heparina, ciclosporina e trimetoprima.
Combinações aumentam risco de hipercalemia.
Combinações perigosas:
- Diuréticos poupadores de potássio (ex: espironolactona)
- Remédios para pressão (IECA ou BRA)
- Imunossupressores (ciclosporina, tacrolimus)
Informe ao médico todos os remédios que usa.
Não use outros remédios sem orientação médica.
Como age no organismo?
Eficácia
Repõe níveis de potássio para prevenir sintomas clínicos. Estudos mostram eficácia em manter níveis adequados em hipertensos usando diuréticos e em casos de paralisia hipocalêmica.
Referências Bibliográficas
1. Gumma A, Hess H, Ramsay RA (1971) Freigabe von KC1 aus einer Retardform. Release of KCl from a slow-release form. Pharm Industr; 33:291-3.
2. De Wardener HE, Clarkson EM, Ford J (1969) Potassium Supplements. Brit med J; IV:168.
3. Nordin BEC, Wilkinson R (1970)] Potassium Supplements. Brit med J; 1:433.
4. Lowance DC, Murad F, Darrow WR, et al (1982)] Bioequivalence of a slow-release potassium tablet and a liquid potassium Supplement. Int J Clin Pharmacol; 20:204-8.
5. Barlow CG (1965)] Release of potassium Chloride from tablets. J Pharm Pharmacol; 17:822-4.
6. Mudge GH (1985)] Agents affecting volume and composition of body fluids. In: Goodman and Gilman's (eds); The pharmacological basis of therapeutics. 7th ed. Macmillan Publishing, New York. pp. 846-78.
7. [Martindale (1982)] Electrolytes. In: Reynolds JEF (eds): The extra pharmacopoeia. 28th ed. The Pharmaceutical Press, London.
8. Levinsky NG (1986)] Fluids and electrolytes. In: Braunwald E, et al. (eds): Harrison's principles of internal medicine, 11th ed. McGraw-Hill Book Company, New York. pp. 198-208.
9. Stanaszek WF, Romankiewicz JA (1985)] Current approaches to management of potassium deficiency. Drug Intell; 19:176-84.
10. [American Medical Association (1986)] Replenishers and regulators of water and electrolytes. In: Drug evaluations, 6th ed. American Medical Association, Chicago. pp.827-39.
11. [Thier SO (1986)] Potassium physiology. Amer J Med; 80 (Suppl. 4A):3-7.
12. Lawson AAH (1981 )] Potassium replaceme nt: When is it ne cessary? Drugs; 21:35 4-61.
13. [He ifant RH (1986)] Hypokalemia and arrhythmias. Am J Med; 80 (Suppl. 4A):13-22.
14. [Lawson AAH (1981)] Potassium replacement: When is it necessary? Drugs; 21:354-61.
15. Jellett LB (1978)] Potassium therapy; When is it indicated? Drugs; 16:88-94.
16. Kaplan NM (1984)] Our appropriate concern about hypokalemia. Am J Med; 77:1-4.
17. [Ben-Ishay D, Engelman K (1973)] Bioavailability of potassium from a slow-release tablet. Clin Pharmacol Ther; 14:250-8.
18. Kosman ME (1974)] Management of potassium problems during long-term diuretic therapy. J Am Med Ass; 230:743-8. 19. Morgan DB (1981)] Hypokalaemia and diuretics. In: Wood C and Somerville W (eds); Arrhythmias and myocardial infarction; the role of potassium. Royal Society of Medicine and Symposium series 44, London. pp. 3-8.
20. Knöchel JP (1984)] Diuretic-induced hypokalemia. Am J Med; 77:18-27.
21. Wyngaarden JB, Smith LH (1982)] Myotonia congenita. Familial periodic paralysis. In: Cecil Textbook of Medicine, 16th ed. W.B. Saunders Company, Philadelphia. pp. 2176f.
22. Lawson DH, Murray RM, Parker JL (1972)] Early mortality in megaloblastic anaemias. Quart J Med; XLI:1-14.
23. Lawson DH, Murray RM, Parker JL, et al (1970)] Hypokalaemia in megaloblastic anaemias. Lancet; 11:588-90.
24. Skoutakis VA, Carter CA, Acchiardo SR. Therapeutic assessment of Cloreto de Potássio and K-tab potassium chloride formulations in hypertensive patients treated with thiazide diuretics. Drug Intell Clin Pharm. 1987 May;21(5):445-50.
25. Non-clinical Safety Statement – CDS Update of sections 4.6 and 5.3 Novartis Pharma AG. Basel, Switzerland. 13 Jul 07.
26. [Lawson DH, Murray RM, Parker JL, et al (1970)] Hypokalaemia in megaloblastic anaemias. Lancet; 11:588-90.
27. [Potter JM, Blake GM, Cox JR (1984)] Potassium Supplements and total body potassium in elderly patients. Age and Ageing; 13:238-42.
28. [Graham DY (1986)] Effectiveness and tolerance of "solid" vs. "liquid" potassium replacement therapy. In: Whelton PK, et al. (eds): Potassium in cardiovascular and renal medicine. Dekker M, INC. New York, Basel. pp. 435-50. 29. [Ponce SP, Jennings AE, Madias NE, et al (1985)] Drug-induced hyperkalemia.Medicine; 64:357-70.
30. [Kunau RT, Stein JH (1977)] Disorders of hypo- and hyperkalemia. Clin Nephrol; 7:173-90.
31. [Al-Dujaili H, Salole EG, Florence AT (1983)] Drug formulation and oesophageal injury. Adverse Drug React. Acute Poison Revs; 2:235-56.
32. [Bott SJ, McCallum RW (1986)] Medication-induced oesophageal injury. Survey of the literature. Med Toxicol; 1:449-57.
33. [Lawson PH (1974)] Adverse reactions to potassium Chloride. Quart J Med; XLIII:433-40.
34. [Durrence CW, Cooper JW (1984)] Gastrointestinal side effects associated with liquid and solid potassium Chloride in a geriatric long-term care facility. Curr Ther Res;36:550-6.
35. [Kleinberg ML, Connors MC (1986)] Ostomy care. In: Davidson DE, Feldmann EG (eds): Handbook of non-prescription drugs. 8th ed. American Pharmaceutical Association, Washington. pp. 120-2.
36. [Wills RW (1986)] Magnesium and potassium inter-relationships in cardiac disorders. Drugs; 31 (Suppl. 4):121-31.
37. [Christofides ND, Ghatei MA, Bloom SR, et al (1982)] Decreased plasma motilin concentrations in pregnancy. Brit med J; 285:1453f.
38. [Bloom Sr, Polak JM (1981)] Gut Hormones, 2nd ed. Churchill Livingstone, Edinburgh. pp. 276f. 39. [Goldszer RC, Coodley EL, Rosner MJ, et al (1981)] Hyperkalemia associated with indomethacin. Arch Intern Med; 141:802-4.
40. [Akbarpour F, Afrasiabi A, Vaziri ND, et al (1985)] Severe hyperkalemia caused by indomethacin and potassium supplementation. Sth med J; 78:756f.
41. [Rimmer JM, Horn JF, Gennari FJ (1987)] Hyperkalemia as a complication of drug therapy. Arch Intern Med; 147:867-9.
42. [Tarpley EL (1974)] Controlled-release potassium supplementation. Curr Ther Res; 16:734-41.
43. [Cooper I (1975)] Potassium supplementation during diuretic therapy. Curr Ther Res; 17:555-63.
44. [Schwartz AB, Swartz Ch et al (1974)] Dosage of potassium Chloride elixir to correct thiazideinduced hypokalemia. J Am Med Ass; 230:702-4.
45. [Ramsay LE, Boyle P, Ramsay MH (1977)] Factors influencing serum potassium in treated hypertension. Quart J Med; XLVI:401-10.
46. Cloreto de Potássio: Overdosage (1982) In Information on overdosage with CIBA-GEIGY pharmaceuticals. CIBA-GEIGY AG. Basel, Switzerland.
47. [Lakhani M (1986)] Complete heart block induced by hyperkalaemia associated with treatment with a combination of captopril and spironolactone. Brit med J; 293:271.
48. [Tannen RL (1986)] Drug interactions causing hyperkalemia. In: Whelton PK et al. (eds): Potassium in cardiovascular and renal medicine. Dekker, New York, Basel. pp.467-76.
49. [May RC, Mitch WE (1986)] The treatment of hyperkalemia. In: Whelton PK et al. (eds): Potassium in cardiovascular and renal medicine. Dekker, New York, Basel. pp.453-66.
50. [L'E Orme M (1986)] Non-steroidal anti-inflammatory drugs and the kidney. Brit med J; 292:1621f.
51. [Lofgren RP, Rothe PR, Carlson GJ (1982)] Jejunal Perforation associated with slow- release potassium chloride therapy. Sth med J; 75:1154f.
52. [Mansfield JB, Schoenfeld FB, Suwa M, et al (1967)] Role of vascular insufficiency in drug-induced small bowel ulceration. Am J Surg; 113:608-14.
53. [Bergmann KE, Ziegler EE, Fomon SJ (1974)] Water and renal solute load. In: Ponton SJ (eds): Infant Nutrition. 2nd ed. Saunders WB Company, Philadelphia. Chapter 10 pp.245-66.
54. [Burnakis TG, Mioduch HJ (1984)] Combined therapy with captopril and potassium supplementation. A potential for hyperkalemia. Arch Intern Med; 144:2371f.
55. [Schwartz AB (1986)] Balance, distribution, and reference ranges of potassium throughout the body. In: Whelton PK, et al. (eds): Potassium in cardiovascular and renal medicine. Dekker, New York, Basel. pp. 85-95.
56. [Weiner N (1985)] Atropine, scopolamine, and related antimuscarinic drugs. In: Goodman and Gilman's (eds): The pharmacological basis of therapeutics. 7th ed. Macmillan Publishing, New York. Chapter 7, pp. 130-141.
57. Clinical Safety Statement – CDS Update of sections 4.2, 4.3, 4.4, 4.5, 4.6 and 4.8 of the CDS. Novartis Pharma AG. Basel, Switzerland. 12 Jul 07.
58. Non-clinical Safety Statement – CDS Update of sections 4.6 and 5.3 Novartis Pharma AG. Basel, Switzerland. 13 Jul 07.
59. [2.5 Clinical Overview] Rationale for changes to Core Data Sheet (CDS)/Product InformationContraindications. Novartis. 08-Nov-2011
60. [2.5 Clinical Overview ] Rationale for changes to Core Data Sheet (CDS)/Product Information-Dosage and administration. Novartis. 08-Nov-2011
61. [2.5 Clinical Overview ]Rationale for changes to Core Data Sheet (CDS)/Product InformationInteractions and Clinical pharmacology. Novartis. 08-Nov-2011
62. [2.4 Non-Clinical Overview ]Rationale for changes to Core Data Sheet (CDS)/Product InformationNon-clinical safety data. Novartis. 08-Nov-2011
63. [2.5 Clinical Overview] Rationale for changes to Core Data Sheet (CDS)/Product Information- topic Overdose (Pharmacobezoar Formation). Novartis. 14-Jul-2015.
Características farmacológicas
Potássio regula impulsos nervosos, contração muscular e equilíbrio ácido-base. Sintomas de falta aparecem quando níveis sanguíneos caem abaixo de 3,5 mmol/L: fraqueza, paralisia, arritmias.
Farmacocinética
Absorção
Liberação gradual no trato digestivo quando administrado oralmente.
Eliminação
90% eliminado pelos rins em 8 horas; 98% em 24 horas.
Segurança pré-clínica
Baixa toxicidade oral. Sem evidência de risco reprodutivo ou cancerígeno relevante para humanos.
Como guardar o Cloreto de Potássio 19,1% Farmarin?
Temperatura ambiente (15°C a 30°C). Validade: 24 meses.
Verifique lote e validade na embalagem.
Não use vencido ou se houver alteração visual (partículas, cor diferente).
Aspecto do produto
Solução transparente e sem partículas.
Mantenha fora do alcance de crianças.
Informações Legais
M.S. 1.1688.0036
Farmacêutico Responsável:
Victor Luiz Kari Quental
CRF-SP 26.638
Fabricado por:
Farmarin Indústria e Comércio Ltda
Rua Pedro de Toledo, 600 – Guarulhos – SP
CNPJ 58.635.830/0001-75
Indústria Brasileira
SAC
0800 101 106
Uso restrito a hospitais com prescrição médica.

 Revisado clinicamente por: Isabelle Baião de Mello Neto (CRF-MG 24309). Atualizado em: 01 de outubro de 2025.
Revisado clinicamente por: Isabelle Baião de Mello Neto (CRF-MG 24309). Atualizado em: 01 de outubro de 2025.