Como o Cabometyx funciona? (Ação da substância)
Resultados de Eficácia
Câncer de rim após tratamento prévio
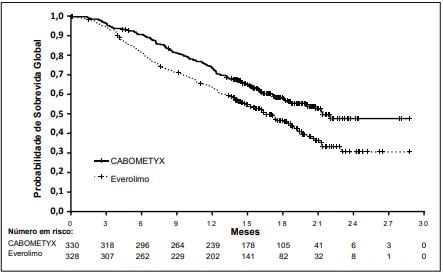
Estudo Metor1,2 (fase 3) mostrou melhora significativa na sobrevida global com Cabozantinibe vs everolimo em pacientes com CCR após tratamento prévio. A sobrevida livre de progressão avaliada por comitê independente foi maior com Cabozantinibe (7,4 vs 3,9 meses). Taxa de resposta: 17% vs 3%.
Tabela 1: Sobrevida Livre de Progressão (comitê independente)
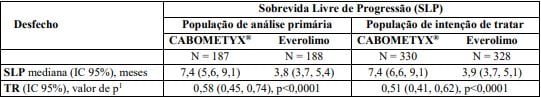
1 teste estratificado log-rank.
SLP = Sobrevida livre de progressão.
TR = Taxa de Risco.
IC = Intervalo de Confiança.
Figura 1: Curva de sobrevida sem progressão (primeiros 375 pacientes)
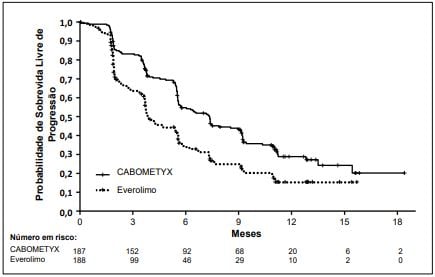
Tabela 2: Taxa de Resposta Objetiva
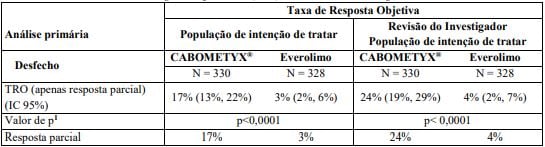
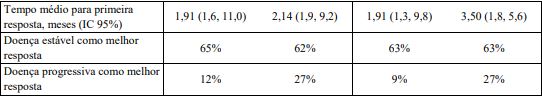
Figura 2: Sobrevida global em CCR
Bibliografia:
1.Choueiri TK, et al; Meteor Investigators. Cabozantinib versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med 2015;373(19):1814-23.
2.Choueiri TK, et al; Meteor Investigators. Cabozantinib versus everolimus in advanced renal cell carcinoma (Meteor): final results from a randomised, open-label, phase 3 trial. Lancet Oncol 17:917-27, 2016.
Câncer de rim não tratado previamente
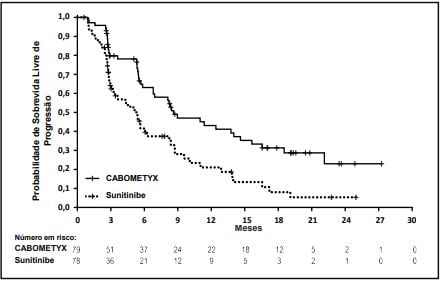
Estudo Cabosun3 comparou Cabozantinibe vs sunitinibe em pacientes não tratados. Sobrevida livre de progressão foi maior com Cabozantinibe (8,6 vs 5,3 meses). Taxa de resposta: 20% vs 9%.
Tabela 3: Resultados de eficácia (população ITT, CABOSUN)
| - | Cabozantinibe (N=79) | Sunitinibe (N=78) |
Sobrevida livre de progressão (SLP) pelo CRI a | ||
SLP mediana em meses (IC 95%) | 8,6 (6,2, 14,0) | 5,3 (3,0, 8,2) |
TR (IC 95%); estratificado b,c | 0,48 (0,32, 0,73) | |
Valor de p da classificação logarítmica bilateral: estratificado b | p=0,0005 | |
Sobrevida livre de progressão (SLP) por investigador | ||
SLP mediana em meses (IC 95%) | 8,3 (6,5, 12,4) | 5,4 (3,4, 8,2) |
TR (IC 95%); estratificado b,c | 0,74 (0,47, 1,14) | |
Valor de p da classificação logarítmica bilateral: estratificado b | p=0,0042 | |
Sobrevida Global (SG) | ||
SG mediana em meses (IC 95%) | 30,3 (14,6, NE) | 21,0 (16,3, 27,0) |
TR (IC 95%); estratificado b,c | 0,74 (0,47, 1,14) | |
Taxa de resposta objetiva (TRO) n (%) pelo CRI | ||
Respostas completas | 0 | 0 |
Respostas parciais | 16 (20) | 7 (9) |
TRO (apenas respostas parciais) | 16 (20) | 7 (9) |
Doença estável | 43 (54) | 30 (38) |
Doença progressiva | 14 (18) | 23 (29) |
Taxa de resposta objetiva (TRO) n (%) pelo investigador | ||
Respostas completas | 1 (1) | 0 |
Respostas parciais | 25 (32) | 9 (12) |
TRO (apenas respostas parciais) | 26 (33) | 9 (12) |
Doença estável | 34 (43) | 29 (37) |
Doença progressiva | 14 (18) | 19 (24) |
a de acordo com recomendações da UE.
b Fatores de estratificação de acordo com o IxRS compreendem categorias de risco do IMDC [risco intermediário, risco ruim e metástase óssea (sim, não)].
c Estimado usando o modelo de risco proporcional de Cox ajustado para fatores de estratificação de acordo com IxRS. Proporção de risco < 1 indica sobrevida livre de progressão em favor do Cabozantinibe.
Figura 3: Sobrevida livre de progressão em CCR não tratado previamente
Bibliografia:
3. Choueiri TK, et al. Cabozantinib Versus Sunitinib As Initial Targeted Therapy for Patients With Metastatic Renal Cell Carcinoma of Poor or Intermediate Risk: The Alliance A031203 Cabosun Trial. J Clin Oncol 2017;35(6):591-7.
Características Farmacológicas
Mecanismo de ação
Cabozantinibe é uma pequena molécula que bloqueia múltiplos receptores de tirosina-quinases envolvidos no crescimento tumoral, formação de vasos sanguíneos, alterações ósseas, resistência a medicamentos e disseminação do câncer. Inibe principalmente receptores MET e VEGF, além de outros como AXL, RET, ROS1, TYRO3, MER, KIT, TRKB, FLT3 e TIE-2.
Efeitos farmacodinâmicos
Demonstrou inibir crescimento tumoral e metástase em modelos pré-clínicos.
Eletrofisiologia cardíaca
Pode aumentar o intervalo QT corrigido em 10-15 ms após 29 dias de tratamento (dose 140 mg). Não foram observados QTcF >500 ms em estudos com CCR (dose 60 mg).
Propriedades farmacocinéticas
Absorção
Concentrações máximas atingidas em 3-4 horas após dose oral. Estado estacionário alcançado em ~15 dias.
Distribuição
Alta ligação a proteínas plasmáticas (>99,7%). Volume de distribuição ~319 L.
Biotransformação
Metabolizado principalmente por CYP3A4. Quatro metabólitos principais no plasma.
Eliminação
Meia-vida ~99 horas. 81% da dose eliminada em 48 dias (54% fezes, 27% urina).
Farmacocinética em populações especiais
Insuficiência renal
Exposição aumentada em 19-30% em insuficiência leve. Não estudado em casos graves.
Insuficiência hepática
Exposição aumentada em 63-81% em insuficiência leve/moderada. Não estudado em casos graves.
Raça
Sem diferenças clinicamente relevantes.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)