Farmacologia: Ação da Substância de Breelet
Resultados de Eficácia
Tratamento Adjuvante
Estudo BIG 1-98 (CFEM345 0019)
Estudo multicêntrico duplo-cego com mais de 8000 mulheres na pós-menopausa com câncer de mama inicial receptor-positivo. Pacientes foram randomizadas para: A. tamoxifeno 5 anos; B. Letrozol 5 anos; C. tamoxifeno 2 anos seguido de Letrozol 3 anos; D. Letrozol 2 anos seguido de tamoxifeno 3 anos.
Objetivo primário: sobrevida livre de doença (SLD). Secundários: tempo para metástase à distância (TMD); sobrevida livre de doença à distância (SLDD); sobrevida global (SG).
Resultados com seguimento mediano de 26 e 60 meses
Taxas de SLD em 5 anos: 84% para Letrozol vs 81,4% para tamoxifeno.
Tabela 1 – Análise principal: Sobrevida livre de doença e sobrevida global (população ITT)
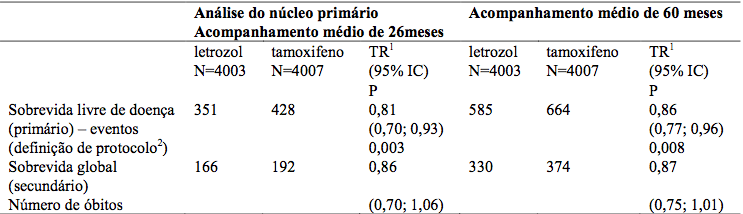
TR = Taxa de risco.
IC = Intervalo de confiança.
1 Teste de “log rank”, estratificado.
2 Eventos SLD: recorrência locorregional, metástase, câncer contralateral, segundo tumor primário, morte sem evento prévio.
Resultados no seguimento médio de 96 meses (braços monoterapia)
Confirmação de redução significativa no risco de recorrência com Letrozol vs tamoxifeno.
Tabela 2 - Monoterapia: sobrevida livre de doença e sobrevida global (população ITT)
| Letrozol N=2463 | Tamoxifeno N=2459 | Taxa de Risco1 (95% IC) | Valor P | |
Eventos de sobrevida livre de doença2 | 626 | 698 | 0,87 (0,78; 0,97) | 0,01 |
Tempo de metástase à distância2 | 301 | 342 | 0,86 (0,74; 1,01) | 0,06 |
Sobrevida global3 | 393 | 436 | 0,89 (0,77; 1,02) | 0,08 |
Análise censurada de SLD4 | 626 | 649 | 0,83 (0,74; 0,92) | |
Análise censurada de SG4 | 393 | 419 | 0,81 (0,70; 0,93) |
1 Teste de “log rank”.
2 Eventos SLD: recorrência, metástase, câncer contralateral, segundo tumor, morte sem evento.
3 Óbitos.
4 Censura na troca para Letrozol.
Análises de Tratamentos Sequenciais
Sem diferenças significativas entre sequências e monoterapia.
Tabela 3 - Tratamento sequencial vs monoterapia com Letrozol (população troca)
| N | Eventos1 | Taxa de risco2 | (97.5% IC) | Valor P | |
[Letrozol→] Tamoxifeno | 1.460 | 254 | 1,03 | (0,84; 1,26) | 0,72 |
Letrozol | 1.463 | 249 | - | - | - |
1 Definição de protocolo.
2 Ajustado por quimioterapia.
Sem diferenças significativas nos objetivos secundários.
Tabela 4 - Sobrevida livre de doença (população ITT)
| - | Letrozol → tamoxifeno | Letrozol |
Pacientes | 1.540 | 1.546 |
| - | Letrozol → tamoxifeno | Tamoxifeno2 |
Pacientes | 1.540 330 0,92 (0,75;1,12) | 1.548 |
1 Ajustado por quimioterapia.
2 40% trocaram seletivamente para Letrozol.
Tabela 5 - Monoterapia adjuvante: reações adversas com diferenças significativas
Letrozol | Tamoxifeno | |||
| Durante tratamento (5 anos) | Após randomização (96 meses) | Durante tratamento (5 anos) | Após randomização (96 meses) | |
Fratura óssea | 10,2% | 14,7% | 7,2% | 11,4% |
Osteoporose | 5,1% | 5,1% | 2,7% | 2,7% |
Eventos tromboembólicos | 2,1% | 3,2% | 3,6% | 4,6% |
Infarto do miocárdio | 1,0% | 1,7% | 0,5% | 1,1% |
Hiperplasia/câncer endometrial | 0,2% | 0,4% | 2,3% | 2,9% |
Tabela 6 - Tratamento sequencial vs monoterapia com Letrozol: reações adversas significativas
| Monoterapia Letrozol 5 anos | Letrozol->Tamoxifeno 2+3 anos | Tamoxifeno->Letrozol | |
| N=1535 | N=1527 | N=1541 | |
Fraturas ósseas | 10,0% | 7,7%* | 9,7% |
Distúrbios endometriais | 0,7% | 3,4%** | 1,7%** |
Hipercolesterolemia | 52,5% | 44,2%* | 40,8%* |
Ondas de calor | 37,6% | 41,7%** | 43,9%** |
Sangramento Vaginal | 6,3% | 9,6%** | 12,7%** |
* Significativamente menor vs monoterapia.
**Significativamente maior vs monoterapia.
Estudo CFEM345D2407
Estudo aberto randomizado comparando efeitos de Letrozol e tamoxifeno sobre densidade mineral óssea (DMO) e perfil lipídico. Após 2 anos, redução mediana de 4,1% na DMO lombar com Letrozol vs aumento de 0,3% com tamoxifeno. Nenhuma paciente com DMO normal desenvolveu osteoporose. Efeitos lipídicos favoráveis ao tamoxifeno.
Estudo FACE (CFEM345D2411)
Estudo fase IIIb aberto comparando Letrozol e anastrozol em câncer de mama inicial com linfonodos positivos. Sem diferenças significativas em sobrevida livre de doença (SLD) ou sobrevida global (SG).
Tratamento Adjuvante Estendido
Estudo MA-17 (CFEM345MA17)
Estudo duplo-cego com mulheres na pós-menopausa que completaram 5 anos de tamoxifeno, randomizadas para Letrozol ou placebo por 5 anos. Letrozol reduziu risco de recorrência em 42% vs placebo.
Tabela 7 - Sobrevida livre de doença e sobrevida global (população ITT modificada)
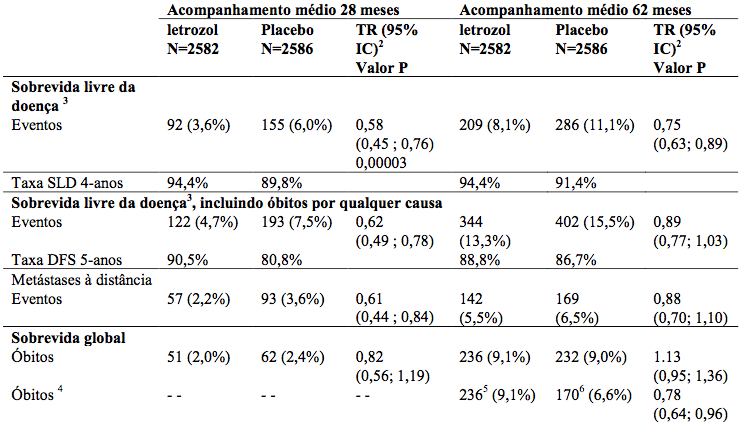
TR= taxa de risco.
IC = intervalo de confiança.
1 60% do grupo placebo trocou para Letrozol.
2 Eventos SLD: recorrência locorregional, metástase, câncer contralateral.
3 Análise censurando na troca.
4 Seguimento médio 62 meses.
5 Seguimento médio até troca: 37 meses.
Estudo MA-17R (CFEM345MA17E1)
Estudo duplo-cego com mulheres após 5 anos de inibidor de aromatase, randomizadas para Letrozol ou placebo por mais 5 anos. Letrozol reduziu risco de recorrência em 34% vs placebo (HR 0,66).
Tratamento Neoadjuvante
Estudo CFEM345E P024
Estudo duplo-cego com 337 pacientes. Resposta objetiva: 55% com Letrozol vs 36% com tamoxifeno (P <0,001). 45% das pacientes com Letrozol vs 35% com tamoxifeno foram submetidas à cirurgia conservadora.
Tratamento de Primeira Linha
Estudo CFEM345C P025
Estudo duplo-cego comparando Letrozol e tamoxifeno em câncer de mama avançado. Letrozol superior em tempo até progressão (TTP), resposta objetiva e benefício clínico.
Tabela 8 - Resultados principais
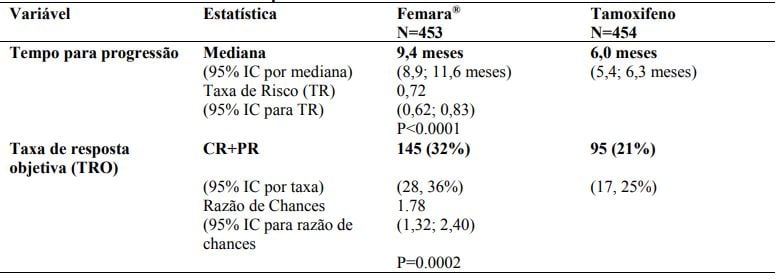
Tratamento de Segunda Linha
Estudos mostraram superioridade do Letrozol 2,5 mg vs megestrol e aminoglutetimida em tempo até progressão e resposta tumoral.
Estudo FEM-INT-01
Estudo aberto randomizado: Letrozol significativamente mais eficaz que anastrozol em taxa de resposta objetiva (19% vs 12%, P=0,013).
Câncer de Mama Masculino
Não estudado.
Referências bibliográficas
1. Clinical Study Report, Study No.CFEM345D019 (BIG1-98).
2. Clinical Expert Statement - Study BIG 1-98.
3. Clinical Expert Statement - Study D2407.
4. Clinical Study Report, Study No.CFEM345DMA17.
5. Clinical Overview for Femara.
6. Expert Statement - Study MA-17.
7. Abbreviated Summary of Clinical Safety.
8. Clinical Overview.
9. Clinical Study Report, Study No. 2026701025.
10. Expert Report.
11. Trial Protocol No. AR/BC2.
12. Trial Protocol No. AR/BC2 Extension.
13. Clinical Trial Report - AR/BC3.
14. Clinical Trial Report - AR/BC3 - Primary Analysis.
15. Clinical Trial Report AR/BC3 Supplement.
16. Clinical Study Report, Study 2026705024.
17. Rationale for changes to Core Data Sheet.
Características Farmacológicas
Grupo farmacoterapêutico: Inibidor não-esteroidal da aromatase; antineoplásico (código ATC: L02B G04).
Mecanismo de Ação
Suprime a biossíntese de estrogênio ao inibir competitivamente a enzima aromatase, reduzindo os níveis de estrogênio em tecidos periféricos e tumorais.
Farmacodinâmica
Em mulheres na pós-menopausa, doses únicas de 0,1-2,5 mg reduzem estrona e estradiol sérico em 75-78%. Supressão máxima em 48-78h. Em câncer de mama avançado, doses diárias de 0,1-5 mg suprimem estradiol em 75-95%.
Não afeta esteroidogênese adrenal, androgênios, LH, FSH ou função tireoidiana.
Farmacocinética
Absorção
Biodisponibilidade absoluta: 99,9%. Alimentação retarda absorção sem alterar extensão.
Distribuição
Ligação a proteínas plasmáticas: ~60%. Volume de distribuição: ~1,87 L/kg.
Biotransformação
Metabolizado principalmente a carbinol (inativo) via CYP3A4 e CYP2A6.
Eliminação
Meia-vida terminal: 2-4 dias. Estado estável alcançado em 2-6 semanas.
Populações Especiais
Idosos: Sem efeito.
Insuficiência renal (CLcr ≥10 mL/min): Sem ajuste necessário.
Insuficiência hepática grave (Child-Pugh C): Exposição aumentada. Monitorar cuidadosamente.
Dados Pré-Clínicos
Baixa toxicidade aguda. Estudos de carcinogenicidade não mostraram tumores relacionados. Potencial teratogênico observado em ratas.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)