Breelet: Indicações e Para Que Serve
- Tratamento complementar para mulheres na pós-menopausa com câncer de mama inicial positivo para receptores hormonais.
- Tratamento prolongado após terapia inicial em mulheres na pós-menopausa com câncer de mama inicial que já usaram tamoxifeno por 5 anos.
- Primeira opção de tratamento para câncer de mama avançado dependente de hormônios em mulheres após a menopausa.
- Tratamento para câncer de mama avançado em mulheres na pós-menopausa (natural ou induzida) que já foram tratadas com medicamentos antiestrogênicos.
- Tratamento pré-operatório para mulheres na pós-menopausa com câncer de mama localmente avançado e positivo para receptores hormonais, visando possibilitar cirurgia conservadora da mama. O tratamento pós-cirúrgico segue os protocolos padrão.
Como Funciona o Breelet?
Breelet contém o princípio ativo letrozol, que pertence ao grupo de medicamentos conhecidos como inibidores da aromatase. É um tratamento hormonal (ou "endócrino") para o câncer de mama.
O crescimento do câncer de mama frequentemente é estimulado pelos estrogênios, hormônios femininos. Breelet reduz a produção de estrogênio ao bloquear a enzima aromatase, responsável pela produção desses hormônios. Isso impede o crescimento de tumores mamários que dependem de estrogênio. Como resultado, as células cancerosas diminuem ou interrompem seu crescimento e disseminação para outras partes do corpo.
Contraindicações do Breelet
- Alergia ao letrozol ou qualquer componente listado em "Composição do Breelet". Consulte seu médico em caso de suspeita.
- Mulheres que ainda menstruam (não entraram na menopausa).
- Grávidas.
- Mulheres amamentando.
- Informe seu médico se alguma dessas situações se aplicar a você.
Não use durante a gravidez sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez.
Posologia: Como Tomar o Breelet
Siga rigorosamente as orientações médicas. Em caso de dúvidas, consulte seu médico ou farmacêutico.
O comprimido deve ser engolido inteiro com água ou outro líquido.
Dosagem Recomendada
A dose habitual é de um comprimido de Breelet uma vez ao dia.
Horário de Administração
Tomar sempre no mesmo horário facilita a lembrança.
Duração do Tratamento
Continue usando diariamente pelo tempo prescrito pelo médico, que pode ser meses ou anos. Discuta a duração com seu médico.
Interrupção do Tratamento
Não suspenda o uso sem orientação médica. Consulte também "Duração do Tratamento".
Siga a prescrição médica quanto a horários, doses e duração. Não interrompa sem conhecimento do médico.
Não divida, esmague ou mastigue o comprimido.
O Que Fazer Se Esquecer de Tomar o Breelet?
- Se faltar pouco para a próxima dose (ex: dentro de 2-3 horas), ignore a dose esquecida e tome a próxima no horário habitual.
- Caso contrário, tome assim que lembrar e retome o esquema normal.
- Não tome dose dupla para compensar.
Em dúvidas, consulte farmacêutico ou médico.
Precauções e Cuidados com o Breelet
Siga todas as recomendações médicas, que podem diferir das informações desta bula.
Atenção Especial com Breelet:
- Problemas renais graves.
- Doença hepática grave.
- Histórico de osteoporose ou fraturas ósseas.
Seu médico pode verificar seus níveis hormonais antes do tratamento para confirmar a menopausa.
Informe seu médico sobre essas condições para ajustes necessários.
Monitoramento Durante o Tratamento
Breelet requer acompanhamento médico regular.
Seu médico fará exames periódicos para avaliar a eficácia do tratamento.
A saúde óssea pode ser monitorada, pois o medicamento pode causar perda de densidade óssea (osteoporose).
Em caso de dúvidas sobre o tratamento, consulte seu médico.
Idosos (65 anos ou mais)
Podem usar a mesma dose de adultos.
Crianças e Adolescentes (menores de 18 anos)
Não é indicado.
Gravidez
Não use durante a gravidez, pois pode prejudicar o feto. Há relatos de anomalias em bebês de mães que usaram Breelet na gestação.
Como Breelet é para mulheres na pós-menopausa, essa restrição provavelmente não se aplica. Porém, se você está na perimenopausa, discuta métodos contraceptivos com seu médico.
Amamentação
Não amamente durante o tratamento. Informe seu médico se estiver amamentando.
Mulheres em Idade Fértil e Homens
Se ainda tem ciclos menstruais, discuta contracepção eficaz com seu médico. Use método contraceptivo durante o tratamento e por 20 dias após parar Breelet.
Breelet pode reduzir a fertilidade masculina.
Habilitação e Operação de Máquinas
Se sentir tontura, sonolência ou alterações visuais, não dirija ou opere máquinas até se sentir normal.
Informações sobre Componentes
Contém lactose. Se tem intolerância à lactose, consulte seu médico antes de usar.
Pode causar doping.
Contém tartrazina, que pode desencadear reações alérgicas, especialmente em pessoas alérgicas a ácido acetilsalicílico.
Efeitos Colaterais do Breelet
Como todo medicamento, Breelet pode causar reações adversas, embora nem todas as pessoas as apresentem.
A maioria é leve a moderada e geralmente desaparece em alguns dias ou semanas. Ondas de calor, queda de cabelo ou sangramento vaginal podem estar relacionados à redução de estrogênio.
Não se alarme com esta lista. Você pode não apresentar nenhum efeito.
Frequência das Reações Adversas:
- Muito Comum: mais de 10% dos usuários;
- Comum: 1% a 10% dos usuários;
- Incomum: 0,1% a 1% dos usuários;
- Rara: 0,01% a 0,1% dos usuários;
- Muito Rara: menos de 0,01% dos usuários;
- Desconhecida: frequência não estimada.
Reações Adversas Graves
- Fraqueza/dormência em membros ou rosto, dificuldade para falar (sinais de AVC);
- Dor ou aperto no peito, dor súbita em braços/pernas (sinais cardíacos);
- Inchaço/vermelhidão em veias (tromboflebite);
- Dificuldade respiratória, dor torácica, desmaio, taquicardia, pele azulada (embolia pulmonar);
- Inchaço em braços, mãos, pés ou tornozelos (edema);
- Inchaço facial ou na garganta (reação alérgica);
- Febre alta, calafrios ou feridas na boca (infecção);
- Visão turva (catarata);
- Pele/olhos amarelados, náusea, perda de apetite, urina escura (hepatite);
- Erupções cutâneas, bolhas, descamação, febre (problemas de pele).
Procure atendimento imediato se apresentar esses sintomas.
Reações Muito Comuns
- Aumento do colesterol;
- Ondas de calor;
- Suor excessivo;
- Cansaço (incluindo fraqueza e mal-estar);
- Dor óssea e articular.
Informe seu médico se forem intensos.
Reações Comuns
- Dor de cabeça;
- Erupções cutâneas;
- Tontura;
- Problemas digestivos (náusea, vômito, indigestão, prisão de ventre, diarreia);
- Aumento ou perda de apetite;
- Dor muscular;
- Osteoporose (pode levar a fraturas);
- Depressão;
- Ganho de peso;
- Queda de cabelo;
- Sangramento vaginal;
- Pele seca;
- Pressão alta;
- Dor abdominal;
- Dor nas costas;
- Quedas;
- Palpitações;
- Rigidez articular;
- Dor no peito.
Informe seu médico se forem intensos.
Reações Incomuns
- Problemas nervosos (ansiedade, nervosismo, irritabilidade, sonolência, problemas de memória, insônia);
- Dor/ardor nas mãos ou pulsos (síndrome do túnel do carpo);
- Alterações na sensibilidade;
- Irritação ocular;
- Coceira com erupção (urticária);
- Corrimento ou ressecamento vaginal;
- Dor mamária;
- Febre;
- Sede, alteração do paladar, boca seca;
- Ressecamento das mucosas;
- Perda de peso;
- Infecção urinária, aumento da frequência urinária;
- Tosse;
- Alterações nos testes de função hepática;
- Aumento da bilirrubina (urina escura);
- Icterícia (pele/olhos amarelados).
Reações de Frequência Desconhecida
- Dedo em gatilho (trava na posição dobrada).
Informe seu médico se forem intensos.
Comunique qualquer reação não listada nesta bula.
Informe profissionais de saúde sobre reações indesejadas.
Apresentações do Breelet
Medicamento similar equivalente ao medicamento de referência.
Comprimidos revestidos 2,5 mg
Embalagem com 30 comprimidos revestidos.
Uso oral.
Para adultos.
Composição do Breelet
Cada comprimido revestido contém:
2,5 mg de letrozol.
Excipientes: lactose monoidratada, amidoglicolato de sódio, celulose microcristalina, hipromelose, sílica coloidal anidra, estearato de magnésio, dióxido de titânio, macrogol, óxido de ferro amarelo, óxido de ferro vermelho, amarelo de tartrazina laca de alumínio.
Superdosagem de Breelet: O Que Fazer?
Em caso de overdose ou ingestão acidental, procure imediatamente médico ou hospital. Leve a embalagem. Pode ser necessário tratamento médico.
Em ingestão excessiva, busque socorro médico e leve a embalagem/bula. Ligue para 0800 722 6001 para orientações.
Interações Medicamentosas do Breelet
Informe seu médico ou farmacêutico sobre todos os medicamentos em uso, inclusive sem prescrição.
Interações Relevantes:
- Tamoxifeno;
- Outros antiestrogênios ou tratamentos com estrogênios.
Essas substâncias podem reduzir a eficácia do Breelet.
Informe seu médico sobre todos os medicamentos em uso.
Não use outros remédios sem orientação médica.
Farmacologia: Ação da Substância de Breelet
Resultados de Eficácia
Tratamento Adjuvante
Estudo BIG 1-98 (CFEM345 0019)
Estudo multicêntrico duplo-cego com mais de 8000 mulheres na pós-menopausa com câncer de mama inicial receptor-positivo. Pacientes foram randomizadas para: A. tamoxifeno 5 anos; B. Letrozol 5 anos; C. tamoxifeno 2 anos seguido de Letrozol 3 anos; D. Letrozol 2 anos seguido de tamoxifeno 3 anos.
Objetivo primário: sobrevida livre de doença (SLD). Secundários: tempo para metástase à distância (TMD); sobrevida livre de doença à distância (SLDD); sobrevida global (SG).
Resultados com seguimento mediano de 26 e 60 meses
Taxas de SLD em 5 anos: 84% para Letrozol vs 81,4% para tamoxifeno.
Tabela 1 – Análise principal: Sobrevida livre de doença e sobrevida global (população ITT)
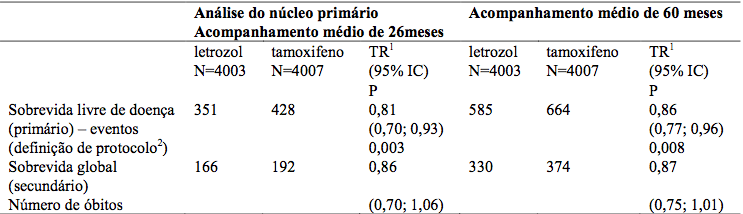
TR = Taxa de risco.
IC = Intervalo de confiança.
1 Teste de “log rank”, estratificado.
2 Eventos SLD: recorrência locorregional, metástase, câncer contralateral, segundo tumor primário, morte sem evento prévio.
Resultados no seguimento médio de 96 meses (braços monoterapia)
Confirmação de redução significativa no risco de recorrência com Letrozol vs tamoxifeno.
Tabela 2 - Monoterapia: sobrevida livre de doença e sobrevida global (população ITT)
| Letrozol N=2463 | Tamoxifeno N=2459 | Taxa de Risco1 (95% IC) | Valor P | |
Eventos de sobrevida livre de doença2 | 626 | 698 | 0,87 (0,78; 0,97) | 0,01 |
Tempo de metástase à distância2 | 301 | 342 | 0,86 (0,74; 1,01) | 0,06 |
Sobrevida global3 | 393 | 436 | 0,89 (0,77; 1,02) | 0,08 |
Análise censurada de SLD4 | 626 | 649 | 0,83 (0,74; 0,92) | |
Análise censurada de SG4 | 393 | 419 | 0,81 (0,70; 0,93) |
1 Teste de “log rank”.
2 Eventos SLD: recorrência, metástase, câncer contralateral, segundo tumor, morte sem evento.
3 Óbitos.
4 Censura na troca para Letrozol.
Análises de Tratamentos Sequenciais
Sem diferenças significativas entre sequências e monoterapia.
Tabela 3 - Tratamento sequencial vs monoterapia com Letrozol (população troca)
| N | Eventos1 | Taxa de risco2 | (97.5% IC) | Valor P | |
[Letrozol→] Tamoxifeno | 1.460 | 254 | 1,03 | (0,84; 1,26) | 0,72 |
Letrozol | 1.463 | 249 | - | - | - |
1 Definição de protocolo.
2 Ajustado por quimioterapia.
Sem diferenças significativas nos objetivos secundários.
Tabela 4 - Sobrevida livre de doença (população ITT)
| - | Letrozol → tamoxifeno | Letrozol |
Pacientes | 1.540 | 1.546 |
| - | Letrozol → tamoxifeno | Tamoxifeno2 |
Pacientes | 1.540 330 0,92 (0,75;1,12) | 1.548 |
1 Ajustado por quimioterapia.
2 40% trocaram seletivamente para Letrozol.
Tabela 5 - Monoterapia adjuvante: reações adversas com diferenças significativas
Letrozol | Tamoxifeno | |||
| Durante tratamento (5 anos) | Após randomização (96 meses) | Durante tratamento (5 anos) | Após randomização (96 meses) | |
Fratura óssea | 10,2% | 14,7% | 7,2% | 11,4% |
Osteoporose | 5,1% | 5,1% | 2,7% | 2,7% |
Eventos tromboembólicos | 2,1% | 3,2% | 3,6% | 4,6% |
Infarto do miocárdio | 1,0% | 1,7% | 0,5% | 1,1% |
Hiperplasia/câncer endometrial | 0,2% | 0,4% | 2,3% | 2,9% |
Tabela 6 - Tratamento sequencial vs monoterapia com Letrozol: reações adversas significativas
| Monoterapia Letrozol 5 anos | Letrozol->Tamoxifeno 2+3 anos | Tamoxifeno->Letrozol | |
| N=1535 | N=1527 | N=1541 | |
Fraturas ósseas | 10,0% | 7,7%* | 9,7% |
Distúrbios endometriais | 0,7% | 3,4%** | 1,7%** |
Hipercolesterolemia | 52,5% | 44,2%* | 40,8%* |
Ondas de calor | 37,6% | 41,7%** | 43,9%** |
Sangramento Vaginal | 6,3% | 9,6%** | 12,7%** |
* Significativamente menor vs monoterapia.
**Significativamente maior vs monoterapia.
Estudo CFEM345D2407
Estudo aberto randomizado comparando efeitos de Letrozol e tamoxifeno sobre densidade mineral óssea (DMO) e perfil lipídico. Após 2 anos, redução mediana de 4,1% na DMO lombar com Letrozol vs aumento de 0,3% com tamoxifeno. Nenhuma paciente com DMO normal desenvolveu osteoporose. Efeitos lipídicos favoráveis ao tamoxifeno.
Estudo FACE (CFEM345D2411)
Estudo fase IIIb aberto comparando Letrozol e anastrozol em câncer de mama inicial com linfonodos positivos. Sem diferenças significativas em sobrevida livre de doença (SLD) ou sobrevida global (SG).
Tratamento Adjuvante Estendido
Estudo MA-17 (CFEM345MA17)
Estudo duplo-cego com mulheres na pós-menopausa que completaram 5 anos de tamoxifeno, randomizadas para Letrozol ou placebo por 5 anos. Letrozol reduziu risco de recorrência em 42% vs placebo.
Tabela 7 - Sobrevida livre de doença e sobrevida global (população ITT modificada)
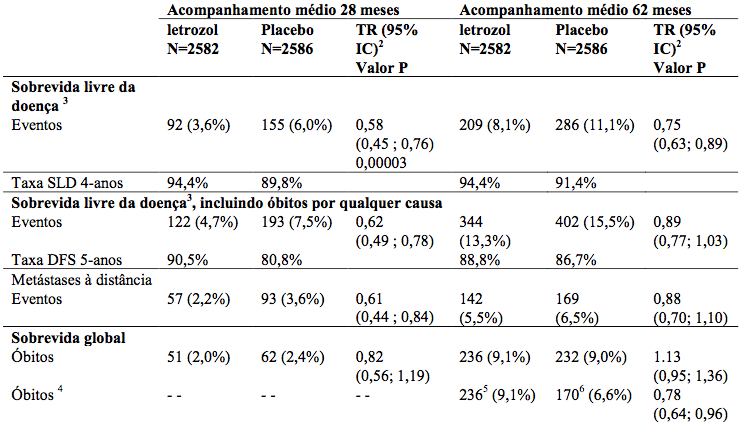
TR= taxa de risco.
IC = intervalo de confiança.
1 60% do grupo placebo trocou para Letrozol.
2 Eventos SLD: recorrência locorregional, metástase, câncer contralateral.
3 Análise censurando na troca.
4 Seguimento médio 62 meses.
5 Seguimento médio até troca: 37 meses.
Estudo MA-17R (CFEM345MA17E1)
Estudo duplo-cego com mulheres após 5 anos de inibidor de aromatase, randomizadas para Letrozol ou placebo por mais 5 anos. Letrozol reduziu risco de recorrência em 34% vs placebo (HR 0,66).
Tratamento Neoadjuvante
Estudo CFEM345E P024
Estudo duplo-cego com 337 pacientes. Resposta objetiva: 55% com Letrozol vs 36% com tamoxifeno (P <0,001). 45% das pacientes com Letrozol vs 35% com tamoxifeno foram submetidas à cirurgia conservadora.
Tratamento de Primeira Linha
Estudo CFEM345C P025
Estudo duplo-cego comparando Letrozol e tamoxifeno em câncer de mama avançado. Letrozol superior em tempo até progressão (TTP), resposta objetiva e benefício clínico.
Tabela 8 - Resultados principais
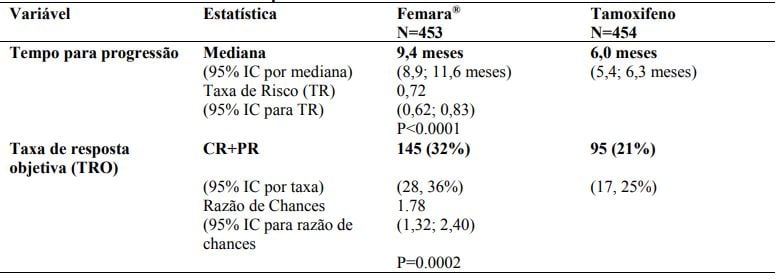
Tratamento de Segunda Linha
Estudos mostraram superioridade do Letrozol 2,5 mg vs megestrol e aminoglutetimida em tempo até progressão e resposta tumoral.
Estudo FEM-INT-01
Estudo aberto randomizado: Letrozol significativamente mais eficaz que anastrozol em taxa de resposta objetiva (19% vs 12%, P=0,013).
Câncer de Mama Masculino
Não estudado.
Referências bibliográficas
1. Clinical Study Report, Study No.CFEM345D019 (BIG1-98).
2. Clinical Expert Statement - Study BIG 1-98.
3. Clinical Expert Statement - Study D2407.
4. Clinical Study Report, Study No.CFEM345DMA17.
5. Clinical Overview for Femara.
6. Expert Statement - Study MA-17.
7. Abbreviated Summary of Clinical Safety.
8. Clinical Overview.
9. Clinical Study Report, Study No. 2026701025.
10. Expert Report.
11. Trial Protocol No. AR/BC2.
12. Trial Protocol No. AR/BC2 Extension.
13. Clinical Trial Report - AR/BC3.
14. Clinical Trial Report - AR/BC3 - Primary Analysis.
15. Clinical Trial Report AR/BC3 Supplement.
16. Clinical Study Report, Study 2026705024.
17. Rationale for changes to Core Data Sheet.
Características Farmacológicas
Grupo farmacoterapêutico: Inibidor não-esteroidal da aromatase; antineoplásico (código ATC: L02B G04).
Mecanismo de Ação
Suprime a biossíntese de estrogênio ao inibir competitivamente a enzima aromatase, reduzindo os níveis de estrogênio em tecidos periféricos e tumorais.
Farmacodinâmica
Em mulheres na pós-menopausa, doses únicas de 0,1-2,5 mg reduzem estrona e estradiol sérico em 75-78%. Supressão máxima em 48-78h. Em câncer de mama avançado, doses diárias de 0,1-5 mg suprimem estradiol em 75-95%.
Não afeta esteroidogênese adrenal, androgênios, LH, FSH ou função tireoidiana.
Farmacocinética
Absorção
Biodisponibilidade absoluta: 99,9%. Alimentação retarda absorção sem alterar extensão.
Distribuição
Ligação a proteínas plasmáticas: ~60%. Volume de distribuição: ~1,87 L/kg.
Biotransformação
Metabolizado principalmente a carbinol (inativo) via CYP3A4 e CYP2A6.
Eliminação
Meia-vida terminal: 2-4 dias. Estado estável alcançado em 2-6 semanas.
Populações Especiais
Idosos: Sem efeito.
Insuficiência renal (CLcr ≥10 mL/min): Sem ajuste necessário.
Insuficiência hepática grave (Child-Pugh C): Exposição aumentada. Monitorar cuidadosamente.
Dados Pré-Clínicos
Baixa toxicidade aguda. Estudos de carcinogenicidade não mostraram tumores relacionados. Potencial teratogênico observado em ratas.
Armazenamento do Breelet
Conservar em temperatura ambiente (15°C a 30ºC). Proteger da umidade.
Lote e validade: ver embalagem.
Não use após o vencimento. Mantenha na embalagem original.
Características Físicas
Comprimido revestido, circular, biconvexo, amarelo, liso em ambas as faces.
Se observar alterações no aspecto, consulte o farmacêutico.
Mantenha fora do alcance de crianças.
Dizeres Legais do Breelet
MS 1.0646.0219
Farm. Resp.:
Maurício Ribeiro Miguel
CRF-SP Nº 26.565
Importado e registrado por:
Laboratório Químico Farmacêutico Bergamo Ltda.
Rua Rafael de Marco, 43 – Pq. Industrial – Jd. das Oliveiras.
Taboão da Serra – SP
CNPJ: 61.282.661/0001-41
Fabricado e embalado por:
SAG Manufacturing, S.L.U.
Madrid - Espanha
Venda sob prescrição médica.

 Revisado clinicamente por: Isabelle Baião de Mello Neto (CRF-MG 24309). Atualizado em: 01 de outubro de 2025.
Revisado clinicamente por: Isabelle Baião de Mello Neto (CRF-MG 24309). Atualizado em: 01 de outubro de 2025.