Qual a ação da substância do Zemplar?
Resultados de Eficácia
Estudos em pacientes com insuficiência renal crônica (IRC) estágio 5 mostraram que Paricalcitol suprime sem diferenças significantes na incidência de hipercalcemia ou hiperfosfatemia quando comparado com o placebo. No entanto, os níveis séricos de fósforo, cálcio e o produto CaXP podem aumentar quando Paricalcitol é administrado.
Em três estudos placebo-controlado1, Fase III, de 12 semanas, em pacientes com insuficiência renal crônica em diálise, Paricalcitol foi introduzido a 0,04 mcg/kg, três vezes por semana. A dose foi aumentada em 0,04 mcg/kg, a cada duas semanas até que os níveis de hormônio paratireóide intacto (PTHi) diminuíssem pelo menos 30% sobre o valor basal, ou até que o quinto aumento levasse a uma dose de 0,24 mcg/kg, ou que o PTHi caísse para menos que 100 pg/mL, ou ainda, o produto Ca x P fosse maior que 75, num período de duas semanas, ou o cálcio sérico ultrapasse 11,5 mg/dL, em qualquer momento.
Os pacientes tratados com Paricalcitol alcançaram uma redução média de PTHi de 30% em seis semanas. Nesses estudos, não houve diferença significativa na incidência de hipercalcemia ou de hiperfosfatemia entre pacientes tratados com Paricalcitol e placebo. Os resultados destes estudos estão resumidos abaixo (Tabela 1).
Tabela 1: Resultados dos estudos1
| - | Grupo (Número de Pacientes) | Valor Basal Médio (faixa) | Média (EP) de alteração do valor basal ao resultado final |
| PTHi (pg/mL) | Paricalcitol (n=40) | 783 (291 - 2076) | -379 (43,7) |
| Placebo (n=38) | 745 (320 - 1671) | -69,6 (44,8) | |
| Fosfatase alcalina (U/L) | Paricalcitol (n=31) | 150 (40 - 600) | -41,5 (10,6) |
| Placebo (n=34) | 169 (56 - 911) | +2,6 (10,1) | |
| Cálcio (mg/dL) | Paricalcitol (n=40) | 9,3 (7,2 - 10,4) | +0,47 (0,1) |
| Placebo (n=38) | 9,1 (7,8 - 10,7) | +0,02 (0,1) | |
| Fósforo (mg/dL) | Paricalcitol (n=40) | 5,8 (3,7 - 10,2) | +0,47 (0,3) |
| Placebo (n=38) | 6,0 (2,8 - 8,8) | -0,47 (0,3) | |
| Produto Cálcio X Fósforo | Paricalcitol (n=40) | 54 (32 - 106) | +7,9 (2,2) |
| Placebo (n=38) | 54 (26 - 77) | -3,9 (2,3) |
Em um estudo de 12 semanas2, Fase IV, duplo-cego, randomizado, multicêntrico, Paricalcitol foi administrado em uma dose inicial de 0,04 mcg/kg ou de PTHi basal/80, três vezes por semana, para pacientes com insuficiência renal crônica (IRC estágio 5) em diálise. A dose foi aumentada em 2 mcg a cada 2 semanas até que os níveis de PTHi fossem reduzidos em 30% a 60% em relação aos níveis basais ou que o PTHi reduzisse para valores inferiores a 100 pg/dL, ou o produto Ca x P aumentasse para acima de 75 por duas mensurações consecutivas, ou o cálcio sérico se elevasse para níveis superiores a 11,5 mg/dL em qualquer momento. Os pacientes completariam o estudo se atingissem redução do PTH ≥ 30% em relação aos níveis basais em quatro mensurações consecutivas, ou se apresentassem um único episódio de hipercalcemia, ou completassem 12 semanas de tratamento. Não foram observados episódios de hipercalcemia em ambos os grupos de tratamento. Ambos os métodos de determinação da dose se mostraram seguros e efetivos. Os resultados estão apresentados abaixo (Tabela 2).
Tabela 2: Resultados do estudo2
| Parâmetro | PTH/80 (n=64) | 0,04 mcg/kg (n=61) |
| Incidência de hipercalcemia | 0 | 0 |
| Mediana de Dias para a Primeira de 4 Reduções do PTHi ≥ 30% | 31a | 45 |
| Mediana do Número de Ajustes de Doseb | 2 | 3 |
| Incidências de Ca x P > 75 | 5 (7,8%) | 2 (3,3%) |
a Estatísticamente significativo (p= 0,0306).
b Para a primeira redução de 4 ≥ 30% do PTHi.
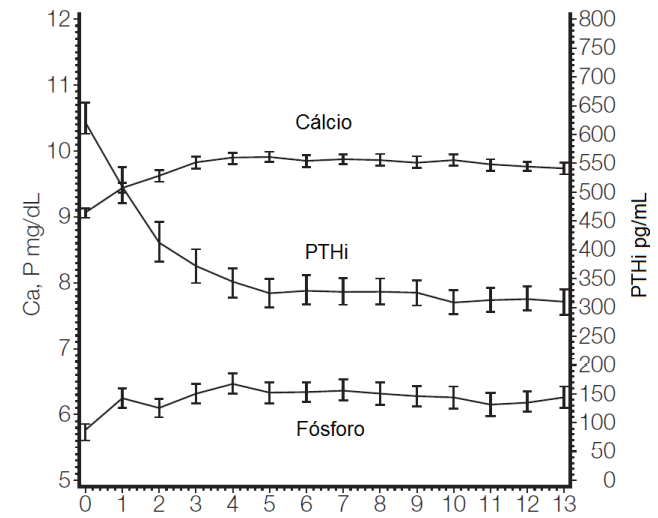
Um estudo de segurança aberto de longo prazo em 164 pacientes com insuficiência renal crônica estágio 5 (dose média de 7,5 mcg três vezes por semana) demonstrou que os níveis séricos médios de Ca, P e do produto Ca x P ficaram com faixas clinicamente apropriadas com a redução do PTH (redução média de 319 pg/mL no 13º mês).3
Referências Bibliográficas
1 - Martin KJ, González EA, Gellens M, Hamm LL, Abboud H, Lindberg J. 19-Nor-1-α-25- Dihydroxyvitamin D2 (Paricalcitol) Safely and Effectively Reduces the Levels of Intact Parathyroid Hormone in Patients on Hemodialysis. J Am Soc Nephrol. 1998; 9:1427-1432.
2 - Martin KJ, González E, Lindberg JS, et al. Paricalcitol Dosing According to Body Weight or Severity of Hyperparathyroidism: a Double-Blind, Multicenter, Randomized Study. Am J Kid Dis. 2001 38(5):S57-63.
3 - Lindberg J, Martin KJ, Gonzáles EA, Acchiardo SR, et al. A long-term, multicenter study of the efficacy of Paricalcitol in end-stage renal disease. Clin Nephrol.2001;56(4):315-323.
Características Farmacológicas
Descrição
O Paricalcitol é um análogo sintético do calcitriol, a forma metabolicamente ativa da vitamina D com modificações na cadeia lateral (D2) e A (19-nor) do anel. O Paricalcitol é um pó branco e cristalino quimicamente denominado como 19-nor-1α,3β,25- triidróxi-9,10 secoergosta-5(Z),7(E),22(E)-trieno (C27H44O3).
Propriedades Farmacodinâmicas
O hiperparatireoidismo secundário é caracterizado por uma elevação do hormônio paratireoidiano (PTH) associada a níveis inadequados de vitamina D ativa. A fonte de vitamina D no organismo é a síntese pela pele como vitamina D3 e a dieta com vitamina D2 ou D3. Ambas as vitaminas D2 e D3 necessitam de duas hidroxilações sequenciais no fígado e nos rins para se ligar e ativar o receptor de vitamina D (VDR). O ativador endógeno do VDR, calcitriol, é um hormônio que se liga aos VDRs presentes na glândula paratireoide, intestino, rins e ossos para manter o funcionamento da paratireoide e homeostase de cálcio e fósforo e aos VDRs que se encontram em muitos outros tecidos, incluindo próstata, endotélio e células imunes. A ativação do VDR é essencial para a formação e manutenção óssea adequadas. Em rins deficientes, a ativação da vitamina D é diminuída, resultando no aumento de PTH e, consequentemente, levando ao hiperparatireoidismo secundário e a distúrbios na homeostase do cálcio e fósforo. A diminuição nos níveis de calcitriol e o aumento nos níveis de PTH precedem anormalidades de cálcio e fósforo séricos e afetam a taxa de turnover ósseo, o que pode resultar em osteodistrofia renal. Em pacientes com insuficiência renal crônica, reduções no PTH estão associadas a um impacto favorável na fosfatase alcalina ósseo-específica, turnover ósseo e fibrose óssea. Além de reduzir os níveis de PTH e corrigir o turnover ósseo, a terapia com vitamina D ativa pode prevenir outras consequências da deficiência de vitamina D.
Mecanismo de ação
Estudos pré-clínicos e in vitro demonstraram que as ações biológicas do Paricalcitol são mediadas pela ligação com o VDR, que resulta na ativação seletiva da via de resposta da vitamina D. Vitamina D e Paricalcitol demonstraram reduzir os níveis do hormônio paratireoidiano através da inibição da síntese e secreção de PTH. Níveis reduzidos de 1,25 (OH)2D3 foram observados nos estágios iniciais da insuficiência renal crônica.
O tempo estimado para início da ação terapêutica do Paricalcitol é dependente dos níveis de PTH basal e resposta individual de cada paciente.
No entanto, em 3 estudos clínicos Fase III, duplo-cego, placebo-controlado, pacientes tratados com Paricalcitol, com dose baseada no peso corporal, atingiram uma redução média de PTHi de 30% em 6 semanas. Adicionalmente, em um estudo Fase IV, duplo-cego, duração de 12 semanas, com dose baseada tanto nos níveis de PTHi basal quanto no peso corporal, o tempo médio para a primeira entre quatro reduções ≥ 30% de PTHi foi de 31 dias para a dose baseada no PTHi e 45 dias para a dose baseada no peso corporal.
Farmacocinética
Duas horas após a administração de doses que variam de 0,04 a 0,24 mcg/kg, as concentrações de Paricalcitol diminuíram rapidamente; depois disso, as concentrações de Paricalcitol declinaram log-linearmente, com meia-vida média de cerca de 15 horas. Nenhum acúmulo de Paricalcitol foi observado após doses múltiplas.
Distribuição
Paricalcitol é extensamente ligado a proteínas do plasma (>99%). Em voluntários sadios, o volume de distribuição no estado de equilíbrio (steady state) é de aproximadamente 23,8 L. Após uma dose de 0,24 mcg/kg de Paricalcitol em pacientes com insuficiência renal crônica estágio 5 com necessidade de hemodiálise e diálise peritoneal, a média do volume aparente de distribuição é de aproximadamente 31 a 35 L. A farmacocinética de Paricalcitol foi investigada em pacientes com insuficiência renal crônica (IRC), com necessidade de hemodiálise. O Paricalcitol é administrado como injeção in bolus intravenosa.
Metabolismo
Muitos metabólitos foram detectados na urina e fezes. O Paricalcitol não foi detectado na urina. Dados in vitro sugerem que Paricalcitol é metabolizado por várias enzimas hepáticas e não hepáticas, incluindo CYP24 mitocondrial, assim como CYP3A4 e UGT1A4.
Os metabólitos identificados incluem o produto da 24(R)-hidroxilação (presente em baixos níveis no plasma), assim como 24,26- e 24,28-diidroxilação e glicuronidação direta. Paricalcitol não é um inibidor de CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 ou CYP3A em concentrações de até 50nM (21ng/mL). Notou-se menos de duas induções com CYP2B6, CYP2C9 e CYP3A4 em concentrações semelhantes de Paricalcitol.
Eliminação
Paricalcitol é eliminado principalmente por excreção hepato-biliar. Aproximadamente 63% da radioatividade foi eliminada nas fezes e 19% foi recuperada na urina em voluntários sadios. Nesses voluntários, a média de eliminação da meia-vida de Paricalcitol é cerca de 5 a 7 horas na faixa da dose estudada de 0,04 a 0,16 mcg/kg.
Tabela 3: Parâmetros Farmacocinéticos em pacientes com insuficiência renal crônica (IRC) estágio 5 (dose única de 0,24mcg/kg in bolus intravenosa)
| - | IRC estágio 5-HD (n=14) | IRC estágio 5-PD (n=8) |
| Cmáx (ng/mL) | 1,680 ± 0,511 | 1,832 ± 0,315 |
| AUC(0-∞) (ng.h/mL) | 14,51 ± 4,12 | 16,01 ± 5,98 |
| β (1/h) | 0,050 ± 0,023 | 0,045 ± 0,026 |
| t1/2 (h)a | 13,9 ± 7,3 | 15,4 ± 10,5 |
| CL (L/h) | 1,49 ± 0,60 | 1,54 ± 0,95 |
| Vdβ (L) | 30,8 ± 7,5 | 34,9 ± 9,5 |
HD: hemodiálise.
PD: diálise peritoneal.
a: média harmônica.
±: pseudo desvio padrão.
Populações especiais
Idosos
A farmacocinética de Paricalcitol não foi estudada em pacientes idosos com idade superior a 65 anos.
Crianças
A farmacocinética de Paricalcitol não foi estudada em pacientes com idade inferior a 18 anos.
Sexo
A farmacocinética de Paricalcitol é independente do sexo.
Interações Medicamentosas
Um estudo in vitro indicou que Paricalcitol não é um inibidor da CYP1A2, CYP2A6, CYP2B6, CYP 2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 OU CYP3A em concentrações acima de 50nM (21 ng/mL) (aproximadamente 20 vezes maior do que o obtido após a maior dose testada). Em culturas primárias frescas de hepatócitos, a indução observada em concentrações de Paricalcitol maiores que 50nM foi menor quer duas induções para CYP2B6, CYP2C9 OU CYP3A, onde os controles positivos resultaram em indução de seis a nove vezes. Portanto, não é esperado que Paricalcitol iniba ou induza a eliminação de drogas metabolizadas por estas enzimas.
Interações de injeção de Paricalcitol não foram estudados.
O efeito de múltiplas doses de cetoconazol administradas como 200 mg duas vezes ao dia por cinco dias na farmacocinética de Paricalcitol cápsulas foi estudada em indivíduos sadios. A Cmax de Paricalcitol foi minimamente afetada, porém a AUC0-∞ aproximadamente dobrou na presença de cetoconazol. A meia-vida média do Paricalcitol foi de 17,0 horas na presença de cetoconazol comparado com 9,8 horas quando Paricalcitol é administrado isoladamente.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)