Qual a ação da substância do Zelboraf?
Resultados de Eficácia
A eficácia de Vemurafenibe foi avaliada em 675 pacientes de um estudo clínico Fase III (NO25026)1 e 278 pacientes de dois estudos clínicos Fase II (NP22657 e MO25743). 2,5 Antes da inclusão no estudo, amostras de tumores de todos os pacientes foram testadas para verificar a presença de uma mutação BRAF V600 pelo teste de mutação cobas® 4800 BRAF V600.
Pacientes sem Tratamento Prévio1
Um estudo Fase III, aberto, multicêntrico, internacional, randomizado apoia o uso de Vemurafenibe em pacientes sem tratamento prévio que apresentem melanoma irressecável ou metastático positivo para mutação BRAF V600. Os pacientes foram randomizados para tratamento com Vemurafenibe (960 mg, duas vezes ao dia) ou dacarbazina (1.000 mg/m2 a cada três semanas).
No total, 675 pacientes foram randomizados para Vemurafenibe (n = 337) ou dacarbazina (n = 338). A randomização foi estratificada de acordo com o estágio da doença, DHL, classificação ECOG e região geográfica. As características iniciais foram bem equilibradas entre os grupos de tratamento. Para pacientes randomizados para Vemurafenibe, a maioria dos pacientes era do sexo masculino (59%) e branco (99%), a mediana da idade era de 56 anos (28% tinham 65 anos ou mais), todos os pacientes apresentavam classificação ECOG de 0 ou 1, e a maioria dos pacientes apresentava doença em estágio M1c (66%). Os desfechos co-primários de eficácia do estudo foram sobrevida global (SG) e sobrevida livre de progressão (SLP). Os desfechos-chave secundários incluíram porcentagem de melhor resposta total confirmada (TR) e duração da resposta.
As características iniciais foram bem equilibradas entre os grupos de tratamento. Para pacientes randomizados para Vemurafenibe, a maioria dos pacientes era do sexo masculino (59%) e branco (99%), a mediana da idade era de 56 anos (28% tinham 65 anos ou mais), todos os pacientes apresentavam classificação ECOG de 0 ou 1, e a maioria dos pacientes apresentava doença em estágio M1c (66%). Os desfechos co primários de eficácia do estudo foram sobrevida global (SG) e sobrevida livre de progressão (SLP). Os desfechos-chave secundários incluíram porcentagem de melhor resposta total confirmada (TR) e duração da resposta.
Na análise interina pré-especificada (dados de corte de 30/12/2010), foram observadas melhoras estatística e clinicamente significativas nos desfechos co-primários de sobrevida global (SG) (p < 0,0001) e sobrevida livre de progressão (SLP) (p < 0,0001) (teste log-rank não estratificado). Após recomendação do conselho de monitoramento dos dados de segurança, esses resultados foram divulgados em janeiro de 2011 e o estudo foi modificado para permitir que os pacientes de dacarbazina pudessem passar a receber vemurafenibe (cross-over).
Análises de sobrevivência post-hoc foram realizadas posteriormente, conforme descrito na tabela a seguir:
Tabela 1: Sobrevida global em pacientes não tratados previamente com melanoma que apresente mutação positiva para BRAF V600 no estudo com data de corte (N = 338 dacarbazina, N = 337 vemurafenibe):
| Data de corte | Tratamento | Número de mortes (%) | Razão de risco (Hazard Ratio) (IC 95%) | Número de pacientes cross-over (%) | Mediana de acompanhamento (meses) |
| 30/Dez/2010 | Dacarbazina | 75 (22) | 0,37 (0,26; 0,55) | 0 (não aplicável) | 2,33 |
| Vemurafenibe | 43 (13) | 3,75 | |||
| 31/Mar/2011 | Dacarbazina | 122 (36) | 0,44 (0,33; 0,59) (g) | 50 (15%) | 4,5 |
| Vemurafenibe | 78 (23) | 6,2 | |||
| 03/Out/2011 | Dacarbazina | 175 (52) | 0,62 (0,49; 0,77) (g) | 81 (24%) | 8,4 |
| Vemurafenibe | 159 (47) | 10,5 | |||
| 01/Fev/2012 | Dacarbazina | 200 (59) | 0,70 (0,57; 0,87) (g) | 83 (25%) | 9,5 |
| Vemurafenibe | 199 (59) | 12,5 | |||
| 20/Dez/2012 | Dacarbazina | 236 (70) | 0,78 (0,64; 0,94) (g) | 84 (25%) | 9,2 |
| Vemurafenibe | 242 (72) | 13,4 |
(g) Resultados censurados na época do cross-over.
Resultados não censurados na época do cross-over: 31/Mar/2011: HR (IC 95%) = 0,47 (0,35; 0,62); 03/Out/2011: HR (IC 95%) = 0,67 (0,54; 0,84); 01/Fev/2012: HR (IC 95%) = 0,76 (0,63; 0,93); 20/Dez/2012: HR (IC 95%) = 0,79 (0,66; 0,95).
No momento da atualização de três meses (dados de corte de 31/03/2011), um total de 200 pacientes morreram (78 no braço de Vemurafenibe e 122 no braço de dacarbazina)3 . O tempo mediano de acompanhamento para a SG no grupo de Vemurafenibe foi de 6,2 meses (intervalo 0,4 a 13,9 meses) e no grupo de dacarbazina foi de 4,5 meses (intervalo <0 ,1 a 11,7 meses).
A sobrevida global foi maior no braço de Vemurafenibe, em comparação com o braço de dacarbazina, com razão de risco (Hazard Ratio) de 0,44 (IC 95%: 0,33; 0,59), o que representa redução de 56% do risco de óbito com Vemurafenibe, em comparação com dacarbazina. As estimativas de Kaplan-Meier (K-M) das porcentagens de sobrevida em seis meses foram de 83% (IC 95%: 79%, 87%) para Vemurafenibe e 63% (IC 95%: 57%, 69%) para dacarbazina. No momento da análise, estimativas de K-M para SG mediana para Vemurafenibe não foram alcançadas (IC 95%: 9,6; não alcançado) e para dacarbazina foram 7,9 meses (IC 95%: 7,3; 9,6).
Vinte e quatro meses após o último paciente ser randomizado (data de corte dos dados: 20/12/2012) 1 , foi realizada uma análise post-hoc atualizada da SG. No momento da análise, 478 pacientes tinham morrido (242 no braço de Vemurafenibe e 236 no braço de dacarbazina). O tempo de acompanhamento mediano no braço de Vemurafenibe foi de 13,4 meses (variação de 0,4 a 33,3 meses). A estimativa de K-M para SG mediana para Vemurafenibe foi de 13,6 meses (IC 95%: 12,0; 15,3).
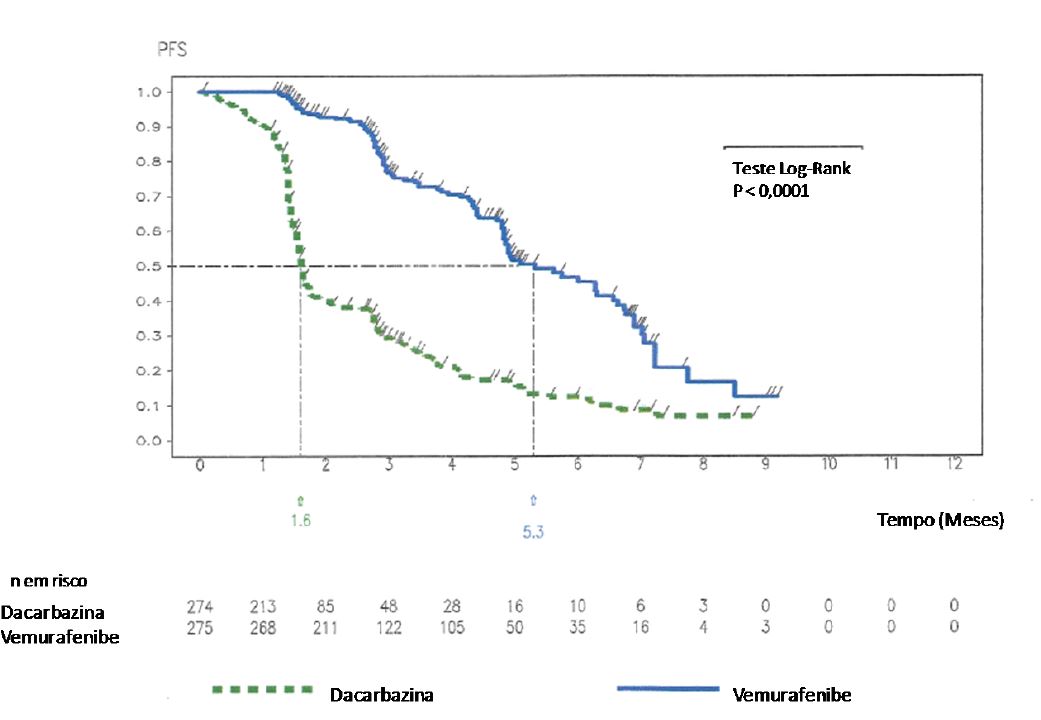
SLP de acordo com avaliação do investigador foi maior com Vemurafenibe, em comparação com dacarbazina, com razão de risco (Hazard Ratio) para progressão ou óbito (SLP) de 0,26 (IC 95%: 0,20; 0,33), o que representa redução de 74% no risco de progressão ou óbito para Vemurafenibe, em comparação com dacarbazina1 . A estimativa de Kaplan-Meier das porcentagens de SLP em seis meses foi de 47% (IC 95%: 38%, 55%) para Vemurafenibe e 12% (IC 95%: 7%, 18%) para dacarbazina. SLP mediana para Vemurafenibe foi de 5,32 meses (IC 95%: 4,86; 6,57) e para a dacarbazina foi de 1,61 meses (IC 95%: 1,58; 1,74). O desfecho secundário de porcentagem de melhor resposta total confirmada (RP + RC), de acordo com avaliação do investigador, foi significativamente melhor (p < 0,0001) no braço de Vemurafenibe (48,4%) (IC 95%: 41,6%, 55,2%), em comparação com o braço de dacarbazina (5,5%) (IC 95%: 2,8%, 9,3%). Doença estável, avaliada de acordo com os critérios internacionais de RECIST 1.1, foi observada em 37% dos pacientes tratados com Vemurafenibe e 24% dos pacientes tratados com dacarbazina.
Melhora em SG, SLP e melhor resposta total confirmada (TR) a favor do tratamento com Vemurafenibe foram geralmente observadas em todos os subgrupos (idade, sexo, DHL inicial, classificação ECOG, estágio de doença metastática) e regiões geográficas.
Os resultados de eficácia estão resumidos na tabela abaixo e Figuras 1 (SG atualizada) e 2 (SLP).
Tabela 2. Eficácia de Vemurafenibe em pacientes sem tratamento prévio com melanoma positivo para mutação BRAF V600:
| --- | Vemurafenibe (n = 337) | Dacarbazina (n = 338) | Valor de pd |
| Sobrevida global* Razão de risco (Hazard Ratio) (IC 95%)a | 0,44 (0,33; 0,59) | < 0,0001 | |
| Sobrevida global mediana (meses) (IC 95%) b | Não alcançado (9,6; não alcançado) | 7,9 (7,3; 9,6) | --- |
| Porcentagem de sobrevida em seis meses (IC 95%)b | 83% (79%, 87%) | 63% (57%, 69%) | --- |
| Sobrevida global atualizada Sobrevida global mediana (meses) (IC 95%)b,c | 13,6 (12,0; 15,3) | 9,7 (7,9; 12,8) | --- |
| Sobrevida livre de progressão Razão de risco (Hazard Ratio) (IC 95%)a | 0,26 (0,20; 0,33) | < 0,0001 | |
| SLP mediana (meses) (IC 95%)b | 5,32 (4,86; 6,57) | 1,61 (1,58; 1,74) | --- |
a Razão de risco estimada usando modelo de Cox; uma razão de risco < 1 favorece Vemurafenibe.
b Estimativa de Kaplan-Meier.
c Resultados atualizados (24 meses após a randomização do último paciente).
d Teste log-rank não estratificado.
Figura 1. Curvas de Kaplan-Meier de sobrevida global atualizadas - pacientes sem tratamento prévio (20/12/2012):
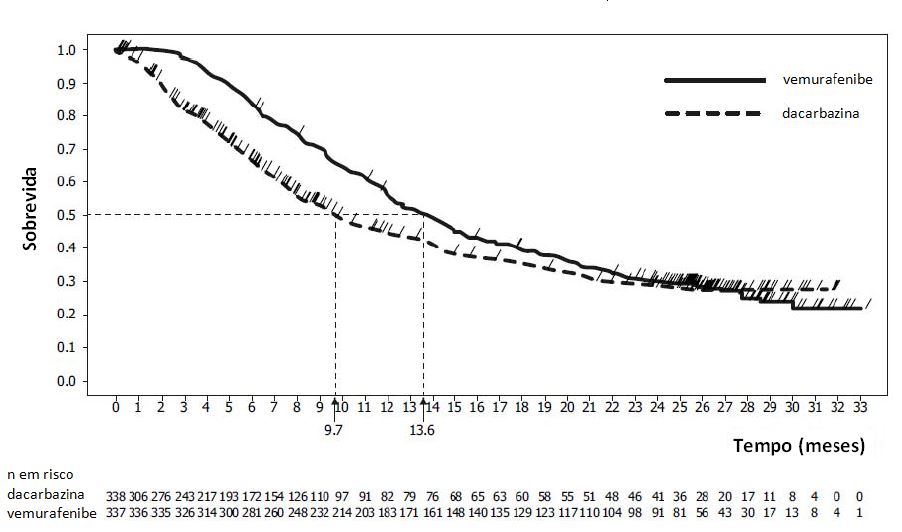
Figura 2. Curvas de Kaplan-Meier de sobrevida livre de progressão - pacientes sem tratamento prévio:
A proporção de pacientes com melhora em seu estado clínico geral de acordo com avaliação médica foi maior no grupo de Vemurafenibe (63,4%) (IC 95%: 57%, 69%) que no grupo de dacarbazina (20,2%) (IC 95%: 15%, 26%).
Pacientes com falha de pelo menos uma terapia sistêmica prévia2,4
Um estudo Fase II de braço único, multicêntrico, multinacional foi conduzido com 132 pacientes com melanoma metastático que tinham recebido pelo menos uma terapia prévia. A idade mediana foi de 52 anos, e 19% dos pacientes tinham mais que 65 anos. A maioria dos pacientes era do sexo masculino (61%), branca (99%) e apresentava doença estágio M1c (61%). Quarenta e nove por cento dos pacientes tinham falhado em duas ou mais terapias prévias.
Com base nos dados com data de corte 01/02/2012, a duração mediana do tratamento foi de 5,7 meses. A duração mediana do acompanhamento foi de 13,4 meses (intervalo de 0,6 a 27,1). O desfecho primário de porcentagem de melhor resposta total confirmada (RP + RC), conforme avaliação de um comitê de revisão independente (CRI), foi de 53% (IC 95%: 44%, 62%). O tempo mediano até a resposta foi de 1,4 meses, com 75% das respostas ocorrendo em torno de 2,6 meses de tratamento. A duração mediana de resposta pelo CRI foi de 7,1 meses (IC 95%: 5,7, 9,8). Foi observada doença estável por RECIST 1.1 em 29% dos pacientes. A sobrevida global mediana foi de 15,9 meses (IC 95%: 11,2; 19,3), e a taxa percentual de sobrevida em seis meses foi de 0,77 (IC 95%: 0,69;0,84) e em um ano foi de 0,58 (IC 95%: 0,48; 0,66). A SLP mediana foi de 6,8 meses (IC 95%: 5,5; 7,9) e a porcentagem de SLP em seis meses foi de 54% (IC 95%: 46%, 63%).
Pacientes com metástases cerebrais
Um estudo Fase II aberto, de braço único e multicêntrico de Vemurafenibe (N=146) foi conduzido em pacientes adultos com melanoma metastático histologicamente confirmado com mutação BRAF V600 e com metástases cerebrais.
O estudo incluiu duas coortes que ocorreram simultaneamente:
- Pacientes não tratados previamente (coorte 1: N = 90): pacientes que não receberam tratamento prévio para metástases cerebrais. Terapia sistêmica prévia para melanoma metastático foi permitida, excluindo inibidores BRAF e inibidores MEK.
- Pacientes tratados previamente (coorte 2: N = 56): pacientes que foram tratados previamente para metástases cerebrais e progrediram após tratamento. Para pacientes tratados com radioterapia estereotáxica ou cirurgia, uma nova lesão cerebral avaliável por RECIST tinha que ter se desenvolvido após o tratamento prévio.
A idade mediana dos pacientes foi de 54 anos (intervalo de 26 a 83 anos) e foi similar nas duas coortes. A maioria dos pacientes era homem (61,6%), similarmente distribuídos entre as duas coortes. Um total de 135 pacientes (92,5%) foram reportados como brancos, sendo que a raça de 11 pacientes (7,5%) não foi reportada, conforme regulamentações locais. O número mediano de lesões cerebrais alvo no ponto basal foi de 2 (intervalo de 1 a 5) em ambas coortes.
O objetivo primário do estudo foi avaliar a eficácia de Vemurafenibe usando melhor resposta total confirmada (TR) no cérebro de pacientes com melanoma metastático com metástases cerebrais não tratadas previamente, como avaliado por um comitê de revisão independente usando o critério de avaliação de resposta em tumores sólidos, versão 1.1 (RECIST 1.1).
O objetivo secundário incluiu avaliação de eficácia de Vemurafenibe usando TR no cérebro de pacientes previamente tratados, duração de resposta, sobrevida livre de progressão (SLP) e sobrevida global (SG) em pacientes com melanoma metastático para o cérebro.
Tabela 3. Eficácia de Vemurafenibe em pacientes com metástases cerebrais:
| --- | Coorte 1 Sem tratamento prévio | Coorte 2 Tratado previamente | Total |
| TRa no cérebro (n) | 90 | 56 | 146 |
| Respondentes (n[%]) (IC 95%)b | 16 (17,8%) (10,5; 27,3) | 10 (17,9%) (8,9; 30,4) | 26 (17,8%) (12,0; 25,0) |
| Duração da respostac no cérebro (n) | 16 | 10 | 26 |
| Mediana (meses) (IC 95%)d | 4,6 (2,9; 6,2) | 6,6 (2,8; 10,7) | 5,0 (3,7; 6,6) |
| SLP -total (n) | 90 | 56 | 146 |
| Mediana (meses)e (IC 95%)d | 3,7 (3,6; 3,7) | 3,7 (3,6; 5,5) | 3,7 (3,6; 3,7) |
| SLP - cérebro apenas (n) | 90 | 56 | 146 |
| Mediana (meses)e (IC 95%)d | 3,7 (3,6; 4,0) | 4,0 (3,6; 5,5) | 3,7 (3,6; 4,2) |
| SG | 90 | 56 | 146 |
| Mediana (meses) (IC 95%)d | 8,9 (6,1; 11,5) | 9,6 (6,4; 13,9) | 9,6 (6,9; 11,5) |
a Melhor resposta total confirmada foi avaliada por um comitê de revisão independente, número de respondentes - n (%).
b Intervalo de confiança (IC) Clopper-Pearson frente e verso de 95%.
c Duração da resposta foi avaliada por um comitê de revisão independente.
d Estimativa Kaplan-Meier.
e Avaliada por um investigador.
Referências bibliográficas:
1. Clinical Study Report - NO25026. A randomized, open-label, controlled, multicenter Phase 3 study in previously untreated patients with unresectable Stage IIIc or IV melanoma with V600E BRAF mutation receiving RO5185426 or dacarbazine. Research Report Number 1039652. April 2011 (CDS Vs 1.0) OS update, Research Report Number 1055972, July 2013 (CDS Vs. 3.0).
2. Clinical Study Report - NP22657. An Open-Label, Multi-Center, Phase II Study of Continuous Oral Dosing of RO5185426 in Previously Treated Patients With Metastatic Melanoma. Report No. 1038633. April 2011 (CDS Vs 1.0).
3. Efficacy Update for Vemurafenib (RO5185426): NDA 202429. June 2011. (CDS Vs 2.0).
4. Final Clinical Study Report – NP22657 - An Open-Label, Multi-Center Phase II Study of Continuous Oral Dosing of RO5185426 in Previously Treated Patients with Metastatic Melanoma - Report No. 1063919, May 2015 (CDS Vs 8.0).
5. Primary Clinical Study Report - MO25743: An Open-label, Single-arm, Phase II, Multicentre Study to Evaluate the Efficacy of Vemurafenib in Metastatic Melanoma Patients with Brain Metastases. Research Report No. 1061236.
Características Farmacológicas
Propriedades farmacodinâmicas
Mecanismo de ação
Vemurafenibe é um inibidor de quinase serina-treonina BRAF. Mutações no gene BRAF resultam em ativação constitutiva da proteína BRAF, que pode causar proliferação celular sem associação com fatores de crescimento.
Dados não clínicos gerados por testes bioquímicos demonstram que Vemurafenibe pode inibir potentemente as quinases BRAF com ativação de mutações no códon 600 (veja tabela a seguir).
Tabela 4. Atividade quinase inibitória de Vemurafenibe contra diferentes BRAF quinases:
Quinase | Frequência esperada em melanoma com mutação V600 positiva* | Concentração inibitória 50 (nM) |
BRAFV600E | 87,3% | 10 |
BRAFV600K | 7,9% | 7 |
BRAFV600R | 1% | 9 |
BRAFV600D | <0,2% | 7 |
BRAFV600G | <0,1% | 8 |
BRAFV600M | 0,1% | 7 |
BRAFV600A | <0,1% | 14 |
BRAFWT | NA | 39 |
* Estimado de 16.403 melanomas com mutação BRAF no códon 600 na base de dados pública COSMIC, lançamento 71 (novembro 2014).
Este efeito de inibição foi confirmado na fosforilação ERK e testes de anti-proliferação celular em células disponíveis de melanoma expressando mutação BRAF V600. Em testes de anti-proliferação celular, a concentração inibitória 50 (IC50) contra as linhagens celulares mutadas V600 (linhagens celulares mutadas V600E, V600R, V600D e V600K) variou de 0,016 a 1,131 µM, ao passo que IC 50 contra linhagens celulares tipo BRAF selvagem foram 12,06 e 14,32 µM, respectivamente.
Propriedades farmacocinéticas
Os parâmetros farmacocinéticos para Vemurafenibe foram determinados usando análise não compartimental em um estudo Fase I e um estudo Fase III. As médias de Cmáx, Cmín e AUC (área sob a curva)0-12h foram de, aproximadamente, 62 µg/mL, 53 µg/mL e 600 µg*h/mL. A análise de farmacocinética (PK) populacional usando dados agrupados de 458 pacientes estimou a mediana de Cmáx, Cmín e AUC em estado de equilíbrio dinâmico como sendo de 62 µg/mL, 59 µg/mL e 734 µg*h/mL, respectivamente. A estimativa de razão de acumulação mediana para um esquema duas vezes por dia é de 7,36. Demonstrou-se que a farmacocinética de Vemurafenibe é proporcional à dose entre 240 e 960 mg, duas vezes por dia, e a análise de farmacocinética populacional também confirmou que a farmacocinética de Vemurafenibe é linear.
Absorção
Vemurafenibe é absorvido com uma mediana de Tmáx de, aproximadamente, quatro horas após uma dose única de 960 mg (quatro comprimidos de 240 mg). Vemurafenibe apresenta acumulação acentuada depois de administração repetida de 960 mg, duas vezes por dia, com elevada variabilidade entre pacientes. Em um estudo Fase II, a concentração plasmática média de Vemurafenibe, quatro horas depois da administração, aumenta de 3,6 µg/mL no dia 1 até 49,0 µg/mL no dia 15 (intervalo de 5,4 a 118 µg/mL).
A biodisponibilidade de vemurafenibe em estado de equilíbrio dinâmico foi de 57,8% (razão geométrica).
Em estado de equilíbrio dinâmico (alcançado no dia 15 em 80% dos pacientes), a exposição média de Vemurafenibe no plasma é estável (concentrações antes e duas a quatro horas depois da dose matinal), como indicado pela razão média de 1,13. Observou-se variabilidade acentuada entre pacientes com semelhante exposição plasmática em estado de equilíbrio dinâmico, independentemente da redução da dose.
Depois da administração oral, a constante de taxa de absorção para a população de pacientes com melanoma metastático é estimada em 0,19 h-1 (com 101% de variabilidade entre pacientes).
Distribuição
O volume aparente de distribuição populacional de Vemurafenibe em pacientes com melanoma metastático é estimado em 91 L (com variabilidade de 64,8% entre os pacientes). In vitro, Vemurafenibe mostrou-se altamente ligado a proteínas plasmáticas humanas (> 99%).
Metabolismo
As proporções relativas de Vemurafenibe e os seus metabólitos foram caracterizados em um estudo de equilíbrio de massa humana com uma dose única de vemurafenibe marcado com C14 administrado oralmente no estado de equilíbrio.
Em média, 95% da dose foi recuperada dentro de 18 dias. A maior parte (94%) nas fezes e < 1% recuperada da urina. Enquanto a CYP3A4 é a enzima primária responsável pelo metabolismo de Vemurafenibe in vitro, metabolitos conjugados (glucuronidação e glicosilação) foram também identificados em humanos. No entanto, o composto-mãe era o componente predominante no plasma (95%). Embora o metabolismo não pareça resultar em uma quantidade relevante de metabólito no plasma, a importância do metabolismo para a excreção não pode ser excluída. A coadministração de itraconazol, um inibidor forte de CYP3A4, aumentou o estado de equilíbrio dinâmico (AUC) de vemurafenibe em, aproximadamente, 40%. A coadministração de rifampicina, um forte indutor de CYP3A4, diminuiu significativamente a exposição plasmática de vemurafenibe (ASC) em, aproximadamente, 40% após uma dose única de 960 mg de Vemurafenibe, sugerindo que a via CYP3A4 poderia ser uma importante via de eliminação para Vemurafenibe.
Início da ação
No estudo NO25026, o tempo até resposta foi avaliado em pacientes com resposta confirmada. Avaliações tumorais foram realizadas a cada 6 semanas nas primeiras 12 semanas e a cada 9 semanas durante o restante do tratamento. Entre os 106 pacientes do braço de Vemurafenibe com resposta confirmada, o tempo mediano até resposta foi de 1,45 mês (variação: 1,0 a 5,5). A maioria desses pacientes (75%) respondeu ao tratamento com Vemurafenibe já na primeira avaliação tumoral pós-basal (1,6 mês).
Eliminação
A eliminação aparente populacional de Vemurafenibe em pacientes com melanoma metastático é estimada em 29,3 L/dia (com variabilidade entre pacientes de 31,9%). A mediana de meia-vida de eliminação individual para Vemurafenibe é de 56,9 horas (o intervalo entre os percentis 5º e 95º é de 29,8 - 119,5 horas).
Farmacocinética em populações especiais
Pacientes geriátricos
Com base na análise de farmacocinética populacional, a idade não tem efeito estatisticamente significativo sobre a farmacocinética de Vemurafenibe.
Sexo
Na análise de farmacocinética populacional, descobriu-se que o sexo é estatisticamente significativo na explicação da variabilidade entre os pacientes, com uma eliminação aparente 17% maior e um volume aparente de distribuição 48% maior em homens. No entanto, os resultados da análise populacional mostraram que as diferenças em exposição são relativamente pequenas (com uma AUC12 horas e Cmáx em estado de equilíbrio dinâmico estimadas de 792 µg*h/mL e 67 µg/mL em mulheres e 696 µg*h/mL e 63 µg/mL em homens, respectivamente), indicando que não existe necessidade de ajuste de dose com base no sexo.
Pacientes pediátricos
Dados farmacocinéticos limitados de seis pacientes adolescentes com idades entre 15 e 17 anos com melanoma estágio IIIC ou IV positivo para mutação BRAF V600 sugerem que as características farmacocinéticas de Vemurafenibe em adolescentes são geralmente semelhantes às dos adultos. No entanto, nenhuma conclusão pode ser feita devido à quantidade limitada de dados.
Insuficiência renal
Na análise farmacocinética populacional usando dados de estudos clínicos em pacientes com melanoma metastático, insuficiência renal leve e moderada não influenciou a eliminação aparente de Vemurafenibe (clearance de creatinina ˃ 30 mL/min). A eventual necessidade de ajuste de dose em pacientes com insuficiência renal grave (clearance de creatinina < 29 mL/min) não pode ser determinada devido à insuficiência de dados clínicos e farmacocinéticos.
Insuficiência hepática
Com base em dados pré-clínicos e estudo de equilíbrio de massa humana, Vemurafenibe é eliminado principalmente pelo fígado. Na análise farmacocinética populacional usando dados dos estudos clínicos em pacientes com melanoma metastático, aumentos na aspartato aminotransferase (AST), alanina aminotransferase (ALT) e bilirrubina total de até 3 vezes o limite máximo da normalidade não influenciou a eliminação aparente de Vemurafenibe. A eventual necessidade de ajuste de dose em pacientes com insuficiência hepática grave não pode ser determinada devido à insuficiência de dados clínicos e farmacocinéticos para determinar o efeito metabólico ou excretor da insuficiência hepática na farmacocinética de Vemurafenibe.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)