Qual a ação da substância do Trodelvy?
Resultados de Eficácia
A eficácia e segurança do sacituzumabe govitecana foi avaliada no ASCENT (IMMU-132-05), um estudo internacional de Fase 3, multicêntrico, aberto, randomizado, conduzido em 529 pacientes com câncer de mama triplo-negativo irressecável, localmente avançado ou metastático (CMTNm) que tiveram recidiva após pelo menos duas quimioterapias anteriores (sem limite superior) para câncer de mama. Terapia adjuvante ou neoadjuvante anterior para doença mais limitada qualificada como um dos tratamentos prévios necessários se o desenvolvimento de doença irressecável, localmente avançada ou metastática ocorreu dentro de um período de 12 meses após a conclusão da quimioterapia. Todos os pacientes receberam tratamento prévio com taxano em estágio adjuvante, neoadjuvante ou avançado, a menos que tivessem uma contraindicação ou fossem intolerantes aos taxanos. Permitiram-se inibidores da poli-ADP-ribose-polimerase (PARP) como uma das duas quimioterapias anteriores para pacientes com uma mutação nos genes BRCA1/BRCA2 documentada.
Os pacientes foram randomizados (1:1) para receber 10 mg/kg de sacituzumabe govitecana como uma infusão intravenosa no Dia 1 e no Dia 8 de um ciclo de tratamento de 21 dias ou o tratamento de escolha do médico (TEM) que foi dosado com base na área de superfície corporal e de acordo com a bula aprovada. O TEM foi determinado pelo investigador antes da randomização de um dos seguintes regimes de agente único: eribulina (n = 139), capecitabina (n = 33), gencitabina (n = 38) ou vinorelbina (exceto se o paciente tivesse neuropatia ≥ Grau 2, n = 52). Pacientes com metástases cerebrais estáveis (com tratamento prévio, não progressiva, sem medicamentos anticonvulsivantes e em dose estável de corticoide por pelo menos 2 semanas) foram elegíveis. A ressonância magnética por imagem (RMI) para determinar as metástases cerebrais foi necessária apenas para pacientes com metástases cerebrais conhecidas ou suspeitas. Pacientes com doença de Gilbert conhecida, com doença óssea metastática exclusiva, história conhecida de angina instável, infarto do miocárdio, ou insuficiência cardíaca congestiva, doença intestinal inflamatória crônica ativa ou perfuração gastrointestinal (GI), doença do vírus da imunodeficiência humana (HIV), infecção ativa de hepatite B ou C, vacina de vírus vivo dentro de 30 dias, ou que receberam irinotecano previamente foram excluídos.
Os pacientes foram tratados até a progressão da doença ou toxicidade inaceitável. O desfecho primário de eficácia foi a sobrevida livre de progressão (SLP) em pacientes sem metástases cerebrais no início (ou seja, BMNeg), conforme medido por um grupo de revisão cego, independente e centralizado (blinded, independent, centralised review - BICR) de especialistas em radiologia usando os critérios de avaliação de resposta em tumores sólidos (RECIST) v1.1. Os desfechos secundários de eficácia incluíram SLP por BICR para a população global, incluindo todos os pacientes com e sem metástases cerebrais, sobrevida global (SG), taxa de resposta objetiva (TRO) e duração de resposta (DR).
A análise primária incluiu 235 pacientes BMNeg no grupo de sacituzumabe govitecana e 233 pacientes BMNeg no grupo do TEM. A análise da população global incluiu 267 pacientes no grupo de sacituzumabe govitecana e 262 pacientes no grupo do TEM.
Os dados demográficos e as características basais da população global (n=529) foram: idade mediana de 54 anos (variação: 27–82 anos) e 81% < 65 anos; 99,6% feminino; 79% branco; 12% negro; o número médio de terapias sistêmicas anteriores foi 4; 69% já haviam recebido 2 a 3 quimioterapias anteriores; 31% haviam recebido anteriormente > 3 quimioterapias anteriores; 42% apresentavam metástases hepáticas; 12% apresentavam ou tinham histórico de metástases cerebrais; 8% tinham status mutacional BRCA1/BRCA2 positivo; o status de BRCA estava disponível para 339 pacientes. No início do estudo, todos os pacientes tinham um status de desempenho ECOG de 0 (43%) ou 1 (57%). O tempo médio desde o diagnóstico do Estágio 4 até a entrada no estudo foi de 16,2 meses (intervalo: -0,4 a 202,9 meses). As quimioterapias anteriores mais frequentes foram ciclofosfamida (83%), antraciclina (83%), incluindo doxorrubucina (53%), paclitaxel (78%), carboplatina (65%), capecitabina (67%), gencitabina (36%), docetaxel (35%) e eribulina (33%). No geral, 29% dos pacientes haviam recebido terapia PD1/PD-L1 anterior. Treze por cento dos pacientes no grupo de sacituzumabe govitecana na população global receberam somente uma linha prévia de terapia sistêmica no contexto de doença metastática.
Os resultados de eficácia na população BMNeg demonstraram melhora estatisticamente significativa de sacituzumabe govitecana em relação ao TEM em SLP e SG com razão de risco (RR) de 0,41 (n=468; IC de 95%: 0,32, 0,52; valor de p: <0.0001) e 0,48 (n=468; IC de 95%: 0,38, 0,59; valor de p: <0.0001), respectivamente. A mediana de SLP foi 5,6 meses versus 1,7 meses; a mediana de SG foi 12,1 meses versus 6,7 meses, em pacientes tratados com sacituzumabe govitecana e TEM, respectivamente.
Os resultados de eficácia na população global foram consistentes com a população BMNeg na análise final pré-especificada (data de corte 11 de março de 2020) e estão resumidos na Tabela 1.
Tabela 1: Desfechos de Eficácia (População global) – Análise final pré-especificada
| Análise final pré-especificada (data de corte 11 de março de 2020) | ||
| Sacituzumabe govitecana n=267 | Tratamento da escolha do médico (TEM) n=262 | |
| Sobrevida Livre de Progressão (SLP)1 | ||
| Número de eventos (%) | 190 (71,2) | 171 (65,3) |
| SLP mediana em meses (IC de 95%) | 4,8 (4,1,5,8) | 1,7 (1,5, 2,5) |
| Razão de Risco (IC de 95%) | 0,43 (0.35, 0,54) | |
| Valor de p2 | <0,0001 | |
| Sobrevida Global (SG) | ||
| Número de mortes (%) | 179 (67,0) | 206 (78,6) |
| SG mediana em meses (IC de 95%) | 11,8 (10,5, 13,8) | 6,9 (5,9, 7,7) |
| Razão de Risco (IC de 95%) | 0,51 (0,41, 0,62) | |
| Valor de p2 | <0,0001 | |
| Taxa de Resposta Global (TRG) | ||
| Número de respondedores (%) | 83 (31) | 11 (4) |
| Razão de Risco (IC de 95%) | 10,99 (5,66, 21,36) | |
| Valor de p3 | <0,0001 | |
| Resposta completa, n (%) | 10 (4) | 2 (1) |
| Resposta parcial, n (%) | 73 (27) | 9 (3) |
| Duração de Resposta (DR) | ||
| DR mediana em meses (IC de 95%) | 6,3 (5,5, 9,0) | 3,6 (2,8, NE) |
1 SLP é definida como o tempo desde a data da randomização até a data da primeira progressão radiológica da doença ou morte por qualquer causa, o que ocorrer primeiro.
2 Teste de log-rank estratificado ajustado para fatores de estratificação: número de quimioterapias prévias, presença de metástases cerebrais conhecidas no início do estudo e região.
3 Baseado no teste Cochran-Mantel-Haenszel (CMH).
IC = Intervalo de confiança.
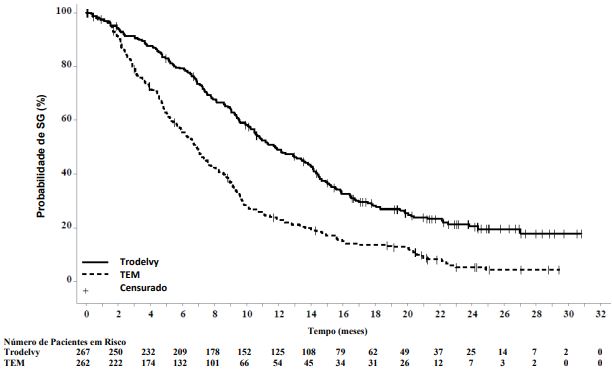
Em uma análise de eficácia atualizada (fechamento final do banco de dados em 25 de fevereiro de 2021), os resultados foram consistentes com a análise final pré-especificada. A mediana de SLP por BICR foi 4,8 meses versus 1,7 meses, em pacientes tratados com sacituzumabe govitecana e TEM, respectivamente (RR de 0,41; IC de 95%: 0,33, 0,52). A mediana da SG foi 11,8 meses versus 6,9 meses, respectivamente (RR de 0,51; IC de 95%: 0,42, 0,63). As curvas de Kaplan-Meier para a SLP por BICR e SG atualizadas estão apresentadas nas Figuras 1 e 2.
Figura 1: Sobrevida Livre de Progressão (população global; fechamento final do banco de dados em 25 de fevereiro de 2021) por BICR
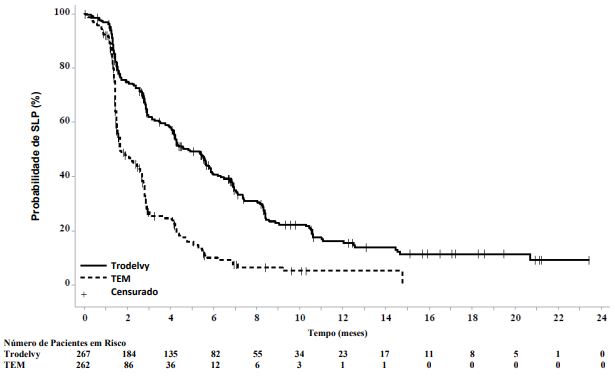
Figura 2: Sobrevida Global (população global; fechamento final do banco de dados em 25 de fevereiro de 2021)
Análise de subgrupo
Nas análises de subgrupo, a melhora na SLP e SG em pacientes tratados com sacituzumabe govitecana em comparação ao TEM foi consistente em todos os subgrupos de pacientes independentemente da idade, raça, status de BRCA, número de terapias sistêmicas prévias em geral (2 e >2, 2-3 e >3) e no contexto de doença metastática (1 e >1), terapia prévia com antraciclina ou PDL1, e metástases hepáticas.
Metástases cerebrais
Uma análise exploratória de SLP e SG em pacientes previamente tratados, com metástases cerebrais estáveis apresentou uma RR estratificado de 0,65 (n=61, IC de 95%; 0,35, 1,22) e 0,87 (n=61; IC de 95%: 0,47, 1,63), respectivamente. A mediana de SLP foi 2,8 meses versus 1,6 meses; a mediana de SG foi 6,8 meses versus 7,5 meses, em pacientes tratados com sacituzumabe govitecana e TEM, respectivamente.
Expressão Trop-2
Análises de subgrupo adicionais foram conduzidas para avaliar a eficácia pelos níveis de expressão tumoral de Trop-2 e os resultados foram consistentes entre os diferentes métodos de pontuação usados. Em pacientes com baixo nível de Trop-2 usando o escore H de membrana por quartis, o benefício de sacituzumabe govitecana em relação ao TEM foi demonstrado tanto para SLP (RR de 0,64; IC de 95%: 0,37, 1,11) quanto para SG (RR de 0,71; IC de 95%: 0,42, 1,21).
Referências bibliográficas
Bardia A, Hurvitz SA, Tolaney SM, et al. Sacituzumab govitecan in metastatic triple-negative breast cancer. N Engl J Med 2021;384:1529-41. DOI: 10.1056/NEJMoa2028485.
Características Farmacológicas
Propriedades farmacodinâmicas
Grupo farmacoterapêutico: Agentes antineoplásicos, anticorpos monoclonais e conjugados de anticorpo-medicamento, outros anticorpos monoclonais, código ATC: L01FX17.
Mecanismo de ação
O sacituzumabe govitecana é um conjugado de anticorpo-medicamento (CAM) direcionado para Trop2. O sacituzumabe é um anticorpo monoclonal humanizado (hRS7 IgG1κ) que reconhece Trop-2. A molécula sintética, SN-38, é um inibidor da topoisomerase I, que é covalentemente ligada ao anticorpo por um ligante hidrolisável. Aproximadamente 7-8 moléculas de SN-38 são ligadas a cada molécula de anticorpo.
O sacituzumabe govitecana liga-se às células cancerígenas que expressam Trop-2 e é internalizado com a liberação subsequente de SN-38 por meio da hidrólise do ligante. O SN-38 interage com a topoisomerase I e impede a religação das quebras de fitas simples induzidas por topoisomerase I. O dano resultante ao DNA leva à apoptose e morte celular.
Propriedades farmacocinéticas
A farmacocinética sérica do sacituzumabe govitecana e do SN-38 foram avaliadas no estudo IMMU132-05 em uma população de pacientes com CMTNm que receberam sacituzumabe govitecana como agente único na dose de 10 mg/kg de peso corporal. Os parâmetros farmacocinéticos do sacituzumabe govitecana e do SN-38 livre são apresentados na Tabela 2.
Tabela 2: Resumo dos parâmetros médios de PK (CV%) do sacituzumabe govitecana e do SN-38 livre
| Sacituzumabe govitecana | SN-38 livre | |
| Cmax [ng/mL] | 240.000 (22,2%) | 90,6 (65,0%) |
| AUC0-168 [ng*h/mL] | 5.340.000 (23,7%) | 2.730 (41,1%) |
Cmax: concentração plasmática máxima.
AUC0-168: área sob a curva de concentração plasmática até 168 horas.
Distribuição
Com base em análises farmacocinéticas populacionais, o volume de distribuição central de sacituzumabe govitecana foi de 2,96 L.
Eliminação
A meia-vida média do sacituzumabe govitecana e do SN-38 livre foi de 15,3 e 19,7 horas, respectivamente. Com base em análises farmacocinéticas populacionais, a depuração do sacituzumabe govitecana é de 0,14L/h.
Metabolismo
Não foram realizados estudos de metabolismo com sacituzumabe govitecana. O SN-38 (a molécula sintética do sacituzumabe govitecana) é metabolizado via UGT1A1.
Populações Especiais
As análises farmacocinéticas em pacientes tratados com sacituzumabe govitecana (n=527) não identificaram um efeito da idade, raça ou insuficiência renal leve na farmacocinética do sacituzumabe govitecana.
Insuficiência Renal
A eliminação renal é conhecida por contribuir minimamente para a excreção do SN-38, a molécula sintética do sacituzumabe govitecana. Não existem dados sobre a farmacocinética do sacituzumabe govitecana em pacientes com insuficiência renal moderada, insuficiência renal grave ou doença renal em estágio final (CrCl ≤ 15 mL/min).
Insuficiência Hepática
A exposição do sacituzumabe govitecana é semelhante em pacientes com insuficiência hepática leve (bilirrubina ≤ LSN e AST > LSN, ou bilirrubina > 1,0 a < 1,5 LSN e AST de qualquer nível; n = 59) a pacientes com função hepática normal (bilirrubina ou AST < ULN; n = 191).
A exposição ao sacituzumabe govitecana é desconhecida em pacientes com insuficiência hepática moderada ou grave. A exposição ao SN-38 pode ser elevada nesses pacientes devido à diminuição da atividade hepática de UGT1A1.
Dados de segurança pré-clínica
O SN-38 foi clastogênico em um teste de micronúcleo de células de mamíferos in vitro em células de ovário de hamster chinês e não foi mutagênico em um ensaio de mutação reversa bacteriana in vitro (Ames).
Em um estudo de toxicidade de dose repetida em macacos cynomolgus, a administração intravenosa do sacituzumabe govitecana resultou em atrofia endometrial, hemorragia uterina, atresia folicular aumentada do ovário e atrofia das células epiteliais vaginais em doses ≥ 60 mg/kg (1,9 vezes a dose recomendada para humanos de 10 mg/kg com base na escala alométrica de peso corporal).
Dados não clínicos para o novo excipiente ácido morfolinoetanossulfônico monoidratado não revelam riscos especiais para os humanos com base em estudos convencionais de toxicidade de dose repetida e genotoxicidade.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)