Qual a ação da substância do Totelle?
Resultados de Eficácia
Estradiol + Trimegestona Ciclo
Vários estudos foram realizados para avaliar a eficácia, a tolerabilidade e a segurança de Estradiol + Trimegestona Ciclo.
Dentre eles destaca-se o estudo de Pornel e Spielmann, um estudo conduzido em 8 países e incluiu 1218 mulheres entre 40 e 65 anos.
Estas mulheres foram randomizadas aleatoriamente para receber Estradiol + Trimegestona, 1 mg de 17 β- estradiol (para uso do 1º ao 14º dia) e 1 mg de 17 β-estradiol e 0,250 mg de trimegestona (para uso do 15º ao 28º dia), 1 mg de 17 β-estradiol (para uso do 1º ao 14º dia) e 1 mg de 17 β-estradiol e 0,125 mg de trimegestona (para uso do 15º ao 28º dia) ou 1 mg de valerato de estradiol (para uso do 1º ao 16º dia) e 1 mg de valerato de estradiol e 1 mg de noretisterona (para uso do 17º ao 28º dia), sendo acompanhadas por 13 ciclos (1 ano), e destas, 531 foram acompanhadas por mais um ano.
Este estudo demonstrou a eficácia de Estradiol + Trimegestona na redução dos sintomas vasomotores, na melhora dos distúrbios psicofuncionais como distúrbio do sono, sintomas urogenitais, alteração de libido, alteração de humor e de concentração, na melhora da qualidade de vida e no índice de Kupperman, assim como na proteção endometrial e também demonstrou favorável perfil de sangramento e ser bem tolerado.
Em outro estudo, Warming e colaboradores, demonstraram a eficiência da associação entre estradiol e trimegestona na prevenção da osteoporose e no aumento da densidade óssea em mulheres na pós-menopausa com osteopenia.
Estradiol + Trimegestona Contínuo
Vários estudos foram realizados para avaliar a eficácia, a tolerabilidade e a segurança de Estradiol + Trimegestona Contínuo. Dentre eles destaca-se o estudo de Gambacciani, Spielmann e Genazzani que demonstrou rápido inicio de ação em melhorar efetivamente os sintomas da menopausa, adequada proteção do endométrio e favorável perfil de sangramento com comprovada segurança.
Da mesma maneira, Bouchard e colaboradores,observaram favorável padrão de sangramento e adequado efeito protetor do endométrio.
Em outro estudo, Warming e colaboradores, demonstraram a eficiência de Estradiol + Trimegestona Contínuo na prevenção da osteoporose e no aumento da densidade óssea em mulheres na pós-menopausa com osteopenia.
Efeitos nos Sintomas Vasomotores
No primeiro ano do estudo Health and Osteoporosis, Progestin and Estrogen (HOPE), um total de 2.805 mulheres na pós-menopausa (idade média de 53,3 ± 4,9 anos) foram randomizadas em um dos oito grupos do tratamento, recebendo placebo ou estrogênios conjugados (ECs), com ou sem acetato de medroxiprogesterona (MPA).
Avaliou-se a eficácia sobre os sintomas vasomotores durante as primeiras 12 semanas de tratamento em um subconjunto de mulheres sintomáticas (n = 241) que apresentaram pelo menos sete episódios de fogachos moderados a graves diariamente, ou pelo menos 50 episódios de fogachos moderados a graves durante a semana anterior à randomização. Demonstrou-se que o alívio da frequência e da gravidade dos sintomas vasomotores moderados a severos foi estatisticamente superior com ECs/MPA (0,625 mg/2,5 mg, 0,45 mg/1,5 mg, 0,3 mg/1,5 mg) em comparação ao placebo nas semanas 4 e 12. A Tabela 1 mostra o número médio ajustado de fogachos nos grupos de tratamento com ECs/MPA (0,625 mg/2,5 mg, 0,45 mg/1,5 mg, 0,3 mg/1,5 mg) e placebo durante o período inicial de 12 semanas.
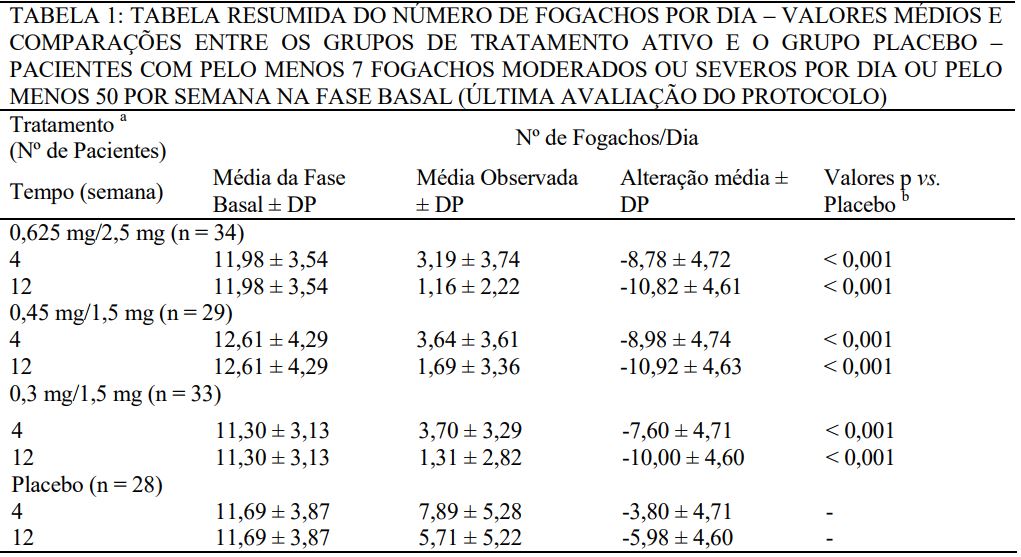
a Identificado pela dosagem (mg) de ECs/MPA ou placebo.
b Não houve diferenças estatisticamente significativas entre os grupos 0,625 mg/2,5 mg, 0,45 mg/1,5 mg e 0,3 mg/1,5 mg em qualquer tempo.
DP = desvio padrão.
Efeitos na Atrofia Vulvar e Vaginal
Os resultados das taxas de maturação vaginal nos ciclos 6 e 13 mostraram que as diferenças com placebo foram estatisticamente significativas (p<0,001) para todos os grupos de tratamento.
Efeitos no Endométrio
Em um estudo clínico randomizado de 1 ano com 1.376 mulheres (idade média de 54 ± 4,6 anos) com ECs 0,625 mg/MPA 2,5 mg (n = 340), ECs 0,625 mg/MPA 5 mg (n = 338), ECs 0,625 mg + MPA 5 mg (n = 351) ou ECs 0,625 mg (ECs 0,625 mg) (n = 347), os resultados de biopsias avaliáveis em 12 meses (n = 279, 274, 277 e 283, respectivamente) mostraram reduzir o risco de hiperplasia endometrial nos dois grupos de tratamento de ECs/MPA (menos que 1%) e no grupo de tratamento de ECs+MPA (menos que 1%; 1% quando foi incluída hiperplasia focal) quando comparados ao grupo com ECs isolados (8%; 20% quando foi incluída hiperplasia focal) (ver Tabela 2).
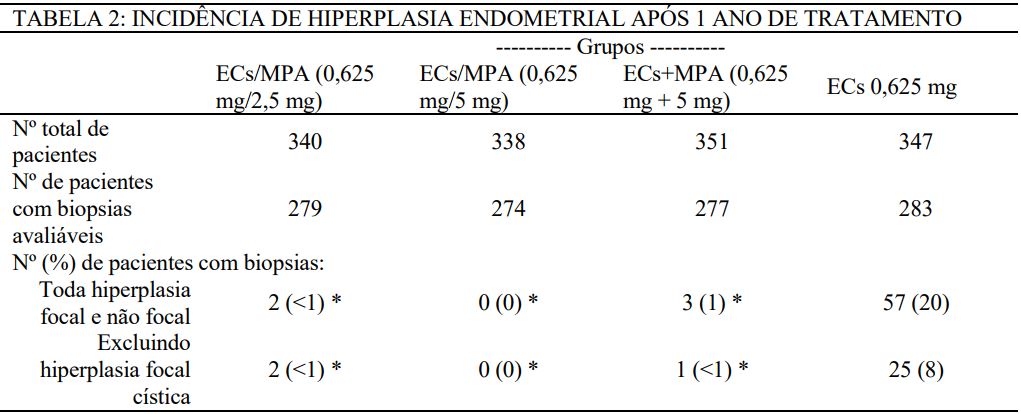
* Significante (p < 0,001) em comparação com ECs (0,625 mg) isolado.
No primeiro ano do estudo Health and Osteoporosis, Progestin and Estrogen (HOPE), 2.001 mulheres (idade média de 53,3 ± 4,9 anos), das quais 88% eram caucasianas, foram tratadas com ECs isolados 0,625 mg (ECs 0,625 mg) (n = 348), ECs isolados 0,45 mg (n = 338), ECs isolados 0,3 mg (ECs 0,3 mg) (n = 326) ou ECs 0,625 mg/MPA 2,5 mg (n = 331), ECs 0,45 mg/MPA 1,5 mg (n = 331) ou ECs 0,3 mg/MPA 1,5 mg (n = 327). Os resultados de biopsias endometriais avaliáveis em 12 meses mostraram reduzir o risco de hiperplasia endometrial ou câncer nos grupos de tratamento com ECs/MPA em comparação aos grupos de tratamento correspondentes com ECs isolados, exceto para os grupos ECs 0,3 mg/MPA 1,5 mg e ECs isolados 0,3 mg (ECs 0,3 mg) no qual houve apenas um caso (ver Tabela 3).
Não foi observada hiperplasia endometrial ou câncer em pacientes tratadas com regime combinado contínuo que continuaram o segundo ano no subestudo de osteoporose e metabolismo do estudo HOPE (ver Tabela 4).
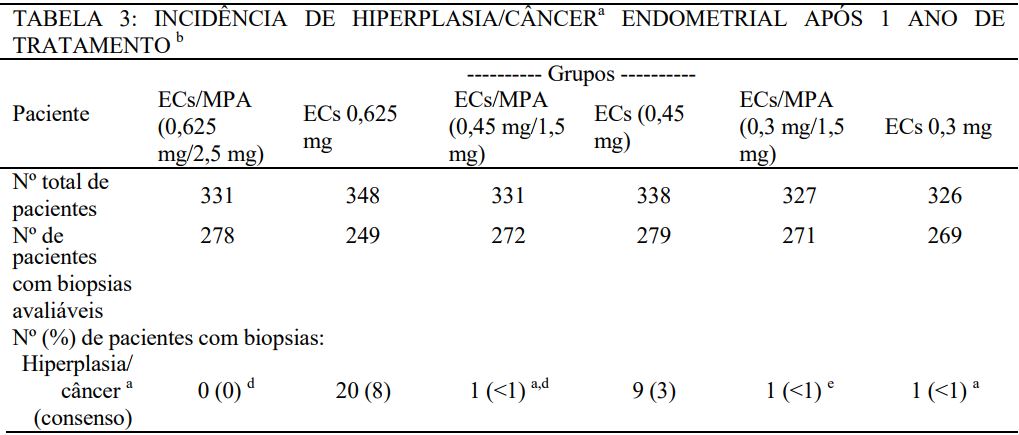
a Todos os casos de hiperplasia/câncer foram hiperplasia endometrial, exceto para uma paciente no grupo ECs 0,3 mg diagnosticada com câncer endometrial na biopsia endometrial e uma paciente no grupo ECs/MPA (0,45 mg/1,5 mg) diagnosticada com câncer endometrial, baseado na biopsia endometrial.
b Dois (2) patologistas primários avaliaram cada biopsia endometrial. Onde houve falta de concordância sobre a presença ou ausência de hiperplasia/câncer entre os dois, um terceiro patologista participou da decisão (consenso).
c Para que uma biopsia endometrial fosse contada como hiperplasia ou câncer endometrial consensual, pelo menos 2 patologistas tinham que concordar com o diagnóstico.
d Significante (p < 0,05) em comparação com a dose correspondente de ECs isoladamente.
e Não significante em comparação com a dose correspondente de ECs isoladamente.
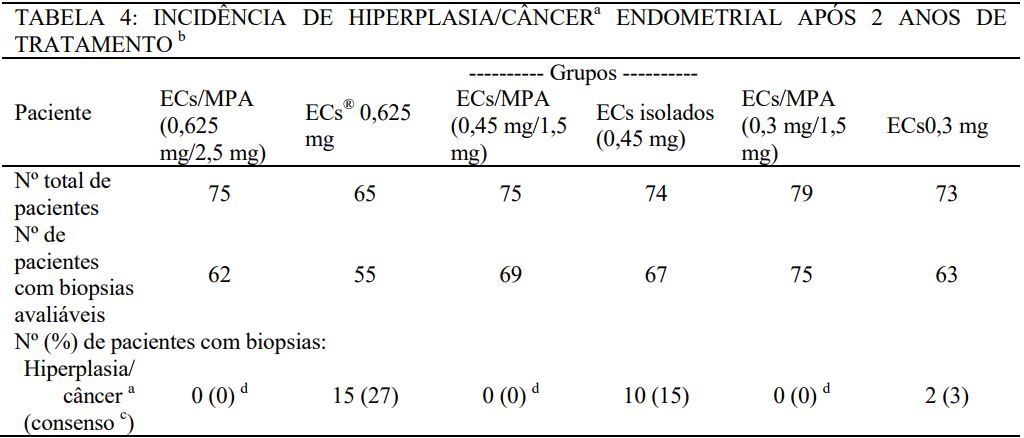
a Todos os casos de hiperplasia/câncer foram hiperplasia endometrial em pacientes que continuarão pelo segundo ano no subestudo de osteoporose e metabolismo do estudo HOPE.
b Dois (2) patologistas primários avaliaram cada biopsia endometrial. Onde houve falta de concordância sobre a presença ou ausência de hiperplasia/câncer entre os dois, um terceiro patologista participou da decisão (consenso).
c Para que uma biopsia endometrial fosse contada como hiperplasia ou câncer endometrial consensual, pelo menos 2 patologistas tinham que concordar com o diagnóstico.
d Significante (p < 0,05) em comparação com a dose correspondente de ECs isoladamente.
Efeitos no Sangramento Uterino ou Spotting
Os efeitos de ECs/MPA no sangramento uterino ou spotting, conforme registrado diariamente em cartões diários, foram avaliados em dois estudos clínicos. Os resultados são mostrados nas Figuras 1 e 2.
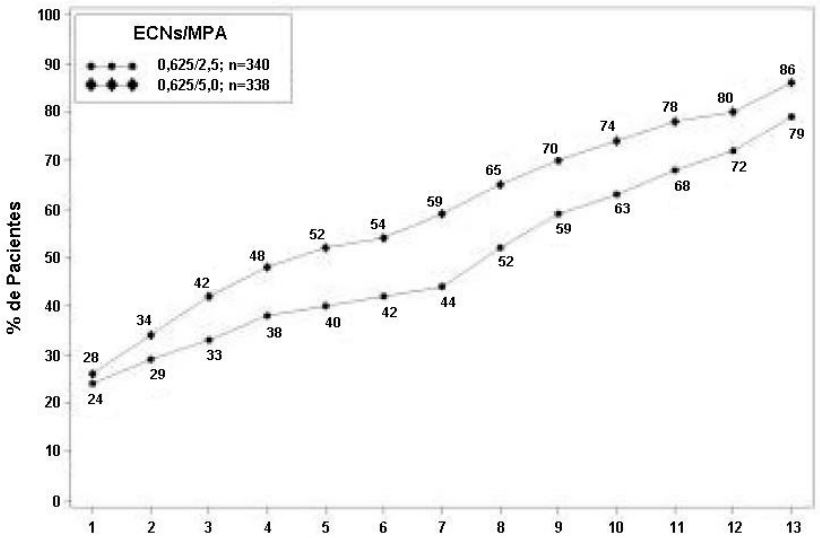
Ciclo
Figura 1. Paciente com amenorreia em ciclos consecutivos ao longo do tempo - porcentagens de mulheres sem sangramento ou spotting em um determinado ciclo até o ciclo 13 na população com intenção de tratar.
Nota: É mostrada a porcentagem de pacientes amenorreicas em um determinado ciclo e até o ciclo 13. Se dados estivessem faltando, era considerado o valor de sangramento do último dia relatado.
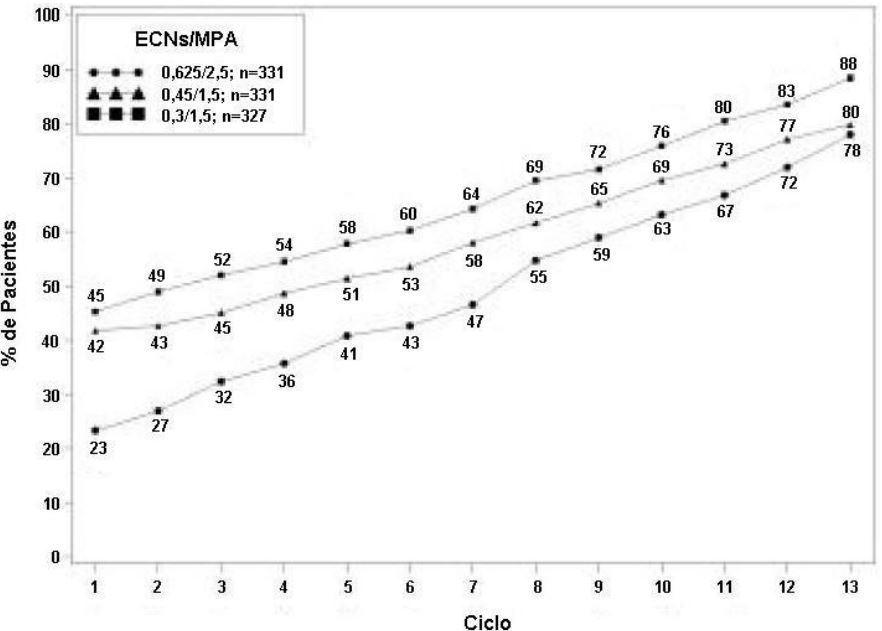
Figura 2. Pacientes com amenorreia em ciclos consecutivos ao longo do tempo- porcentagens de mulheres sem sangramento ou spotting em um determinado ciclo até o ciclo 13 na população com intenção de tratar.
Nota: É mostrada a porcentagem de pacientes amenorreicas em um determinado ciclo e até o ciclo 13. Se dados estivessem faltando, era considerado o valor de sangramento do último dia relatado.
Efeitos na densidade de mineral óssea
Estudo Health and Osteoporosis, Progestin and Estrogen (HOPE)
O estudo HOPE foi um estudo duplo-cego, randomizado, controlado por placebo/substância ativa, multicêntrico de mulheres saudáveis na pós-menopausa, com útero intacto. As mulheres (idade média de 53,3 ± 4,9 anos) estavam, em média, 2,3 ± 0,9 anos em menopausa e tomavam um comprimido de 600 mg de cálcio diariamente. As mulheres não recebiam suplementos de vitamina D. Elas foram tratadas com ECs/MPA (0,625 mg/2,5 mg, 0,45 mg/1,5 mg, 0,3 mg/1,5 mg), doses comparáveis de ECs isolados ou placebo. A prevenção da perda óssea foi avaliada pela medida da densidade mineral óssea (BMD), primeiramente na coluna lombar anteroposterior (L2 a L4). Secundariamente, foram analisadas também as medidas de BMD do corpo inteiro, do colo e do trocânter femoral. Osteocalcina sérica, cálcio urinário, e N-telopeptídeo foram usados como marcadores do turnover ósseo (BTM) nos ciclos 6, 13, 19, e 26.
Pacientes com intenção de tratar
Todos os grupos de tratamento com medicamento mostraram diferenças significativas em relação ao placebo em cada um dos quatro parâmetros final de BMD nos ciclos 6, 13, 19, e 26. As alterações percentuais da fase basal à avaliação final são mostradas na Tabela 5.
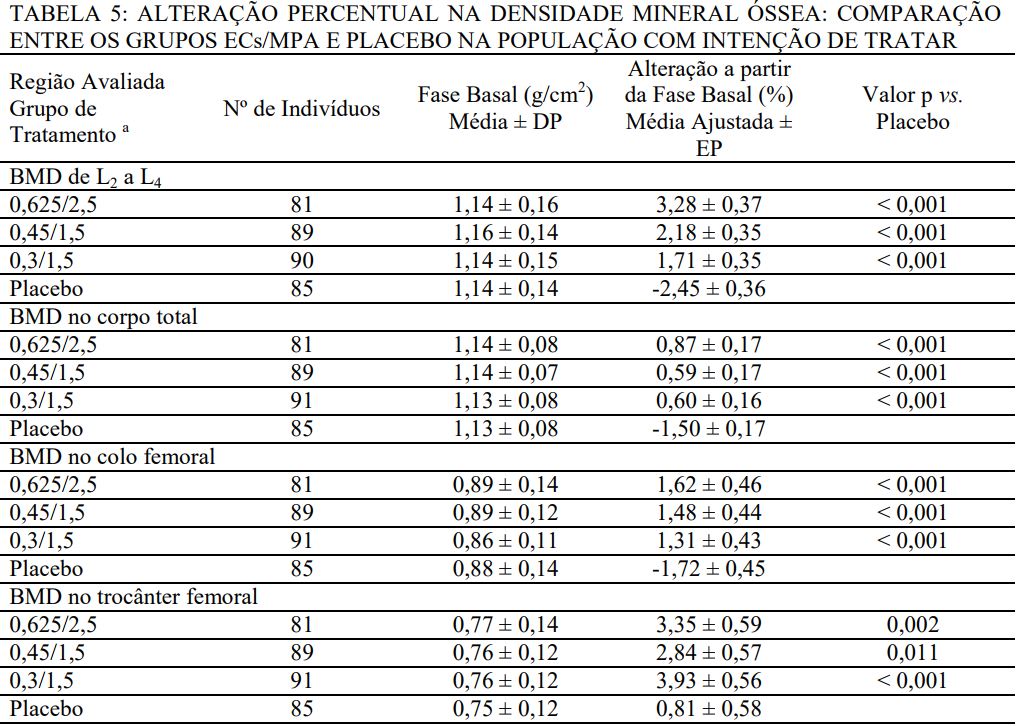
a Identificado pela dosagem (mg/mg) de ECs/MPA ou placebo.
EP = erro padrão.
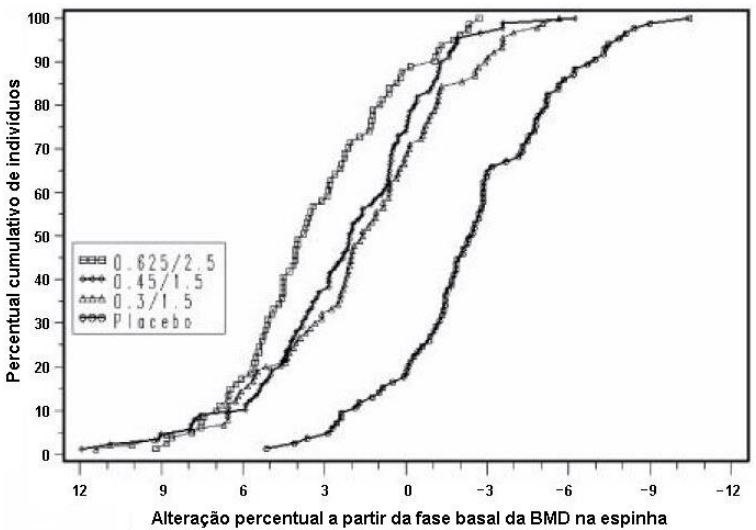
A Figura 3 mostra o percentual cumulativo de mulheres com alterações a partir da fase basal da BMD na coluna espinhal igual ou maior que o valor mostrado no eixo x.
Figura 3. Percentual cumulativo de indivíduos com alterações a partir da fase basal da BMD de coluna espinhal para determinada magnitude ou maior nos grupos ECs/MPA e placebo
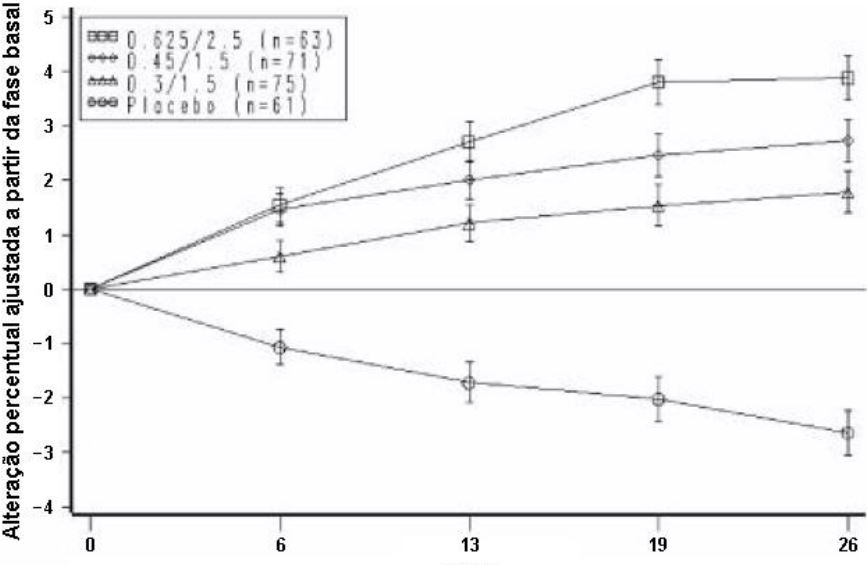
As alterações percentuais da média a partir da fase base da BMD da L2 a L4 para mulheres que completaram o estudo de densidade óssea estão demonstradas com barras de erro padrão por grupo de tratamento na Figura 4. Diferenças significativas entre cada um dos grupos de dosagem ECs/MPA e placebo foram encontradas nos ciclos 6, 13, 19 e 26.
Figura 4. Alteração percentual da média ajustada (EP) a partir da fase basal da BMD na coluna espinhal em cada ciclo para os grupos de ECs/MPA e placebo
Os marcadores do turnover ósseo osteocalcina sérica e N-telopeptídeo urinário diminuíram significativamente (p<0,001) em todos os grupos de tratamento com medicamento nos ciclos 6, 13, 19, e 26 em comparação ao grupo placebo. As diminuições médias maiores a partir da fase basal foram observadas nos grupos que receberam medicamento do que no grupo placebo. As diferenças significativas em relação ao placebo foram menos frequentemente observadas no cálcio urinário; somente com ECs 0,625 mg/MPA 2,5 mg e ECs 0,45 mg/MPA 1,5 mg houve significativamente diminuições médias maiores que com placebo em 3 ou mais de 4 pontos de tempo.
Estudos Women´s Health Initiative (WHI)
O estudo Women’s Health Initiative (WHI) incluiu aproximadamente 27.000 mulheres predominantemente saudáveis na pós-menopausa em dois subestudos para avaliar os riscos e benefícios de estrogênios equinos conjugados (ECs) [0,625 mg diariamente] isolados ou em combinação com acetato de medroxiprogesterona (MPA) [0,625 mg / 2,5 mg diariamente] em comparação a placebo na prevenção de certas doenças crônicas. O parâmetro primário foi a incidência de doença coronariana cardíaca (DCC), definida como infarto do miocárdio não fatal (IM), IM silencioso e morte por DCC, com câncer de mama invasivo como resultado adverso primário. Um índice global incluiu a ocorrência precoce de DCC, câncer de mama invasivo, acidente vascular cerebral (AVC), embolia pulmonar (EP), câncer endometrial (somente no subestudo com ECs+MPA), câncer colorretal, fratura de quadril, ou morte devido a outras causas. O subestudo não avaliou os efeitos de ECs+MPA ou ECs isolados sobre os sintomas da menopausa.
O subestudo de estrogênio mais progestagênio foi interrompido precocemente. De acordo com a regra pré-definida para a interrupção, após um acompanhamento médio de 5,6 anos de tratamento, o aumento no risco de câncer de mama e eventos cardiovasculares superaram os benefícios específicos incluídos no índice global. O risco absoluto excessivo de eventos incluídos no índice global foi de 19 por 10.000 mulheres-ano.
Para aqueles resultados incluídos no índice global do WHI que alcançaram significância estatística após acompanhamento de 5,6 anos, os riscos absolutos excessivos por 10.000 mulheres-ano no grupo tratado com ECs+MPA foram 8 vezes mais AVCs, 10 vezes mais EPs e 8 vezes mais cânceres de mama invasivos, enquanto que as reduções de risco absoluto por 10.000 mulheres-ano foram de 6 vezes menos cânceres colorretais e 5 vezes menos fraturas de quadril.
Resultados do subestudo de estrogênio mais progestagênio de WHI que incluíram 16.608 mulheres (idade média de 63 anos; variação de 50 a 79: 83,9% Brancas, 6,8% Negras, 5,4% Hispânicas, 3,9% Outras) são apresentados na Tabela 6. Esses resultados refletem os dados adjudicados centralmente após um acompanhamento médio de 5,6 anos.
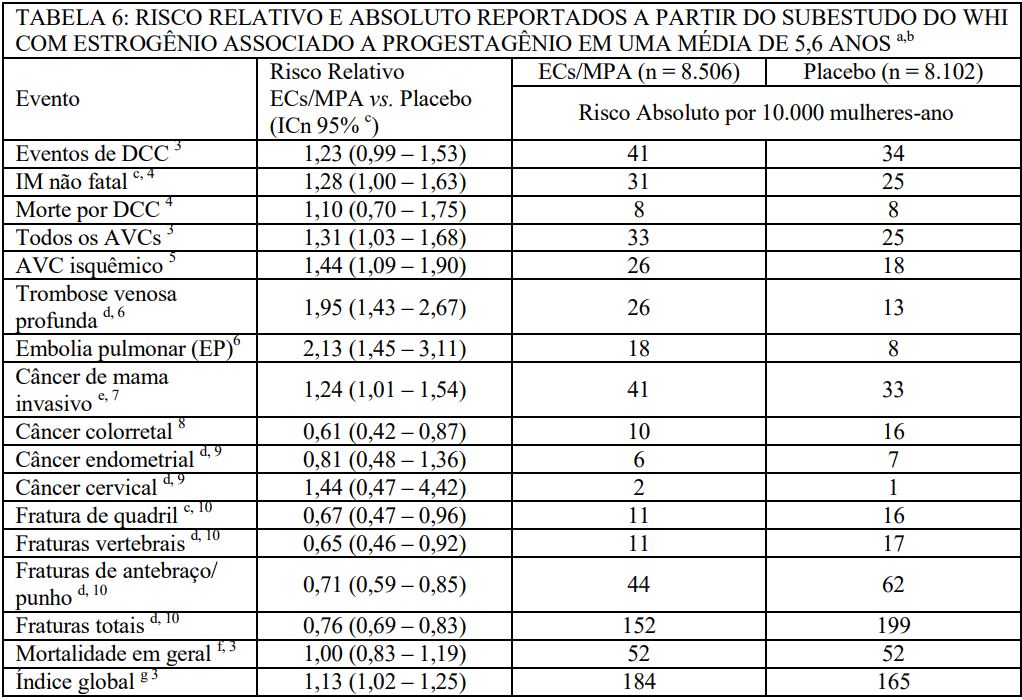
a Adaptado a partir de inúmeras publicações do WHI. Publicações WHI podem ser encontradas em: www.nhlbi.nih.gov/whi.
b Os resultados são baseados nos dados definidos centralmente.
c Intervalos de confiança nominais não ajustados para verificações e comparações múltiplas.
d Não incluído no “índice global”.
e Inclui câncer de mama metastático e não metastático, com exceção de câncer de mama in situ.
f Todas as mortes, exceto as de câncer de mama ou colorretal, DCC determinado/provável, EP ou doença cerebrovascular.
g Um subconjunto de eventos foi combinado em um “índice global” definido como a ocorrência mais precoce de eventos de DCC, câncer de mama invasivo, AVC, EP, câncer colorretal, fratura de quadril ou morte devido a outras causas.
O tempo de início da terapia estrogênica relativo ao início da menopausa pode afetar o perfil geral de riscos e benefícios. O subestudo com estrogênio mais progestagênio do WHI estratificado por idade mostrou em mulheres de 50-59 anos de idade uma tendência não significativa em direção ao risco reduzido para mortalidade total [HR 0,69 (IC 95% 0,44 – 1,07)].
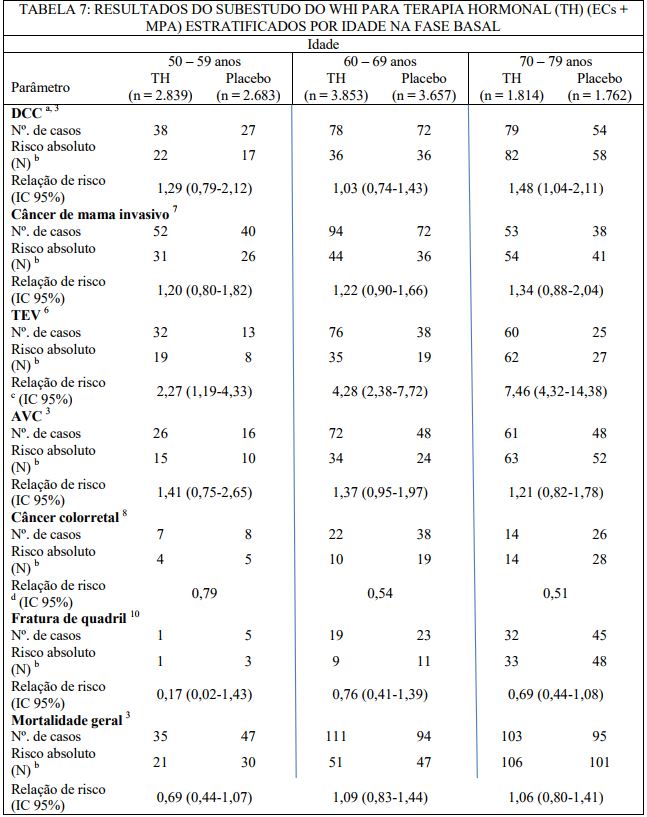
a DCC definida como infarto do miocárdio ou morte coronariana.
b Risco absoluto por 10.000 pessoas-ano.
c Relações de risco de TEV (tromboembolismo venoso) comparadas a mulheres com 50 – 59 anos de idade recebendo placebo.
d Intervalos de confiança não relatados.
Estudo da Memória da Women’s Health Initiative
No Estudo da Memória do Women’s Health Initiative (WHIMS) com estrogênio mais progestagênio, um estudo auxiliar do WHI, foram inscritas 4.532 mulheres predominantemente saudáveis e na pós-menopausa com 65 anos de idade ou mais velhas (47% com 65 a 69 anos de idade; 35% com 70 a 74 anos de idade; e 18% com 75 anos ou mais) para avaliar os efeitos de ECs (0,625 mg) mais MPA (2,5 mg) administrados diariamente na incidência de possível demência (resultado primário) em comparação ao placebo.
Após um acompanhamento médio de quatro anos, um risco relativo de possível demência para ECs (0,625 mg) mais MPA (2,5 mg) versus placebo foi de 2,05 (IC de 95% 1,21-3,48). O risco absoluto de possível demência para ECs (0,625 mg) mais MPA (2,5 mg) versus placebo foi de 45 versus 22 casos por 10.000 mulheres-ano. Conforme definido neste estudo, possível demência incluiu doença de Alzheimer (DA), demência vascular (DV) e tipos mistos (contendo características de ambas DA e DV). A classificação mais comum de possível demência no grupo de tratamento e no grupo placebo foi DA.11 Considerando que o subestudo foi conduzido com mulheres de 65 a 79 anos de idade, não se sabe se estes achados se aplicam a mulheres mais jovens na pós-menopausa, ou se estão associados a achados relacionados à idade.
Características Farmacológicas
Descrição
Estradiol + Trimegestona é uma associação de estradiol e trimegestona.
Estradiol
O princípio ativo, um 17-beta-estradiol sintético, é química e biologicamente idêntico ao estradiol endógeno humano. Repõe a perda da produção de estrogênio após a menopausa e alivia os sintomas da menopausa. O estradiol previne a perda óssea após a menopausa ou após a ooforectomia.
Trimegestona
A trimegestona é um progestagênio 19-norpregnano, com afinidade in vitro pelo receptor de progesterona aproximadamente 6 vezes maior do que a da própria progesterona. A trimegestona não tem atividade androgênica, estrogênica, mineralocorticoide, glicocorticoide ou antiglicocorticoide significante in vivo.
Como o estrogênio promove o crescimento do endométrio, o estradiol isolado aumenta o risco de hiperplasia e câncer endometriais. Além disso, o progestagênio reduz, mas não elimina totalmente, o risco induzido pelos estrogênios de hiperplasia endometrial em mulheres não-histerectomizadas.
Informações clínicas sobre Estradiol + Trimegestona
- Alívio dos sintomas da menopausa nas primeiras semanas de tratamento.
- Amenorreia em pelo menos 81% das mulheres a partir do Ciclo 6 e em até 94% no segundo ano de tratamento.
Mecanismo de Ação
Estrogênios endógenos são responsáveis, em grande parte, pelo desenvolvimento e manutenção do sistema reprodutivo feminino e características sexuais secundárias. Embora os estrogênios circulantes existam em um equilíbrio dinâmico de interconversões metabólicas, o estradiol é o principal estrogênio humano intracelular e é substancialmente mais potente que seus metabólitos, estrona e estriol, no nível de receptor.
A fonte primária de estrogênio em mulheres adultas com ciclos normais é o folículo ovariano, que secreta de 70 a 500 mcg de estradiol diariamente, dependendo da fase do ciclo menstrual.Após a menopausa, a maioria do estrogênio endógeno é produzido pela conversão da androstenediona, secretada pelo córtex adrenal, em estrona nos tecidos periféricos. Portanto, a estrona e sua forma sulfato-conjugada, sulfato de estrona, são os estrogênios circulantes mais abundantes em mulheres na pós-menopausa.
Os estrogênios agem através da ligação aos receptores nucleares nos tecidos estrogênio-responsivos. Até o momento foram identificados 2 receptores de estrogênio.A proporção destes varia de tecido para tecido.
Os estrogênios circulantes modulam a secreção pituitária das gonadotrofinas, hormônio luteinizante (LH) e hormônio folículo estimulante (FSH), pelo mecanismo de feedback negativo. Os estrogênios agem reduzindo os níveis elevados dessas gonadotrofinas encontradas em mulheres na pós-menopausa.
O acetato de medroxiprogesterona (MPA) administrado parenteralmente inibe a produção de gonadotrofina, que por sua vez previne a maturação folicular e ovulação, embora dados disponíveis indiquem que isto não ocorre quando a dosagem oral geralmente recomendada é ingerida como uma dose única diária.
O acetato de medroxiprogesterona (MPA) pode alcançar seu efeito benéfico no endométrio em parte pela diminuição dos receptores nucleares de estrogênio e supressão da síntese epitelial de DNA no tecido endometrial. Não foram percebidos efeitos androgênicos e anabólicos do MPA, mas o ativo é aparentemente isento de atividade estrogênica significante.
Farmacodinâmica
Atualmente não há dados farmacodinâmicos conhecidos para estrogênio conjugados (ECs)/acetato de medroxiprogesterona (MPA) ou estrogênios conjugados (ECs) + acetato de medroxiprogesterona (MPA).
Farmacocinéticas
Estradiol
Após a administração oral de 1 mg de estradiol na forma micronizada, ocorre rápida absorção pelo trato gastrintestinal. O estradiol sofre extenso metabolismo de primeira passagem no fígado e no intestino delgado e atinge concentrações plasmáticas máximas de aproximadamente 14 a 72 pg/mL em 4 a 8 horas após dose única.
Os estrogênios são excretados principalmente na urina em uma forma biologicamente inativa; também são excretados na bile, onde são hidrolisados e reabsorvidos (circulação êntero-hepática). Após a administração repetida de 1 mg de estradiol, a concentração plasmática média é de cerca de 50 pg/mL com concentrações plasmáticas mínimas de 20 pg/mL.
Não houve alterações na farmacocinética do estradiol com a administração concomitante da trimegestona. O estradiol apresenta alta taxa de ligação às proteínas plasmáticas (98%), principalmente à albumina. O estradiol é metabolizado principalmente no fígado e no intestino, mas também nos órgãos-alvo, envolvendo a formação de metabólitos menos ativos ou inativos, entre eles, a estrona, os catecolestrogênios e vários sulfatos e glicuronídeos de estrogênio.
Trimegestona
Após doses únicas orais de 0,125 mg em mulheres na pós-menopausa em jejum, a trimegestona é rápida e totalmente absorvida com concentrações plasmáticas máximas de 2 a 5 ng/mL em 30 minutos. A biodisponibilidade absoluta após a administração oral é de aproximadamente 100%. A meia-vida de eliminação terminal é de cerca de 17 horas (intervalo de 7 a 37 horas). A farmacocinética da trimegestona é proporcional à dose no intervalo de dose de 0,0625 a 1 mg.
Após a administração repetida de dose única diária de 0,125 mg, o estado de equilíbrio é atingido até a terceira administração com concentrações médias de cerca de 0,5 ng/mL e concentrações plasmáticas mínimas de 0,2 ng/mL. A farmacocinética da trimegestona após a administração repetida pode ser estimada a partir da farmacocinética de dose única.
A trimegestona e seu metabólito principal (sulfato de trimegestona) apresentam alta taxa de ligação às proteínas plasmáticas humanas (98%). Dentro do intervalo de concentrações obtidas após a administração das doses usadas nos estudos clínicos, a ligação é constante e não-saturável. O volume de distribuição no estado de equilíbrio após a administração intravenosa é de 1,8 L/kg.
A trimegestona é amplamente metabolizada. A principal via metabólica é a sulfoconjugação; uma via secundária é a oxidação pela isoenzima CYP3A4 com base nos dados in vitro.
Em comparação à trimegestona, o sulfato de trimegestona apresenta concentração plasmática 10 vezes maior e meia-vida mais prolongada (30 horas), mas menos de um décimo da afinidade de ligação ao receptor de progesterona. No plasma, o sulfato de trimegestona é o principal constituinte da AUC após uma dose única oral (aproximadamente 55%). A trimegestona inalterada constitui cerca de 8% da AUC, ao passo que o glicuronídeo de trimegestona e os metabólitos 1 e 6-hidroxilados juntos constituem aproximadamente 5% da AUC.
Após a administração oral da trimegestona radiomarcada, 38% da dose é excretada na urina e 54% nas fezes. Não há excreção da trimegestona inalterada na urina. Não foram observadas diferenças nos parâmetros farmacocinéticos do estradiol, da trimegestona e do sulfato de trimegestona em mulheres idosas (> 65 anos) em comparação a mulheres mais jovens na pós-menopausa.
Em mulheres com disfunção renal leve a moderada (depuração de creatinina > 30 mL/min/1,73 m2 ), não foram observados efeitos sobre a concentração plasmática de estradiol, trimegestona e sulfato de trimegestona. Em mulheres com disfunção renal grave (depuração de creatinina < 30 mL/min/1,73 m2 ), os dados são poucos, mas indicam aumento das concentrações plasmáticas de estradiol e sulfato de trimegestona.
Não foram realizados estudos de farmacocinética em mulheres com doença hepática.
Absorção
Os estrogênios conjugados (ECs) são solúveis em água e são bem absorvidos no trato gastrointestinal após liberação da formulação do produto. A drágea de ECs libera estrogênios conjugados lentamente durante várias horas. Concentrações plasmáticas máximas são alcançadas aproximadamente em 6-10 horas após administração da drágea com ECs. Os estrogênios são geralmente eliminados de forma quase paralela, com meia-vida variando de 10-20 horas quando corrigidos por concentrações endógenas, se necessário.
Efeito com alimentos:
Foram conduzidos estudos com doses únicas em mulheres saudáveis na pós-menopausa para investigar interação medicamentosa potencial quando ECs/MPA são administrados com desjejum com alto teor de gordura. A administração com alimentos diminuiu a Cmáx da estrona total de 18 a 34% e aumentou a Cmáx da equilina total em 38% quando comparado ao estado de jejum, sem outro efeito na taxa ou extensão de absorção de outros estrogênios conjugados ou não.
A administração com alimentos aproximadamente dobra a Cmáx do MPA e aumenta a AUC do MPA por aproximadamente 20 a 30%.
Proporcionalidade de dose:
Os valores de Cmáx e AUC para o MPA observados em dois estudos separados de farmacocinética conduzidos com dois comprimidos de ECs/MPA (0,625 mg/2,5 mg) ou dois comprimidos de ECs/MPA (0,625 mg/5 mg) mostraram proporcionalidade de dose não linear; o dobro da dose de MPA de 2 x 2,5 mg a 2 x 5 mg aumentou a Cmáx e AUC média em 3,2 e 2,8 vezes, respectivamente.
A proporcionalidade de dose de estrogênios e acetato de medroxiprogesterona foi avaliada pela combinação de dados farmacocinéticos cruzados com outros dois estudos, totalizando 61 mulheres saudáveis na pós-menopausa. Doses de ECs de 2 x 0,3 mg, 2 x 0,45 mg ou 2 x 0,625 mg foram administradas isoladamente ou em combinação com doses de MPA de 2 x 1,5 mg ou 2 x 2,5 mg. A maioria dos componentes estrogênio demonstraram proporcionalidade de dose; no entanto, vários componentes estrogênio não. Os parâmetros de farmacocinética do acetato de medroxiprogesterona aumentaram de forma proporcional à dose.
Distribuição
A distribuição de estrogênios exógenos é similar a de estrogênios endógenos. Os estrogênios são amplamente distribuídos no corpo e são geralmente encontrados em altas concentrações nos órgãos-alvo de hormônio sexual. Os estrogênios circulam no sangue em grande parte ligados à globulina de ligação aos hormônios sexuais (SHBG) e albumina; o MPA é ligado aproximadamente 90% a proteínas plasmáticas, mas não é ligado à SHBG.
Metabolismo
Os estrogênios exógenos são metabolizados da mesma forma que os estrogênios endógenos. Os estrogênios circulantes existem em um equilíbrio dinâmico de interconversões metabólicas. Estas transformações ocorrem principalmente no fígado. O estradiol é convertido reversivelmente em estrona e ambos podem ser convertidos em estriol, que é o maior metabólito urinário. Os estrogênios também sofrem recirculação entero-hepática via conjugação com sulfato ou glicuronídeo no fígado, secreção biliar dos conjugados no intestino e hidrólise no intestino seguido de reabsorção.
Em mulheres na pós-menopausa, uma proporção significante de estrogênios circulantes existe como sulfato conjugados, especialmente sulfato de estrona, que serve como reservatório circulante para a formação de mais estrogênios ativos. O metabolismo e a eliminação do acetato de medroxiprogesterona (MPA) ocorrem primariamente no fígado via hidroxilação, com conjugação subsequente e eliminação na urina.
Excreção
O estradiol, a estrona e o estriol são excretados na urina, juntamente com glicuronídeo e sulfatos conjugados. A maioria dos metabólitos do MPA é excretada como glicuronídeo conjugados, com apenas pequenas quantidades excretadas como sulfatos.
Populações especiais
Não foram conduzidos estudos farmacocinéticos em populações especiais, incluindo pacientes com insuficiência renal ou hepática.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)