Qual a ação da substância do Striverdi Respimat?
Resultados de Eficácia
O programa de desenvolvimento clínico de fase III para Olodaterol incluiu quatro pares de estudos replicados, randomizados, duplo-cegos, controlados por placebo em 3.533 pacientes com DPOC (1.281 receberam a dose de 5 mcg e 1.284 receberam a dose de 10 mcg):
- Dois estudos replicados, controlados por placebo, paralelos, de 48 semanas (Estudos 1 e 2)1.
- Dois estudos replicados, controlados por placebo e por ativo, paralelos, de 48 semanas, com formoterol 12 mcg 2 vezes ao dia como comparador ativo (Estudos 3 e 4)2.
- Dois estudos replicados, controlados por placebo e por ativo, cruzados, de 6 semanas, com formoterol 12 mcg 2 vezes ao dia como comparador ativo (Estudos 5 e 6)3.
- Dois estudos replicados, controlados por placebo e por ativo, cruzados, de 6 semanas, com tiotrópio HandiHaler 18 mcg 1 vez ao dia como comparador ativo (Estudos de 7 e 8)4.
Todos os estudos incluíram medidas de função pulmonar (volume expiratório forçado em 1 segundo, VEF1); os estudos de 48 semanas avaliaram pico (AUC0-3) e vale das respostas de função pulmonar, enquanto os estudos de 6 semanas avaliaram o perfil da função pulmonar ao longo de um intervalo de dose de 24 horas contínuo. Os dois estudos replicados, controlados por placebo e por ativo de 48 semanas também incluíram o Questionário Respiratório de St. George (SGRQ) como medida da qualidade de vida relacionada à saúde.
Pacientes incluídos no programa de Fase III tinham 40 anos de idade ou mais, com diagnóstico clínico de DPOC, com história de tabagismo de pelo menos 10 maços-ano e com disfunção pulmonar moderada a muito grave (VEF1 pós broncodilatador <80% do normal previsto (estádio GOLD II-IV); relação VEF1/CVF pós broncodilatador <70%).
Características dos pacientes
A maioria dos 3.104 pacientes recrutados nos estudos globais de 48 semanas [Estudos 1 e 2, Estudos 3 e 4] eram homens (77%), brancos (66%) ou asiáticos (32%), com média de idade de 64 anos. O VEF1 médio após broncodilatador foi 1,38 L (GOLD II [50%], GOLD III [40%], GOLD IV [10%]). A média da resposta ao beta2- agonista foi de 15% do basal (0,160 L). Com exceção dos outros beta2-agonistas de longa duração, todas as medicações pulmonares foram permitidas como terapia concomitante (por exemplo, tiotrópio [24%], ipratrópio [25%], corticoides inalatórios [45%], xantinas [16%]); a inclusão dos pacientes foi estratificada por uso de tiotrópio.
Em todos os quatro estudos, os objetivos primários de eficácia em função pulmonar foram:
- Alteração da AUC0-3 do VEF1 pré-tratamento e alteração do vale do VEF1 basal pré-tratamento (após 12 semanas nos Estudos 1 e 2; após 24 semanas nos Estudos 3 e 4).
Os estudos de 6 semanas [Estudos 5 e 6, Estudos 7 e 8] foram conduzidos na Europa e na América do Norte. Nos Estudos 5 e 6, a maioria dos 199 pacientes recrutados eram homens (53%) e brancos (93%), com uma média de idade de 63 anos. A média de VEF1 pós-broncodilatador foi 1,43 L (GOLD II [54%], GOLD III [39%], GOLD IV [7%]). A média de resposta ao beta2-agonista foi 17% do basal (0,187 L). Com exceção dos outros beta2-agonistas de longa duração, todas as medicações pulmonares foram permitidas como terapia concomitante (por exemplo, tiotrópio [24%], ipratrópio [16%], corticoides inalatórios [31%], xantinas [0.5%]). Nos Estudos 7 e 8, a maioria dos 230 pacientes recrutados eram homens (69%) e brancos (99,6%), com média de idade de 62 anos. A média do VEF1 pós-broncodilatador foi de 1,55 L (GOLD II [57%], GOLD III [35%], GOLD IV [7%]). A resposta ao beta2-agonista foi 18% do basal (0,203 L). Com exceção dos outros beta2-agonistas de longa duração e anticolinérgicos, todas as outras medicações pulmonares foram permitidas como terapia concomitante (por exemplo, corticoides inalatórios [49%], xantinas [7%]).
Função pulmonar
Nos estudos de 48 semanas, 5 mcg de Olodaterol administrado 1vez ao dia pela manhã ofereceu uma melhora significativa (p<0,0001) na função pulmonar dentro de 5 minutos após a primeira dose (média de aumento de 0,130 L no VEF1 em comparação ao basal de pré-tratamento de 1,18 L). A melhora significativa na função pulmonar manteve-se por 24 horas (média de aumento de 0,162 L na AUC0-3 do VEF1 em comparação com placebo, p<0,0001; média de aumento de 0,071 L no vale de VEF1 de 24 horas em relação ao placebo, p<0,0001); a melhora na função pulmonar foi evidente tanto em usuários de tiotrópio quanto em não usuários de tiotrópio. As melhoras na AUC0-3 do VEF1 e no vale de VEF1 foram comparáveis às do formoterol 2vezes ao dia. Os efeitos broncodilatadores de Olodaterol se mantiveram durante todo o período de tratamento de 48 semanas. Olodaterol também melhorou as PEFR (taxas de pico do fluxo expiratório) matinal e vespertina, medidas pelas anotações diárias do paciente em comparação ao placebo.
Nos estudos de 6 semanas, Olodaterol mostrou uma resposta de VEF1 significativamente maior em comparação com placebo (p<0,0001) ao longo de todo o intervalo de dose de 24 horas (Figura 1, Figura 2, Tabela 1).
Figura 1: Perfil de VEF1 para 5 mcg de Olodaterol e placebo ao longo do intervalo de dose contínuo de 24 horas (estudos 5 e 6, conjunto de dados combinado; anticolinérgicos permitidos como medicação concomitante)
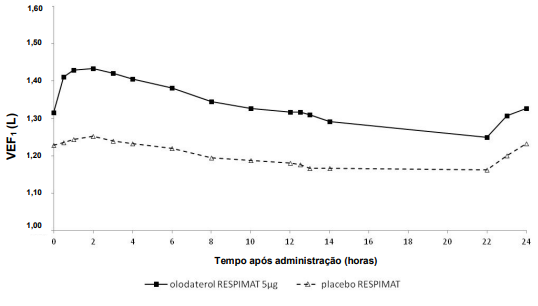
Figura 2: Perfil de VEF1 para 5 mcg de Olodaterol e placebo ao longo do intervalo contínuo de dose de 24 horas (Estudos 7 e 8, conjunto de dados combinado; anticolinérgicos permitidos como medicação concomitante)
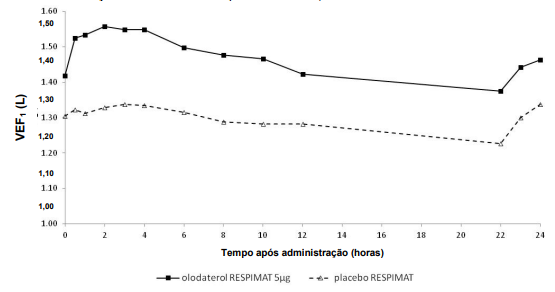
Tabela 1: Diferenças em VEF1 para 5 mcg de Olodaterol em comparação ao placebo ao longo de um intervalo de dose contínuo de 24 horas após 6 semanas de tratamento nos Estudos 5 e 6 (conjunto de dados combinado) e Estudos 7 e 8 (conjunto de dados combinado)
| --- | VEF1: diferença vs placebo (L)1 | |||
| Média em 3h | Média em 12 h | Média em 24h | Vale | |
| Estudos 5 e 6 | 0,175 | 0,160 | 0,137 | 0,102 |
| Estudos 7 e 8 | 0,211 | 0,193 | 0,168 | 0,134 |
1VEF1 basal pré-tratamento = 1,26 L (Estudos 5 e 6) e 1,33 L (Estudos 7 e 8).
Qualidade de vida relacionada à saúde, uso de medicação de resgate, avaliação global do paciente
O Questionário Respiratório de St. George (SGRQ) também foi incluído no estudo replicado, controlado por placebo e por ativo, de 48 semanas [Estudos 3 e 4]. Após 24 semanas, Olodaterol melhorou significativamente a média de pontuação total do SGRQ comparado ao placebo (Tabela 2); a melhora foi observada em todos os 3 domínios do SGRQ (sintomas, atividades, impacto). Mais pacientes tratados com Olodaterol tiveram uma melhora na pontuação total SGRQ maior do que o MCID (4 unidades) comparados ao placebo (50,2% vs 36,4%, p<0,0001).
Tabela: 2 SGRQ total e escores nos domínios após 24 semanas de tratamento
| --- | Média de tratamento (mudança do basal) | Diferença vs placebo Média (valor p) |
| Pontuação total | ||
| Basal | 44,4 | --- |
| Placebo | 41,6 (-2,8) | --- |
| Olodaterol 5 mcg 1x/dia | 38,8 (-5,6) | -2,8 (p=0,0034) |
| Formoterol 12 mcg 2x/dia | 40,4 (-4,0) | -1,2 (p=0,2009) |
| Sintomas | ||
| Placebo | 46,0 | --- |
| Olodaterol 5 mcg 1x/dia | 41,1 | -4,8 (p=0,0004) |
| Formoterol 12 mcg 2x/dia | 43,7 | -2,3 (p=0,0924) |
| Atividades | ||
| Placebo | 55,3 | --- |
| Olodaterol 5 mcg 1x/dia | 52,9 | -2,4 (p=0,0455) |
| Formoterol 12 mcg 2x/dia | 55,0 | -0,3 (p=0,7797) |
| Impacto | ||
| Placebo | 32,3 | --- |
| Olodaterol 5 mcg 1x/dia | 29,7 | -2,6 (p=0,0157) |
| Formoterol 12 mcg 2x/dia | 30,8 | -1,5 (p =0,1605) |
Pacientes tratados com Olodaterol usaram menos salbutamol de resgate durante o dia e à noite em comparação com pacientes tratados com placebo.
Em cada um dos estudos de 48 semanas, os pacientes tratados com Olodaterol perceberam uma melhora maior na sua condição respiratória em comparação ao placebo, medida por uma escala de Avaliação Global do Paciente (PGR), fornecendo mais evidências sobre o benefício nos sintomas.
Tolerância ao exercício
O efeito de Olodaterol na tolerância ao exercício limitada por sintomas em pacientes com DPOC foi investigado em dois estudos replicados, randomizados, duplo-cegos, controlados por placebo e cruzados, de 6 semanas. Nestes estudos, Olodaterol melhorou significativamente a capacidade de exercício em 14,0% (p=0,0002) e 11,8% (p=0,0018) em comparação ao placebo. Olodaterol também reduziu a hiperinsuflação pulmonar (reduziu a capacidade funcional residual, CFR), resultando em aumento da capacidade inspiratória em repouso e durante o exercício em relação ao placebo5.
Referências:
1.Ferguson GT, Feldman GJ, Hofbauer P, et al. Efficacy and safety of olodaterol once daily delivered via Respimat® in patients with GOLD 2-4 COPD: results from two replicate 48-week studies. Int J Chron Obstruct Pulmon Dis. 2014;9:629-45.
2. Koch A, Pizzichini E, Hamilton A, et al. Lung function efficacy and symptomatic benefit of olodaterol once daily delivered via Respimat® versus placebo and formoterol twice daily in patients with GOLD 2-4 COPD: results from two replicate 48-week studies. Int J Chron Obstruct Pulmon Dis. 2014;9:697-714.
3. Feldman GJ, Bernstein JA, Hamilton A, et al. The 24-h FEV1 time profile of olodaterol once daily via Respimat® and formoterol twice daily via Aerolizer® in patients with GOLD 2-4 COPD: results from two 6-week crossover studies. Springerplus. 2014;3(1):419.
4. Lange P, Aumann JL, Hamilton A, et al. The 24 hour lung function time profile of olodaterol once daily versus placebo and tiotropium in patients with moderate to very severe chronic obstructive pulmonary disease. J Pulm Respir Med. 2014; 4(4):196.
5. Maltais F, Kirsten A, Hamilton A, et al. The influence of log transformation in analyzing exercise endurance time data in COPD: results from two olodaterol trials. Am J Respir Crit Care Med. 2015; 191 [A5737].
Características Farmacológicas
Farmacodinâmica
O olodaterol é um agonista beta2-adrenérgico de longa duração (LABA) com alta afinidade e seletividade pelos adrenoceptores beta2 humanos, com rápido início de ação e uma duração da ação de pelo menos 24 horas. Exerce seu efeito farmacológico por ligação e ativação destes receptores nas vias aéreas após administração tópica por inalação, resultando na estimulação da adenilciclase intracelular, uma enzima que media a síntese do AMP cíclico, cujos níveis elevados induzem broncodilatação pelo relaxamento da musculatura lisa das vias respiratórias.
Os beta-adrenoceptores são divididos em três subtipos:
- Beta1 (expressos predominantemente no músculo liso cardíaco), beta2 (expressos predominantemente na musculatura lisa das vias respiratórias) e beta3 (expressos predominantemente no tecido adiposo). Os agonistas beta2 causam broncodilatação. Embora os adrenoceptores beta2 sejam os receptores predominantes na musculatura lisa das vias respiratórias, também estão presentes na superfície de várias outras células, como células epiteliais do pulmão e endoteliais do coração. A função precisa dos receptores beta2 no coração não é conhecida, mas sua presença levanta a possibilidade que mesmo agonistas beta2-adrenérgicos altamente seletivos possam ter efeitos cardíacos.
Estudos in vitro têm mostrado uma atividade agonista de olodaterol 241 vezes maior nos adrenoceptores beta2 do que nos adrenoceptores beta1 e 2.299 vezes maior do que nos adrenoceptores beta3.
Efeitos na eletrofisiologia cardíaca
O efeito do olodaterol sobre o intervalo QT/QTc do ECG foi investigado em um estudo duplo-cego, randomizado, com controle ativo (moxifloxacino) e com placebo, em 24 homens e mulheres voluntários saudáveis. Em dose única de 10, 20, 30 e 50 microgramas demonstrou que, em comparação com o placebo, as médias de alteração no intervalo QT basal de 20 minutos a 2 horas após a administração tiveram um aumento dose-dependente de 1,6 (10 mcg de olodaterol) a 6,5 ms (50 mcg de olodaterol), com os limites superiores dos intervalos de confiança (IC) de 90% de dois lados sendo menor que 10 ms com todas as doses.
O efeito de 5 mcg e 10 mcg de Olodaterol na frequência e ritmo cardíaco foi avaliado pela gravação contínua por 24 horas do ECG (monitoramento de Holter) em um subgrupo de 772 pacientes nos estudos de Fase 3 de 48 semanas, controlados por placebo. Não houve tendências relacionadas à dose ou ao tempo nem foram observados padrões nas médias das alterações de frequência cardíaca ou em batimentos prematuros. Mudanças em relação aos batimentos prematuros do basal até o final do tratamento não indicaram diferenças significativas entre olodaterol 5 mcg, 10 mcg e placebo.
Farmacocinética
Informações sobre a farmacocinética do olodaterol foram obtidas de indivíduos saudáveis, de pacientes com DPOC ou com asma após inalação oral de doses terapêuticas ou acima da dose terapêutica. O olodaterol demonstrou farmacocinética linear com um aumento da exposição sistêmica proporcional à dose após inalação de dose única de 5 a 70 mcg e doses múltiplas, uma vez ao dia, de 2 a 20 mcg.
O estado de equilíbrio das concentrações plasmáticas após inalações repetidas uma vez ao dia foi atingido após 8 dias e a extensão da exposição aumentou em até 1,8 vezes em comparação com uma dose única.
Absorção
O olodaterol é rapidamente absorvido, atingindo concentrações plasmáticas máximas geralmente em 10 a 20 minutos após a inalação. Em voluntários saudáveis a biodisponibilidade absoluta de olodaterol após a inalação foi estimada em cerca de 30%; em contrapartida, para a solução oral foi inferior a 1%. Portanto, a disponibilidade sistêmica de olodaterol após inalação é determinada principalmente pela absorção pulmonar, visto que qualquer parte da dose deglutida contribui de forma desprezível para a exposição sistêmica.
Distribuição
O olodaterol exibe cinética de tendência multi-compartimental após a inalação bem como administração intravenosa. O volume de distribuição é alto (1.110 L), sugerindo extensa distribuição no tecido. A ligação do 14C-olodaterol às proteínas plasmáticas humanas in vitro é independente da concentração e é de aproximadamente 60%.
Biotransformação
O olodaterol é metabolizado substancialmente por glicuronidação direta (as isoformas UGT2B7, UGT1A1, 1A7 e 1A9 da uridina difosfato glicosil-transferase mostraram-se envolvidas) e por O-desmetilação do radical metoxi seguido por conjugação (estão envolvidas as isoenzimas do citocromo P450 CYP2C9 e CYP2C8, com uma contribuição desprezível da CYP3A4). Dos 6 metabólitos identificados, somente o produto de desmetilação não conjugado (SOM 1522) se liga aos receptores beta2; no entanto, este não é detectável no plasma após inalação crônica da dose terapêutica recomendada ou doses até 4 vezes maiores. Portanto, o olodaterol é considerado o único composto relevante para a ação farmacológica.
Eliminação
O clearance total do olodaterol em voluntários saudáveis é de 872 mL/min e o clearance renal é de 173 mL/min. A meia-vida terminal após administração intravenosa é de 22 horas. A meia-vida terminal após a inalação, ao contrário, é cerca de 45 horas, indicando que esta é determinada mais pelos processos de absorção do que pelos de eliminação. Após administração intravenosa de 14C-olodaterol, 38% da dose radioativa foi recuperada na urina e 53% nas fezes. A quantidade de olodaterol inalterado recuperado na urina após a administração intravenosa foi de 19% e após a administração oral apenas 9% da radioatividade foi recuperada na urina enquanto a maior parte foi recuperada nas fezes (84%). Mais de 90% da dose foi excretada dentro de 6 e 5 dias após a administração oral e intravenosa, respectivamente. Após inalação, a excreção de olodaterol inalterado na urina dentro do intervalo das doses em voluntários saudáveis no estado de equilíbrio foi de 5-7% da dose.
Efeito da idade, sexo e peso
Uma meta-análise de farmacocinética foi realizada utilizando dados de 2 estudos clínicos controlados, que incluíram 405 pacientes com DPOC e 296 pacientes com asma que receberam tratamento com Olodaterol. A análise mostrou que não há necessidade de ajuste de dose baseado no efeito da idade, sexo e peso na exposição sistêmica em pacientes com DPOC após a inalação de Olodaterol.
Insuficiência renal
Em indivíduos com disfunção renal grave (CLCR <30 mL/min) a exposição sistêmica ao olodaterol foi em média 1,4 vezes maior. A magnitude do aumento da exposição não causa preocupações relativas à segurança, tendo em vista a experiência de segurança do tratamento com Olodaterol em estudos clínicos de até 1 ano com até o dobro da dose terapêutica recomendada.
Insuficiência hepática
A exposição sistêmica ao olodaterol não foi afetada pela presença de insuficiência hepática leve e moderada. Não foi investigado o efeito da insuficiência hepática grave na exposição sistêmica ao olodaterol.
Raça
A comparação de dados farmacocinéticos dentro e entre os estudos revelou uma tendência para maior exposição sistêmica em japoneses e outros asiáticos do que em caucasianos. Não foram identificadas preocupações relativas à segurança em estudos clínicos de até 1 ano com caucasianos e asiáticos com Olodaterol com doses até o dobro da dose terapêutica recomendada.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)