Qual a ação da substância do Somavert?
Resultados de Eficácia
Um total de cento e doze pacientes (63 homens e 49 mulheres) com acromegalia participaram de estudo multicêntrico, randomizado, duplo-cego, durante 12 semanas, comparando placebo e pegvisomanto. A média de idade ±DP foi de 48±14 anos e a duração média da acromegalia foi de 8±8 anos. Noventa e três pacientes já haviam passado por cirurgia hipofisária, dos quais 57 também haviam sido tratados com terapia de radiação convencional. Seis pacientes haviam sido submetidos à irradiação sem cirurgia, nove pacientes receberam apenas terapia medicamentosa, e quatro pacientes não tinham recebido nenhuma terapia anterior.
Os indivíduos foram qualificados a participar do estudo se a dosagem de níveis séricos de IGF-1 fosse ≥ 1,3 vez o limite superior do intervalo ajustado para a idade média no mínimo de duas semanas após a descontinuação da terapia com análogo de somatostatina e cinco semanas depois da descontinuação da terapia com agonista de dopamina.
Os pacientes foram então randomizados para a visita de baseline de um dos quatro tratamentos:
- Placebo (n=32), 10 mg/dia (n=26), 15 mg/dia (n=26) ou 20 mg/dia (n=28).
O desfecho primário de eficácia foi a alteração da porcentagem em concentração do IGF-1 desde o baseline até a semana 12. Estes 3 grupos que receberam pegvisomanto demonstraram reduções estatisticamente significativas nos níveis séricos de IGF-1 (p<0,01) comparado com o grupo de placebo (Tabela 1).
Tabela 1 – Alteração média percentual de IGF-1 da baseline até a semana 12 para população avaliada por intenção de tratamento:
| --- | Placebo n=31 | Pegvisomanto | ||
| 10 mg/dia n=26 | 15 mg/dia n=26 | 20 mg/dia n=28 | ||
| Média baseline IGF-1 (ng/mL) (DP) | 670 (288) | 627 (251) | 649 (293) | 732 (205) |
| Alteração média percentual a partir da baseline em IGF-1 (DP) | -4,0 (17) | -27 (28) | -48 (26) | -63 (21) |
*p<0,01; n=número de pacientes; DP=desvio padrão.
Comparado com placebo, em todas as visitas no início do tratamento, houve também reduções nos níveis séricos de IGF-1 livre, de IGFBP-3 e de ALS.
Figura 1 – Efeitos do pegvisomanto em marcadores séricos (média ± erro padrão):
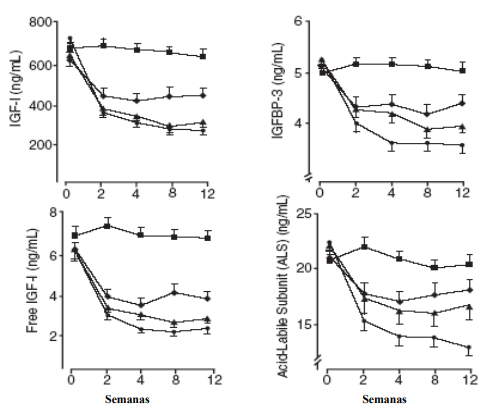
Placebo (n=31).
Pegvisomanto 10 mg/dia (n=25-26).
Pegvisomanto 15 mg/dia (n=24-26).
Pegvisomanto 20 mg/dia (n=27-28).
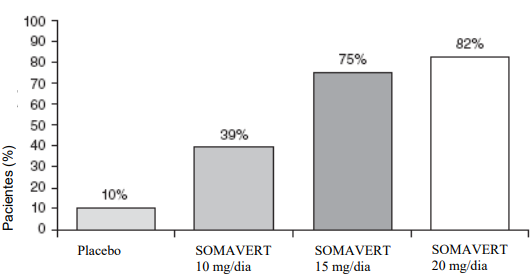
Após 12 semanas de tratamento, as seguintes porcentagens de pacientes tiveram IGF-1 normalizada.
Figura 2 – Porcentagem de pacientes cujos níveis de IGF-I normalizaram após 12 semanas de tratamento:
A tabela 2 mostra os efeitos do tratamento com pegvisomanto no tamanho do anel (tamanho padrão de joalheiro europeu) e nos sinais e sintomas de acromegalia. Cada escore individual foi baseado em uma escala ordinal de nove pontos (0=ausente e 8=grave e incapacitante) e o escore total foi derivado da soma dos escores individuais.
Tabela 2 – Alteração média percentual, a partir da baseline (DP) até a semana 12, para o tamanho do anel e sinais e sintomas de acromegalia:
| --- | Placebo n=30 | Pegvisomanto | ||
| 10 mg/dia n=26 | 15 mg/dia n=24-25 | 20 mg/dia n=26-27 | ||
| Tamanho do Anel | -0,1 (2,3) | -0,8 (1,6) | -1,9 (2,0) | -2,5 (3,3) |
| Escore total para sinais e sintomas de acromegalia | 1,3 (6,0) | -2,5 (4,3) | -4,4 (5,9) | -4,7 (4,7) |
| Edema de tecidos moles | 0,3 (2,3) | -0,7 (1,6) | -1,2 (2,3) | -1,3 (1,3) |
| Artralgia | 0,1 (1,8) | -0,3 (1,8) | -0,5 (2,5) | -0,4 (2,1) |
| Cefaleia | 0,1 (1,7) | -0,4 (1,6) | -0,3 (1,4) | -0,3 (2,0) |
| Transpiração | 0,1 (1,7) | -0,6 (1,6) | -1,1 (1,3) | -1,7 (1,6) |
| Fadiga | 0,7 (1,5) | -0,5 (1,4) | -1,3 (1,7) | -1,0 (1,6) |
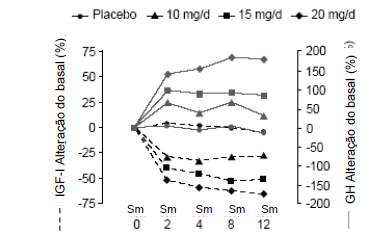
Assim como medido nos ensaios dos estudos utilizando antibióticos que não apresentam reação cruzada com pegvisomanto, as concentrações séricas do hormônio do crescimento aumentaram em duas semanas após o início do tratamento com pegvisomanto. O maior aumento da concentração do hormônio do crescimento foi observado nos pacientes tratados com pegvisomanto 20 mg/dia. Este efeito é provavelmente devido à diminuição da inibição do hormônio do crescimento assim como a redução dos níveis séricos de IGF-1. Como mostrado na Figura 3, quando pacientes com acromegalia receberam uma dose de ataque de pegvisomanto seguida por uma dose fixa diária, a elevação do hormônio do crescimento foi inversamente proporcional à queda em IGF-1 e geralmente estabilizou na semana 2.
No estudo de extensão, a redução observada na concentração sérica do IGF-1 nos meses 12 e 18 são similares aos observados nos pacientes tratados com pegvisomanto na dose de 20 mg/dia nas primeiras 12 semanas. As concentrações séricas do hormônio do crescimento (GH) também permaneceram estáveis em pacientes tratados com pegvisomanto por até 18 meses.
Figura 3 – Alteração percentual nas concentrações séricas do hormônio de crescimento e IGF-I (Sm=semana):
Na extensão open-label do estudo clínico, 160 indivíduos tiveram média de exposição de tratamento de 425 dias. O tratamento com pegvisomanto foi em geral bem tolerado. Apenas 2 pacientes apresentaram aumento nos níveis de enzimas hepáticas e descontinuaram o tratamento. Dos 90 pacientes acompanhados por mais de 12 meses de tratamento, 87 atingiram normalidade na concentração de IGF-1 (97%). Foi realizado estudo de coorte aberto, de longa duração, com 38 pacientes acromegálicos, durante pelo menos 12 meses consecutivos de administração diária de pegvisomanto (média = 55 semanas) e titulação da dose. A concentração média de IGF-1 neste estudo caiu de 917 ng/mL (± 356) para 299 ng/mL (± 134) no grupo tratado com pegvisomanto, com 92% atingindo uma concentração normal de IGF-1 (ajustada para a idade).
Referências:
1. Trainer PJ, Drake WM, Katznelson L, et al. Treatment of acromegaly with the growth hormone-receptor antagonist pegvisomant. N Engl J Med. 2000 Apr 20;342(16):1171-7.
2. Drake WM, Parkinson C, Akker SA, et al. Successful treatment of resistant acromegaly with a growth hormone receptor antagonist.Eur J Endocrinol. 2001 Oct;145(4):451-6.
3. Parkinson C and Trainer J. Pegvisoamnt: a growth hormone receptor antagonist for the treatment of acromegaly. Growth hormone & IGF Research, 2000. Supplement B, S119-23.
4. Van der Lely et al. Long-term treatment of acromegaly with pegvisomant, a growth hormone receptor antagonist. Lancet 2001:358:1754-9.
Características Farmacológicas
Propriedades Farmacodinâmicas
O pegvisomanto liga-se seletivamente aos receptores de GH na membrana celular e não reage de forma cruzada com outros 19 receptores de citoquinas testadas, incluindo a prolactina. O pegvisomanto leva a reduções na concentração sérica de IGF-1, IGF-1 livre, IGFBP-3 e subunidade ácido labil de IGF-1.
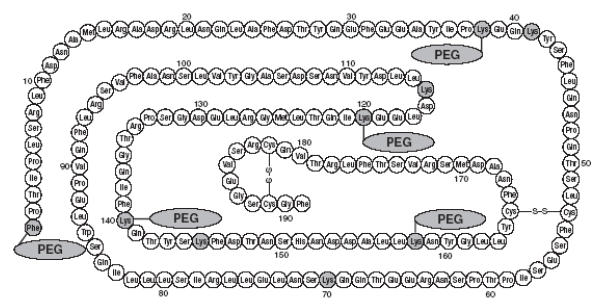
Sequência de aminoácidos da proteína pegvisomanto
Figura 4 – Os resíduos marcados indicam sítios de ligação PEG (Phe1, Lys38, Lys41, Lys70, Lys115, Lys120, Lys140, Lys145, Lys158):
O pegvisomanto liga-se seletivamente aos receptores do hormônio de crescimento na superfície das células, bloqueando a ligação do hormônio de crescimento endógeno, interferindo, dessa forma, na transdução do sinal intracelular do hormônio de crescimento. A inibição da ação do hormônio de crescimento pelo pegvisomanto leva à redução das concentrações séricas do fator de crescimento semelhante à insulina I (IGF-1), bem como das outras proteínas séricas responsivas ao hormônio de crescimento, incluindo a subunidade ácido-lábil do IGF-1 (ALS) e a proteína de ligação do fator de crescimento semelhante à insulina-3 (IGFBP-3).
Eficácia clínica e segurança
Em diferentes estudos e também no Acrostudy, o pegvisomanto normalizou os níveis de IGF-1 em uma alta porcentagem de pacientes (>70%) e diminuiu significativamente os níveis de glicose plasmática em jejum (FPG) e insulina plasmática em jejum (FPI).
O pegvisomanto também melhora a sensibilidade à insulina, provavelmente devido a um bloqueio dos receptores de GH nos tecidos, principalmente no fígado e também no tecido adiposo, rins e músculos esqueléticos, removendo assim o efeito prejudicial do GH na sinalização da insulina, lipólise e gliconeogênese. No entanto, o mecanismo de ação de todos esses efeitos não é conhecido com certeza. Pode ser necessária uma diminuição das doses de insulina ou de medicamentos hipoglicemiantes em pacientes acromegálicos com diabetes mellitus.
Propriedades Farmacocinéticas
Absorção
Após administração subcutânea, concentrações séricas máximas de pegvisomanto são atingidas em 33 a 77 horas após a administração. O nível médio de absorção de uma dose subcutânea de 20 mg foi de 57% em relação a uma dose intravenosa de 10 mg.
Distribuição
O volume aparente médio de distribuição do pegvisomanto é de 7 L (com coeficiente de variação de 12%), o que sugere que o pegvisomanto não seja extensivamente distribuído entre os tecidos. Após administração subcutânea única, a exposição ao pegvisomanto (Cmáx, AUC) aumenta desproporcionalmente com o aumento da dose. As concentrações sanguíneas médias (± SEM) de pegvisomanto após 12 semanas de tratamento com doses diárias de 10, 15 e 20 mg foram de, respectivamente, 6.600 ± 1.330; 16.000 ± 2.200; e 27.000 ± 3.100 ng/mL.
Metabolismo e eliminação
A molécula de pegvisomanto contém ligações covalentes a polímeros de polietilenoglicol, o que torna a velocidade de clearance reduzida. O clearance de pegvisomanto observado após doses múltiplas é mais baixo do que o observado após uma única dose. O clearance sistêmico corporal médio de pegvisomanto após doses múltiplas subcutâneas de 10 a 20 mg/dia varia de 36 a 28 mL/h, respectivamente. O clearance de pegvisomanto costuma aumentar de acordo com o peso corporal. O pegvisomanto é eliminado do soro sanguíneo com uma meia-vida de aproximadamente 6 dias, tanto após dose única como doses múltiplas.
Menos de 1% da dose administrada é recuperada na urina após 96 horas. A rota de eliminação do pegvisomanto não foi estudada em humanos.
Populações especiais
- Renal: nenhum estudo farmacocinético foi conduzido em pacientes com insuficiência renal.
- Hepático: nenhum estudo farmacocinético foi conduzido em pacientes com insuficiência hepática.
- Geriátrico: nenhum estudo farmacocinético foi conduzido em pacientes idosos.
- Pediátrico: nenhum estudo farmacocinético foi conduzido em pacientes pediátricos.
- Gênero: nenhum efeito farmacocinético relacionado ao gênero (sexo masculino ou feminino) dos pacientes foi observado durante a análise farmacocinética de uma população.
- Etnia: efeitos farmacocinéticos do pegvisomanto relacionados à etnia não foram estudados
Dados de Segurança Pré-Clínicos
Os dados pré-clínicos não revelaram riscos especiais para humanos com base nos estudos convencionais de toxicidade de dose repetida em ratos e macacos e de potencial carcinogênico em ratos. No entanto, devido à resposta farmacológica acentuada em macacos, não foram estudadas exposições sistêmicas mais elevadas do que aquelas atingidas em pacientes nas doses terapêuticas.
Histiocitomas fibrosos malignos associados a fibrose e inflamação histiocítica foram observados nos locais de injeção em machos no estudo de carcinogenicidade em ratos em níveis de exposição equivalentes a três vezes a exposição humana com base nas concentrações plasmáticas médias em dois estudos de longo prazo com uma dose diária de 30 mg. A relevância desta resposta para os seres humanos é atualmente desconhecida. O aumento da incidência de tumores no local da injeção foi provavelmente causado por irritação e alta sensibilidade do rato a injeções subcutâneas repetidas.
Os efeitos do pegvisomanto no início do desenvolvimento embrionário e no desenvolvimento embrio-fetal foram avaliados em dois estudos separados, realizados em coelhas prenhas com pegvisomanto em doses subcutâneas de 1, 3 e 10 mg/kg/dia. Não houve evidência de efeitos teratogênicos associados à administração de pegvisomanto durante a organogênese. Na dose de 10 mg/kg/dia (6 vezes a dose terapêutica humana máxima com base na área da superfície corporal), foi observado um aumento na perda pós-implantação quando o pegvisomanto foi administrado a partir de GD 0-7. Não foram realizados estudos de fertilidade.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)