Qual a ação da substância do Radicava?
Resultados de Eficácia
A eficácia do Edaravona para o tratamento da ELA foi estabelecida a partir um estudo duplo-cego, randomizado, controlado com placebo, de 6 meses, conduzido em pacientes japoneses com ELA que viviam independentemente e atendiam os seguintes critérios na triagem:
- A funcionalidade mantida na maioria das atividades da vida diária (definida como pontuações de 2 pontos ou mais em cada item individual da Escala de Avaliação Funcional de ALS - Revisado [ALSFRS-R; descrito abaixo]);
- Função respiratória normal (definida como valores percentuais de capacidade vital forçada previstos de [% FVC] ≥ 80%);
- ELA definitiva ou provável com base nos critérios revisados de El Escorial;
- Duração da doença de 2 anos ou menos.
O estudo envolveu 69 pacientes no braço Edaravona e 68 no braço placebo. As características basais foram semelhantes entre esses grupos, com mais de 90% dos pacientes em cada grupo sendo tratados com riluzol.
Edaravona foi administrado como uma infusão intravenosa de 60 mg administrada durante um período de 60 minutos de acordo com o seguinte cronograma:
- Administração diária por 14 dias, seguido de período de 14 dias sem administração do medicamento;
- Ciclos subsequentes de tratamento: administração diária por 10 dias em período de duas semanas (14 dias), seguido de período de 14 dias sem administração do medicamento.
O endpoint primário de eficácia foi uma comparação da mudança entre os braços de tratamento no total de ALSFRS-R pontuações desde o início até a semana 24. A escala ALSFRS-R consiste em 12 questões que avaliam a função motora fina, motora grossa, bulbar e respiratória de pacientes com ELA (fala, salivação, deglutição, caligrafia, corte de alimentos, curativo / higiene, virar na cama, caminhar, subir escadas, dispneia, ortopneia e insuficiência respiratória). Cada item é pontuado de 0 a 4, com pontuações mais altas representando maior capacidade funcional. O declínio nas pontuações ALSFRS-R da linha de base foi significativamente menor nos pacientes tratados com Edaravona em comparação com o placebo (ver Tabela 1). A distribuição da mudança nas pontuações ALSFRS-R desde o início até a Semana 24 por porcentagem dos pacientes é mostrada na Figura 1.
Tabela 1: Alterações médias da linha de base na pontuação ALSFRS-R
| - | Número de casos avaliados a | Pontuação de ALSFRS-R b | Alterações médias da linha de base d,e | Comparação com o grupo placebo e | ||
| Antes do 1º ciclo | Ao final da avaliação c | Diferença entre os grupos [95% CI] | Valor p | |||
| Grupo Placebo | 66 | 41.9 ± 2.2 | 35.0 ± 5.6 | -7.50 ± 0.66 | 2.49 [0.99, 3.98] | 0.0013 |
| Grupo edaravona | 68 | 41.9 ± 2.5 | 37.5 ± 5.3 | -5.01 ± 0.64 | ||
a Os casos que completaram o 3º ciclo (alcançado o Dia 81 após o início do tratamento) foram avaliados.
b Média ± SD.
c No tempo de 2 semanas após a conclusão do 6º ciclo ou descontinuação do tratamento (LOCF).
d Mudança média ajustada ± SE.
e Com base em um modelo de análise de variância com grupos de tratamento, alterações médias nas pontuações ALSFRS-R no período de run-in, sintomas iniciais (sintoma bulbar/membro) e tratamento concomitante com Riluzol como fatores.
Edaravona não foi avaliado em um estudo que possa esclarecer o efeito do medicamento na sobrevivência de pacientes com ELA.
Figura 1 - Distribuição da mudança da linha de base até a semana 24 nas pontuações ALSFRS-R
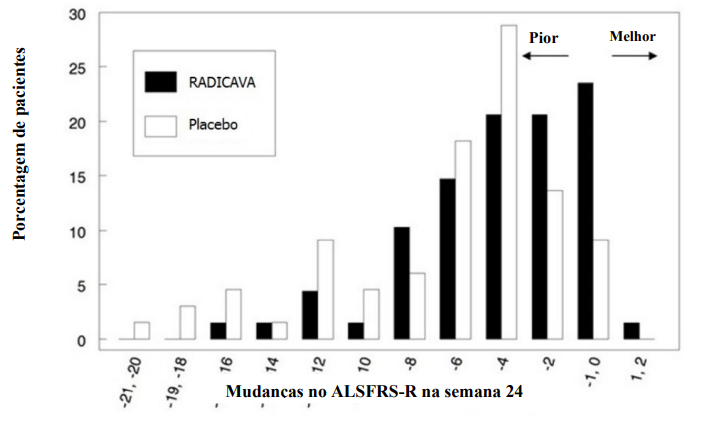
Dados obtidos em estudos clínicos demonstraram diferença nos resultados da edaravona para os mais variados graus de apresentação clínica de pacientes com ELA.
Referências bibliográficas
1. Mitsubishi Tanabe Pharma Corporation: The second confirmatory study (internal report). Abe, K. et al.: Amyotroph Lateral Scler Frontotemporal Degener. 2014;15(7-8): 610-617.
Características Farmacológicas
Propriedades Farmacodinâmicas
Grupo Farmacoterapêutico: Agente neuroprotetor (sequestrante de radicais livres).
Mecanismo de ação
Embora a etiologia de desenvolvimento e o progresso da ELA sejam desconhecidos sugere-se um possível envolvimento do estresse oxidativo causado por radicais livres.
A edaravona sequestra os radicais livres e inibe a peroxidação lipídica, prevenindo assim o dano oxidativo às células cerebrais (células endoteliais vasculares/células nervosas). No caso da ELA a edaravona suprime a progressão da doença, exercendo seus efeitos inibitórios contra o desenvolvimento de dano oxidativo às células nervosas.
Efeitos farmacodinâmicos
Em um estudo não clínico usando ratos transgênicos com mutação para superóxido dismutase (conhecido como um gene responsável pela ELA familiar), a edaravona foi administrada por via intravenosa a 3 mg/kg/h durante 1 hora por 2 dias, seguida de interrupção por 2 dias como um ciclo, e o ciclo foi repetido até a perda do reflexo de endireitamento. O resultado mostrou um efeito inibitório significativo na redução do ângulo em ratas, em um teste de plano inclinado para avaliar a função motora em extremidades.
Eletrofisiologia cardíaca
A edaravona não prolonga o intervalo QT em extensão clinicamente relevante em doses até cinco vees superiores às recomendadas.
Propriedades Farmacocinéticas
Absorção
Não aplicável, visto que a edaravona é administrada por via intravenosa.
Distribuição
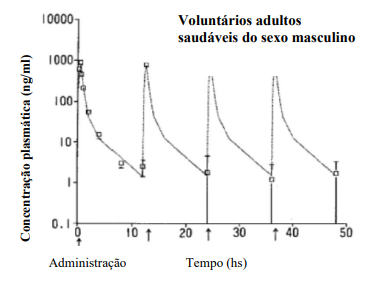
O perfil da concentração plasmática de fármaco inalterado após múltiplas doses intravenosas (0,5 mg/kg), administradas por 30 minutos duas vezes por dia, durante 2 dias, em 5 adultos saudáveis do sexo masculino é ilustrado na Figura 1, e os parâmetros farmacocinéticos calculados a partir dos perfis de concentração plasmática do fármaco inalterado após a dose inicial são fornecidas Tabela 2.
Figura 2 - Concentração plasmática de edaravona em cinco adultos saudáveis do sexo masculino
As taxas de ligação in vitro da edaravona, em concentrações de 5 e 10 micromoles/L, às proteínas séricas humanas e albumina humana foram 92% e 89-91%, respetivamente.
Metabolismo
O principal metabólito observado no plasma de indivíduos adultos saudáveis do sexo masculino e idosos saudáveis do sexo masculino foi o conjugado de sulfato, tendo o conjugado glucuronídeo também sido detectado. Na urina, o principal metabólito observado foi o conjugado glicuronídeo, tendo o conjugado sulfato também sido detectado.
Eliminação
Após administração intravenosa de 1,0 mg/kg de edaravona durante 40 minutos a cinco indivíduos saudáveis do sexo masculino, 90,43 ± 4,38% da dose administrada foi excretada na urina nas 24 horas após o início da administração. As taxas de excreção urinária de edaravona inalterada, conjugado de sulfato e conjugado glicuronídeo foram de 0,68 ± 0,13%, 6,58 ± 1,69%, e 83,17 ± 4,36% da dose administrada, respectivamente.
Após a administração intravenosa repetida da edaravona a adultos saudáveis do sexo masculino duas vezes ao dia por 2 dias (0,5 mg/kg/30 minutos, 2 vezes/dia), 0,7-0,9% e 71,0-79,9% da dose foram recuperados como fármaco inalterado e metabólitos na urina, respectivamente, até 12 horas após cada dose.
Farmacocinética em populações especiais
Crianças
Não existem dados farmacocinéticos de edaravona em crianças.
Pacientes idosos
Nenhum ajuste de dose relacionado à idade é necessário.
Quando 0,5 mg/kg de edaravona foi administrado a voluntários idosos e indivíduos adultos saudáveis por infusão intravenosa durante 30 minutos, não foram encontradas diferenças estatisticamente significativas nos parâmetros farmacocinéticos entre estes grupos até 12 horas após a primeira administração.
Tabela 2: Comparação dos parâmetros farmacocinéticos da edaravona entre indivíduos adultos saudáveis e indivíduos idosos saudáveis
| Parâmetros farmacocinéticos * | Indivíduos adultos saudáveis (n = 5) | Indivíduos idosos saudáveis (n = 5) | Teste t |
| Cmáx (ng/mL) | 888 ± 171 | 1,041 ± 106 | p = 0,127 |
| t1/2α (horas) | 0,27 ± 0,11 | 0,17 ± 0,03 | p = 0,081 |
| t1/2β (horas) | 2,27 ± 0,80 | 1,84 ± 0,17 | p = 0,269 |
| Vdss (L/kg) | 0,93 ± 0,20 | 0,86 ± 0,10 | p = 0,502 |
| Depuração de creatinina (mL/min) | 113,2 ± 13,8 | 94,7 ± 13,2 | p = 0,061 |
* Média ± SD.
Insuficiência renal
Insuficiência renal leve e moderada não tem efeitos clinicamente significativos no perfil farmacocinético da edaravona. Portanto, nenhum ajuste de dose é necessário nesses pacientes. Não foram realizados estudos para caracterizar a farmacocinética da edaravona ou estabelecer a sua segurança em pacientes com insuficiência renal grave.
Após infusão intravenosa única de 30 mg de edaravona durante 60 minutos, a Cmáx média e AUC0- ∞ da edaravona inalterada foram 1,15 e 1,20 vezes maiores em indivíduos com insuficiência renal leve (taxa de filtração glomerular estimada (eTFG) 60-89 mL/min/1,73m2) do que em indivíduos com função renal normal, e foram 1,25 e 1,29 vezes maiores em indivíduos com insuficiência renal moderada (eTFG 30-59 mL/min/1,73m2) do que em indivíduos com função renal normal, respectivamente. A Cmáx média e AUC0-∞ do conjugado de sulfato inativo foram 1,41 e 1,50 vezes maiores em indivíduos com insuficiência renal leve do que em indivíduos com função renal normal, e foram 1,41 e 1,97 vezes maiores em indivíduos com insuficiência renal moderada do que em indivíduos com função renal normal, respectivamente. Com base em tais dados concluiu-se que não houve efeito clinicamente significativo de insuficiência renal leve a moderada na farmacocinética da edaravona.
Insuficiência hepática
A insuficiência hepática leve, moderada e grave não tem efeitos clinicamente significativos no perfil farmacocinético da edaravona. Portanto, nenhum ajuste de dose é necessário nesses pacientes.
Após infusão intravenosa única de 30 mg de edaravona durante 60 minutos, a Cmáx média e AUC0-∞ da edaravona inalterada foram 1,20 e 1,07 vezes maiores em indivíduos com insuficiência hepática leve (pontuação de Child-Pugh 5 ou 6) do que em indivíduos com função hepática normal, e foram 1,24 e 1,14 vezes maiores em indivíduos com insuficiência hepática moderada (pontuação de Child-Pugh 7 a 9) do que em indivíduos com função hepática normal; já em indivíduos com insuficiência hepática grave (pontuação de Child-Pugh de 10 a 14), foram 1,20 e 1,19 vezes maiores do que em indivíduos com função hepática normal, respectivamente. Em comparação com indivíduos com função hepática normal, a Cmáx média e AUC0-∞ do conjugado de sulfato inativo foram 1,16 e 1,26 vezes maiores em indivíduos com insuficiência hepática leve, 0,96 e 1,31 vezes maiores em indivíduos com insuficiência hepática moderada e 0,99 e 1,58 vezes maiores em indivíduos com insuficiência hepática grave. Com base em tais dados concluiu-se que não houve efeito clinicamente significativo de insuficiência hepática leve a grave na farmacocinética da edaravona.
Segurança pré-clínica
Os dados pré-clínicos não revelam riscos especiais para humanos, baseado em estudos convencionais de farmacologia de segurança e genotoxicidade.
Em um teste de dependência psicológica em macacos, um efeito de reforço fraco foi observado. Na administração subcutânea a porquinhos da índia, foi observada uma reação alérgica cutânea retardada.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)