Qual a ação da substância do Naglazyme?
Resultados de Eficácia
Estudos clínicos
Cinco estudos foram concluídos. Um total de 56 pacientes com MPS VI e idades entre 5 e 29 anos foram inscritos em quatro estudos clínicos. Também foi realizado um estudo de fase 4, randomizado, em quatro pacientes com MPS VI com menos de 1 ano de idade. A maioria dos pacientes apresentava manifestações graves da doença, evidenciadas por desempenho insatisfatório em testes de resistência física.
No estudo clínico randomizado, duplo-cego, multicêntrico, controlado com placebo, 38 pacientes com MPS VI receberam Galsulfase1 mg/kg ou placebo uma vez por semana, durante 24 semanas. A idade dos pacientes variou entre 5 e 29 anos, sendo que a mediana dos valores de idade dos pacientes era de 12 anos. A inclusão foi restrita aos pacientes que percorriam uma distância entre 5 e 400 metros em 12 minutos de caminhada. Todos os pacientes receberam antihistamínico antes de cada infusão.
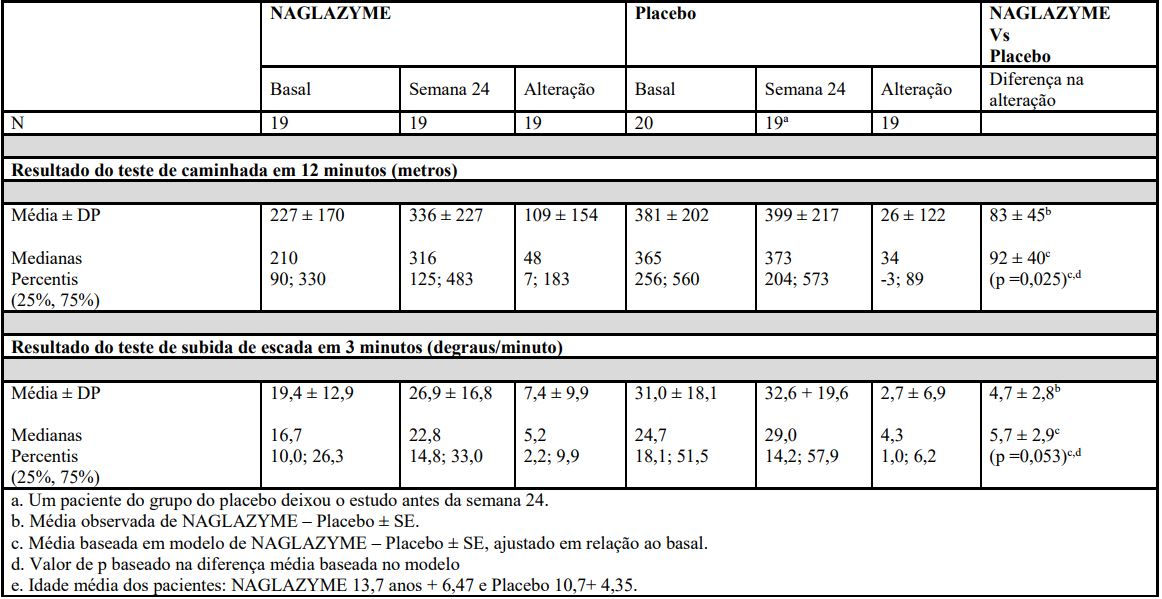
O grupo que utilizou Galsulfaseapresentou maior aumento médio da distância caminhada em 12 minutos (teste de caminhada de 12 minutos, 12-MWT) e maior velocidade na subida de degraus, no teste de subida de escada em 3 minutos, em comparação com o grupo que utilizou placebo (tabela 1 a seguir).
Após o período de 24 semanas de estudo controlado com placebo, trinta e oito pacientes receberam Galsulfasena fase aberta do estudo por mais 72 semanas. Entre os 19 pacientes inicialmente randomizados para receber Galsulfaseque continuaram a receber o tratamento por 72 semanas (total de 96 semanas) foram observados aumentos da distância percorrida no teste de 12 minutos de caminhada (12 MWT) e da velocidade de subida de escada em comparação com o início da fase aberta (média [±DP] alteração): 72 ± 116 metros e 5,6 ± 10,6 degraus/minuto, respectivamente).
Entre os 19 pacientes que haviam sido inicialmente randomizados para receber placebo por 24 semanas e posteriormente direcionados para o uso de Galsulfase, os aumentos após 72 semanas de uso de Galsulfase, comparado com o início do período aberto do estudo (média [±DP] alteração), foram: 118 ± 127 metros e 11,1 ± 10,0 degraus/minuto para o teste de 12 minutos (12 MWT) e da velocidade de subida de escada, respectivamente.
A bioatividade foi avaliada por meio da concentração urinária de GAG. No total, 95% dos pacientes apresentaram pelo menos 50% de redução dos níveis de GAG urinário após 72 semanas de uso de Galsulfase. Nenhum paciente, que recebeu Galsulfase, atingiu a faixa normal de níveis de GAG urinário.
Em um estudo de extensão realizado após o estudo aberto, os pacientes que receberam Galsulfasemantiveram a melhora inicial na resistência por aproximadamente 240 semanas.
Na fase 4 do estudo randomizado com duas doses distintas, quatro pacientes com MPS VI com menos de 1 ano de idade foram tratados com 1 ou 2 mg/kg/semana durante 53 a 153 semanas.
Embora limitadas pelo pequeno número de pacientes inclusos, as seguintes conclusões podem ser obtidas com o estudo:
O tratamento com Galsulfasedemonstrou melhora, ou estabilização do dismorfismo facial.
Não evitou o progresso da displasia esquelética e do desenvolvimento de hérnias, e não evitou a progressão da opacidade corneal. A taxa de crescimento permaneceu normal ao longo do período limitado de acompanhamento. Foi observada melhora da audição em pelo menos um ouvido de todos os quatro participantes. Os níveis de GAG na urina foram reduzidos em mais de 70%, compatível com resultados em pacientes mais velhos.
Os resultados de segurança em bebês foram consistentes com os resultados observados nos pacientes com 5 a 29 anos de idade.
Tabela 1: Resultados dos estudos clínicos controlados com placebo
Características Farmacológicas
Mecanismo de ação
As doenças de depósito de mucopolissacarídeos são causadas pela deficiência de enzimas lisossomais específicas, necessárias para o catabolismo dos glicosaminoglicanos (GAG). A mucopolissacaridose tipo VI (MPS VI, síndrome de Maroteaux-Lamy) caracteriza-se por ausência ou redução importante da atividade da N–acetilgalactosamina 4-sulfatase (aril-sulfatase B, ASB).
A deficiência na atividade da sulfatase resulta no acúmulo do substrato GAG, sulfato de dermatam, em todo o organismo. Esse acúmulo causa disfunção celular, tecidual e orgânica generalizadas. Galsulfaseé composto por uma enzima exógena captada pelos lisossomos, a qual cataboliza os GAG. A captação da galsulfase pelas células e sua entrada nos lisossomos é muito provavelmente mediada pela ligação a cadeias oligossacarídicas terminadas em manose-6- fosfato da galsulfase a receptores específicos de manose-6-fosfato.
Propriedades farmacodinâmicas
Não se conhece a relação entre a concentração de GAG urinário e as diferentes doses de Galsulfase. A relação entre a concentração de GAG urinário e a resposta clínica não foi estabelecida. Não foi observada associação entre o desenvolvimento de anticorpos e níveis de GAG urinário.
Propriedades farmacocinéticas
Os parâmetros farmacocinéticos da galsulfase foram avaliados em 13 pacientes com MPS VI que receberam 1 mg/kg de Galsulfasepor meio de infusão semanal de 4 horas, durante 24 semanas.
Os parâmetros farmacocinéticos nas semanas 1 e 24 estão apresentados na tabela 2.
Tabela 2: Parâmetros farmacocinéticos (mediana, intervalo)
Parâmetros farmacocinéticos | Semana 1 | Semana 24 |
Cmax (mcg/mL) | 0,8 (0,4 a 1,3) | 1,5 (0,2 a 5,5) |
ASC0-t (h-mcg/mL)a | 2,3 (1,0 a 3,5) | 4,3 (0,3 a 14,2) |
Vz (mL/kg) | 103 (56 a 323) | 69 (59 a 2,799) |
CL (mL/kg/min) | 7,2 (4,7 a 10,5) | 3,7 (1,1 a 55,9) |
Meia-vida (min) | 9 (6 a 21) | 26 (8 a 40) |
Cmax - concentração plasmática máxima.
ASC0-t - área sob a curva de tempo x concentração plasmática de galsulfase do início da infusão até 60 minutos após a infusão.
Vz - Volume de distribuição.
CL- clearance plasmático.
Os parâmetros farmacocinéticos da galsulfase relacionados na tabela 2 requerem cuidados na interpretação devido à alta variabilidade do teste. O desenvolvimento de anticorpos antigalsulfase parece ter impacto na farmacocinética da galsulfase, contudo, os dados são limitados.
Potencial imunogênico
Noventa e oito por cento (53/54) dos pacientes tratados com Galsulfasee submetidos à avaliação da presença de anticorpos antigalsulfase desenvolveram anticorpos IgG antigalsulfase entre 4 a 8 semanas de tratamento (em quatro estudos clínicos). Em dezenove pacientes que utilizaram Galsulfaseem estudos clínicos controlados com placebo, amostras de soro foram avaliadas para verificar a potencial relação do desenvolvimento de anticorpos antigalsulfase e os resultados clínicos.
Todos os dezenove pacientes que utilizaram Galsulfasedesenvolveram anticorpos específicos contra a galsulfase; contudo, a análise não mostrou relação previsível consistente entre o título total de anticorpos, anticorpos neutralizadores ou IgG e reações associadas à infusão, níveis urinários de glicosaminoglicanos (GAG) ou resultados dos testes de resistência física. Os anticorpos foram avaliados em relação à capacidade de inibição da atividade enzimática mas não em relação à capacidade de captação celular.
Os dados refletem a porcentagem de pacientes cujos resultados dos testes foram considerados positivos para os anticorpos anti-galsulfase usando um determinado ensaio; isto faz com que os resultados sejam altamente dependentes da sensibilidade e especificidade deste ensaio.
Adicionalmente, a observação da incidência de anticorpos em um ensaio pode ser influenciada por vários fatores como a manipulação da amostra; o horário de coleta da amostra; medicações concomitantes e doença de base. Por estas razões, a comparação entre a incidência de anticorpos antigalsulfase com a incidência de anticorpos para outros produtos pode ser equivocada.
Toxicologia não clínica
Carcinogêse; mutagênese e redução da fertilidade.
Não foram realizados estudos de longo prazo para avaliar o potencial carcinogênico e o potencial mutagênico da galsulfase.
O uso da galsulfase em dose intravenosa de até 3,0 mg/Kg (aproximadamente 0,5 vezes a dose recomendada para seres humanos, de 1 mg/Kg com base na superfície corpórea) não teve efeito na fertilidade e na reprodução de ratos machos e fêmeas.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)