Qual a ação da substância do Leflunomida Biosintética - Aché?
Resultados de Eficácia
Artrite Reumatoide
A eficácia de Leflunomida no tratamento da artrite reumatoide (AR) foi demonstrada em três estudos clínicos controlados mostrando redução dos sinais e sintomas e inibição dos danos estruturais. Em dois destes três estudos clínicos controlados, a eficácia também foi demonstrada na melhora da função física.
Em todos os estudos de monoterapia com Leflunomida, uma dose inicial de ataque de 100 mg/dia por três dias só foi utilizada seguida de 20 mg por dia, após estes três primeiros dias de dose de ataque.
US301
O estudo US301, um estudo placebo-controlado de 2 anos, randomizou 482 pacientes com AR ativa com pelo menos 6 meses de duração para receber 20 mg/dia de leflunomida (n = 182), 7,5 mg/semana de metotrexato aumentando para 15 mg/semana (n = 182) ou placebo (n = 118). Todos os pacientes receberam 1 mg de folato duas vezes ao dia. A análise primária foi realizada após 52 semanas com tratamento cego até 104 semanas.
De maneira geral, 235 dos 508 pacientes randomizados (482 na análise primária de dados e mais 26 pacientes adicionais), continuaram o tratamento duplo-cego por mais 12 meses (98 recebendo leflunomida, 101 recebendo metotrexato e 36 recebendo placebo). A dose de leflunomida continuou com 20 mg/dia e a dose de metotrexato poderia ser aumentada até um máximo de 20 mg/semana. No total, 190 pacientes (83 recebendo leflunomida, 80 recebendo metotrexato e 27 recebendo placebo) completaram os dois anos de tratamento duplo-cego.
MN301/303/305
O estudo MN301, um estudo placebo-controlado, randomizou 358 pacientes com AR ativa para receber 20 mg/dia de leflunomida (n = 133), 2,0 g/dia de sulfassalazina (n = 133) ou placebo (n = 92). A duração do tratamento foi de 24 semanas. Uma extensão do estudo foi uma continuação opcional do estudo MN301, sem o grupo placebo, resultando em uma comparação de 12 meses de leflunomida e sulfassalazina (estudo MN303).
Dos 168 pacientes que completaram 12 meses de tratamento nos estudos MN301 e MN303, 146 pacientes (87%) entraram em um estudo de extensão de 1 ano sem o grupo placebo, de tratamento ativo duplo-cego (MN305: 60 recebendo leflunomida, 60 recebendo sulfassalazina e 26 recebendo placebo/sulfassalazina). Os pacientes continuaram com a mesma dose diária de leflunomida ou sulfassalazina que eles estavam tomando quando eles completaram os estudos MN301/303. Um total de 121 pacientes (53 recebendo leflunomida, 47 recebendo sulfassalazina e 21 recebendo placebo/sulfassalazina) completou os dois anos de tratamento duplo-cego.
MN302/304
O estudo MN302, um estudo controlado ativo sem o grupo placebo, randomizou 999 pacientes com AR ativa para receber 20 mg/dia de leflunomida (n = 501) ou 7,5 mg/semana de metotrexato aumentando para 15 mg/semana (n = 498). O suplemento de folato foi usado em 10% dos pacientes. A duração do tratamento foi de 52 semanas.
Dos 736 pacientes que completaram as 52 semanas de tratamento no estudo MN302, 612 (83%) entraram no estudo de extensão de 1 ano duplo-cego MN304 (292 recebendo leflunomida, 320 recebendo metotrexato). Os pacientes continuaram recebendo a mesma dose diária de leflunomida ou metotrexato que eles estavam recebendo quando completavam o estudo MN302. Quinhentos e trinta e três pacientes (256 recebendo leflunomida, 277 recebendo metotrexato) completaram os 2 anos de tratamento duplo-cego.
Sinais e Sintomas da Artrite Reumatoide
O alívio dos sinais e sintomas foi avaliado utilizando-se o Índice de Respondedores ACR20 do American College of Rheumatology, composto de medições clínicas, laboratoriais e funcionais da artrite reumatoide. Um “Respondedor ACR20” é um paciente que apresentou uma melhora ≥ 20%, tanto na contagem de articulações tumefactas como na contagem de articulações dolorosas, além de uma melhora em 3 dos 5 seguintes critérios: avaliação global realizada pelo médico, avaliação global realizada pelo paciente, medição da habilidade funcional [Modified Health Assessment Questionnaire (MHAQ)], Escala Visual Analógica de dor e taxa de sedimentação eritrócitária ou proteína C-reativa. Um “Respondedor ACR20 no Desfecho” é um paciente que completou o estudo e foi um “Respondedor ACR20” ao final do estudo.
As taxas do Respondedor ACR20 no desfecho são apresentadas na Figura 1. Estatisticamente, o tratamento com Leflunomida foi significativamente superior ao placebo na redução dos sinais e sintomas da AR, segundo a análise de eficácia primária, Respondedor ACR20 no desfecho, nos estudos US301 (desfecho primário de 12 meses) e MN301 (desfecho de 6 meses). As taxas do Respondedor ACR20 no desfecho com tratamento com Leflunomida foram consistentes ao longo dos estudos de 6 e 12 meses (41 – 49%). Não foram demonstradas diferenças consistentes entre leflunomida e metotrexato, ou entre leflunomida e sulfassalazina. O efeito do tratamento com Leflunomida mostrou-se evidente após 1 mês, estabilizando-se entre os meses 3 – 6 e continuando ao longo do tratamento, conforme apresentado na Figura 2.
Figura 1
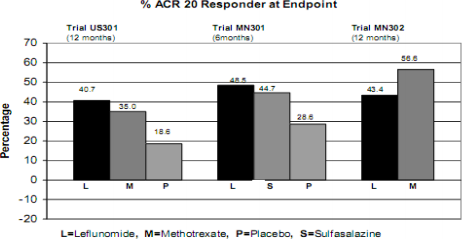
| - | Comparações | Intervalo de Confiança | Valor p |
US301 | Leflunomida vs. Placebo | (12, 32) | < 0,0001 |
Metotrexato vs. Placebo | (8, 30) | < 0,0001 | |
Leflunomida vs. Metotrexato | (-4, 16) | NS | |
MN301 | Leflunomida vs. Placebo | (7, 33) | 0,0026 |
Sulfassalazina vs. Placebo | (4, 29) | 0,0121 | |
Leflunomida vs. Sulfassalazina | (-8, 16) | NS | |
MN302 | Leflunomida vs. Metotrexato | (-19, -7) | < 0,0001 |
Figura 2
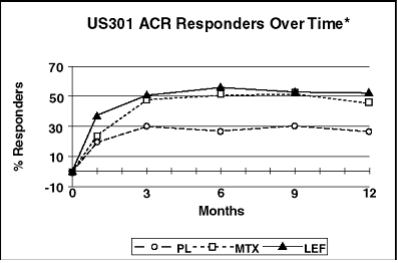
*Última observação realizada.
Os Respondedores ACR50 e ACR70 são definidos de maneira análoga ao Respondedor ACR20, mas utilizam melhoras de 50% ou 70%, respectivamente (Tabela 1). A alteração média dos componentes individuais do Índice de Respondedores ACR é apresentada na Tabela 2.
Tabela 1. Resumo das Taxas de Resposta ACR*
Grupo de Estudo e Tratamento | ACR20 | ACR50 | ACR70 |
Estudos Placebo-Controlados | |||
US301 (12 meses) | |||
Leflunomida (n=178)† | 52,2‡ | 34,3‡ | 20,2‡ |
Placebo (n=118)† | 26,3 | 7,6 | 4,2 |
Metotrexato (n=180)† | 45,6 | 22,8 | 9,4 |
MN301 (6 meses) | |||
Leflunomida (n=130)† | 54,6‡ | 33,1‡ | 10,0§ |
Placebo (n=91)† | 28,6 | 14,3 | 2,2 |
Sulfassalazina (n=132)† | 56,8 | 30,3 | 7,6 |
Estudos sem grupo placebo | |||
MN302 (12 meses) | |||
Leflunomida (n=495)† | 51,1 | 31,1 | 9,9 |
Metotrexato (n=489)† | 65,2 | 43,8 | 16,4 |
*Análise por intenção de tratamento (ITT) utilizando a técnica da Última Observação Realizada (LOCF), para pacientes que interromperam o tratamento precocemente.
† N é o número de pacientes ITT para os quais havia dados adequados disponíveis para cálculo das taxas indicadas.
‡ p > 0,001 leflunomida vs. placebo.
§ p > 0,02 leflunomida vs. placebo.
A Tabela 2 apresenta os resultados dos componentes dos critérios de resposta ACR para os estudos US301, MN301 e MN302. O tratamento com Leflunomida foi significativamente superior ao placebo em todos os componentes dos critérios de resposta ACR nos estudos US301 e MN301. Além disso, o tratamento com Leflunomida foi significativamente superior ao placebo na melhora da rigidez matinal, um indicador da atividade de AR, não incluída nos critérios de resposta ACR. Não foram demonstradas diferenças consistentes entre o tratamento com Leflunomida e os comparadores ativos.
Tabela 2. Alteração Média nos Componentes do Índice de Respondedores ACR*:
Componentes | Estudos Placebo-Controlados | Estudo Não-Placebo Controlado | ||||||
| --- | US301 (12 meses) | MN301 - Não-EUA (6 meses) | MN302 - Não-EUA (12 meses) | |||||
| --- | Leflunomida | Metotrexato | Placebo | Leflunomida | Sulfassalazina | Placebo | Leflunomida | Metotrexato |
Contagem de articulação dolorosa1 | -7,7 | -6,6 | -3,0 | -9,7 | -8,1 | -4,3 | -8,3 | -9,7 |
Contagem de articulação tumefacta1 | -5,7 | -5,4 | -2,9 | -7,2 | -6,2 | -3,4 | -6,8 | -9,0 |
Avaliação global do paciente2 | -2,1 | -1,5 | 0,1 | -2,8 | -2,6 | -0,9 | -2,3 | -3,0 |
Avaliação global do médico2 | -2,8 | -2,4 | -1,0 | -2,7 | -2,5 | -0,8 | -2,3 | -3,1 |
Função física /desabilidade (MHAQ/HAQ) | -0,29 | -0,15 | 0,07 | -0,50 | -0,29 | -0,04 | -0,37 | -0,44 |
Intensidade da dor2 | -2,2 | -1,7 | -0,5 | -2,7 | -2,0 | -0,9 | -2,1 | -2,9 |
Taxa de sedimentação eritrocitária | -6,26 | -6,48 | 2,56 | -7,48 | -16,56 | 3,44 | -10,12 | -22,18 |
Proteína C-reativa | -0,62 | -0,50 | 0,47 | -2,26 | -1,19 | 0,16 | -1,86 | -2,45 |
Não incluído no Índice de Respondedores ACR | ||||||||
Rigidez matinal (min) | -101,4 | -88,7 | 14,7 | -93,0 | -42,4 | -6,8 | -63,7 | -86,6 |
* Última observação realizada; Alterações negativas indicam melhoras.
1 Com base na contagem de 28 articulações.
2 Escala Visual Analógica: 0 = Melhor; 10 = Pior.
Manutenção do efeito
Após completar 12 meses de tratamento, os pacientes que continuaram o tratamento do estudo foram avaliados por 12 meses adicionais, em tratamento duplo-cego (período total de 2 anos de tratamento) nos estudos US301, MN305 e MN304. As taxas de Respondedores ACR nos 12 meses foram mantidas ao longo de 2 anos na maioria dos pacientes que continuaram com um segundo ano de tratamento. A melhora a partir do baseline nos componentes individuais dos critérios de resposta ACR também foi mantida na maioria dos pacientes durante o segundo ano do tratamento com Leflunomida , em todos os três estudos.
Inibição do dano estrutural
A inibição do dano estrutural comparada ao controle foi avaliada através do Escore Sharp, um escore composto de erosões ao raio-X e redução do espaço articular, nas mãos/pulsos e frente dos pés.
A alteração na progressão da doença estrutural, a partir da linha basal até o desfecho, conforme medida pelo escore Sharp de raio-X, é apresentada na Figura 3. Estatisticamente, o estudo com Leflunomida foi significativamente superior ao placebo na inibição da progressão da doença pelo escore de Sharp. Não foram demonstradas diferenças consistentes entre a leflunomida e o metotrexato, ou entre a leflunomida e a sulfassalazina.
Figure 3
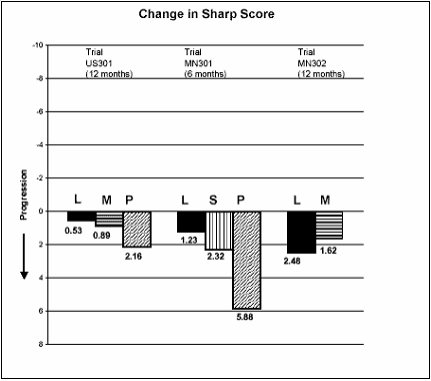
L = leflunomida.
M = metotrexato.
S = sulfassalazina.
P = placebo.
Comparações | Intervalo de Confiança 95% | Valor p | |
US301 | Leflunomida vs. Placebo | (-4,0 , -1,1) | 0,0007 |
Metotrexato vs. Placebo | (-2,6 , -0,2) | 0,0196 | |
Leflunomida vs. Metotrexato | (-2,3 , 0,0) | 0,0499 | |
MN301 | Leflunomida vs. Placebo | (-6,2 , -1,8) | 0,0004 |
Sulfassalazina vs. Placebo | (-6,9 , 0,0) | 0,0484 | |
Leflunomida vs. Sulfassalazina | (-3,3 , 1,2) | NS | |
MN302 | Leflunomida vs. Metotrexato | (-2,2 , 7,4) | NS |
Melhora na função física
A melhora na função física foi avaliada utilizando-se o Questionário de Avaliação de Saúde (HAQ) e o Formulário resumido de resultados médicos (SF-36). O questionário HAQ avalia a função física de um paciente e o grau de desabilidade. A alteração média na habilidade funcional, a partir da linha basal, medida pelo Índice de Desabilidade HAQ (HAQ DI), nos estudos placebo e ativo controlado de 6 e 12 meses é apresentada na Figura 4. Estatisticamente, o tratamento com Leflunomida foi significativamente superior ao placebo na melhora da função física. A superioridade em relação ao placebo foi demonstrada consistentemente em todas as oito subescalas HAQ D1 (ações de vestir, levantar-se, comer, andar, higiene, extensão do braço, ato de segurar e atividades) em ambos os estudos placebo-controlados.
O Formulário resumido de resultados médicos (SF-36), um questionário genérico de qualidade de vida relacionada à saúde, trata de maneira adicional a função física. No estudo US301, no mês 12, o tratamento com Leflunomida apresentou melhoras estatisticamente significante em comparação ao placebo no escore do sumário do componente físico (PCS).
Figura 4
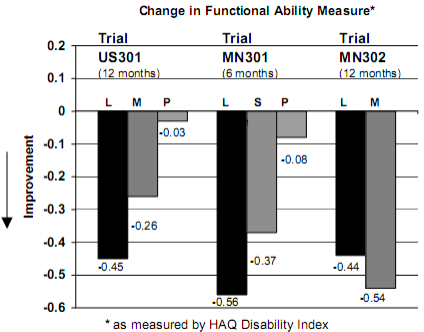
L = leflunomida.
M = metotrexato.
S = sulfassalazina.
P = placebo.
Comparações | Intervalo de Confiança 95% | Valor p | |
US301 | Leflunomida vs. Placebo | (-0,58 , -0,29) | 0,0001 |
Leflunomida vs. Metotrexato | (-0,34 , -0,07) | 0,0026 | |
MN301 | Leflunomida vs. Placebo | (-0,67 , -0,36) | < 0,0001 |
Leflunomida vs. Sulfassalazina | (-0,33 , -0,03) | 0,0163 | |
MN302 | Leflunomida vs. Metotrexato | (0,01 , 0,16) | 0,0221 |
Manutenção do efeito
A melhora na função física demonstrada nos meses 6 e 12 foi mantida por dois anos. Nos pacientes que continuaram a terapia por um segundo ano, essa melhora na função física, medida pelo HAQ e SF-36 (PCS), foi mantida.
Artrite Psoriática
Pacientes adultos com Artrite Psoriática (PsA) foram randomizados para receber leflunomida ou placebo. A duração do tratamento foi de 6 meses, com dose de 100 mg/dia de leflunomida por três dias, seguida de 20 mg/dia no período restante.
No grupo da leflunomida, dos pacientes totalmente analisáveis (n=186), 59,0% apresentaram uma melhora nos Critérios de Resposta ao Tratamento de Artrite Psoriática (PsARC), tratando-se do desfecho primário, comparada a 29,7% no grupo recebendo placebo (p<0,0001). O PsARC é uma medida que combina uma avaliação global realizada pelo médico, uma autoavaliação global realizada pelo paciente, um escore de articulação dolorosa e um escore de articulação tumefacta. A melhora no PsARC é definida como uma diminuição ≥ 30% nos escores de articulações e ≥1 ponto nas avaliações globais. Para ser considerado um respondedor, o paciente deveria apresentar uma melhora em pelo menos duas das medidas relacionadas acima, sendo uma delas de escore de articulação dolorosa ou tumefacta, e não apresentar piora em nenhuma das quatro medidas.
Tabela 3: Alteração Média nos Componentes do Índice de Respondedores PsARC*
Componentes | Estudo placebo-controlado (6 meses) | ||
| --- | Leflunomida (n=95) | Placebo (n=91) | Valores de p |
Escore de articulação dolorosa* | -9,1 | -4,6 | 0,0022 |
Escore de articulação tumefacta* | -6,8 | -4,2 | 0,0013 |
Avaliação global do médico – com melhora em pelo menos uma categoria1 | 52,6% | 34,1% | < 0,0001 |
Auto-avaliação global do paciente – com melhora em pelo menos uma categoria1 | 31,6% | 30,8% | 0,0036 |
* Alterações negativas indicam melhoras.
1 escala Likert de 5 pontos: 1 = Muito bom; 5 = Muito pobre.
Alterações no Índice de Área e Severidade da Psoríase (PASI) refletem alterações na extensão e severidade das lesões de psoríase, julgadas por eritema, descamação e infiltração. A leflunomida resultou em uma melhora significativa nos escores PASI ao longo das 24 semanas do estudo, em comparação ao grupo placebo, com uma melhora média (± DP) de 22,4% (± 51,6%) no grupo da leflunomida, comparada à uma deterioração de 2,2% (± 70,4%) no grupo recebendo placebo (p=0,0030). Em comparação com o grupo placebo, uma proporção significativamente maior de pacientes do grupo recebendo leflunomida apresentou uma redução ≥50% nos escores PASI (PASI 50; 18,9% vs. 30,4%; p=0,050) e uma redução ≥75% nos escores PASI a partir da linha basal (PASI 75; 7,8% vs. 17,4%; p=0,048).
Os eventos adversos observados no estudo clínico realizado em pacientes PsA foram comparáveis aos eventos adversos observados nos estudos clínicos realizados em pacientes com Artrite Reumatoide.
Exposição durante a gravidez
A leflunomida não deve ser utilizada em gestantes ou em mulheres em idade fértil que não estejam utilizando um método contraceptivo confiável durante o tratamento com leflunomida. A possibilidade de gravidez deve ser descartada antes do início do tratamento com leflunomida. Caso exista qualquer razão de suspeita de gravidez, as pacientes devem ser aconselhadas a notificar seus médicos para realizar um teste de gravidez e, se positivo, discutir os riscos relacionados com o resultado da gravidez. Os procedimentos de eliminação do fármaco para reduzir rapidamente o nível sanguíneo do metabólito ativo da leflunomida podem reduzir o risco ao feto.
Um estudo prospectivo do resultado da gravidez foi conduzido pela Organização dos Especialistas em Informação Teratológica (OTIS) para estimar o risco de defeitos de nascença e outros resultados adversos da gravidez em decorrência da exposição inadvertida à leflunomida no primeiro trimestre da gravidez. As gestantes foram incluídas em um de três grupos: mulheres com diagnóstico de artrite reumatoide que tomaram pelo menos uma dose de leflunomida (n=64), um grupo de comparação com a mesma patologia sem a exposição à leflunomida durante a gravidez (n=108) ou um grupo de comparação de gestantes saudáveis (n=78). A exposição inadvertida de leflunomida durante o primeiro trimestre da gravidez seguido de descontinuação do tratamento com o fármaco, mais um procedimento de “washout” com colestiramina resultou em grandes defeitos estruturais em 5,4% dos nascidos vivos comparado com os dois grupos comparativos (4,2% no grupo de comparação com a mesma patologia e 4,2% no grupo das gestantes saudáveis).
O resultado deste estudo, que foi descontinuado prematuramente devido a uma declinação no recrutamento, não altera a contraindicação inicial do uso de leflunomida durante a gravidez. Em particular, o estudo não lidou com possíveis riscos associados com o uso da leflunomida durante o período completo de desenvolvimento embrionário, uma vez que todos os indivíduos do grupo exposto à leflunomida descontinuaram a medicação após a identificação da gravidez. Aproximadamente todas foram submetidas a pelo menos um procedimento de eliminação do fármaco e a maioria das pacientes não foram expostas a leflunomida por um período maior que três semanas após a concepção.
Estudos pós-comercialização
Um estudo multicêntrico, randomizado e controlado avaliou a taxa de resposta de eficácia clínica em pacientes virgens de tratamento com DMARD (n = 121) com início de AR tratado com leflunomida, usando o critério de ACR20 avaliado em três meses como desfecho primário em grupos de tratamento posológico de dose inicial (com e sem dose de ataque).
Durante o período duplo-cego inicial de três dias, dois grupos paralelos receberam 20 mg ou 100 mg de leflunomida com placebo correspondente. O período inicial foi seguido por um período aberto de manutenção de três meses, durante o qual ambos os grupos receberam leflunomida 20 mg ao dia. A eficácia da leflunomida foi confirmada neste estudo, mas nenhum benefício adicional foi observado na população estudada com o uso da dose de ataque. No final do estudo, a taxa de resposta ACR20 foi 58,5% no grupo com a dose de ataque, contra 77,8% no grupo sem dose de ataque (p = 0,025). Para as variáveis secundárias analisadas (ACR50, ACR70, DAS28) não foram observadas diferenças significativas entre os dois grupos de tratamento em um limite de probabilidade de 0,05. Uma resposta clínica foi observada durante o primeiro mês de tratamento em mais da metade dos pacientes, sem diferença significativa em 30 dias, entre os grupos de tratamento para todos os critérios de eficácia. Os dados de segurança obtidos a partir dos dois grupos de tratamento foram consistentes com o conhecido perfil de segurança de leflunomida, no entanto, a incidência de eventos adversos gastrointestinais e o aumento das enzimas hepáticas tende a ser maior em pacientes recebendo a dose de ataque de 100 mg leflunomida.
Referências Bibliográficas
Strand V, et al. Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate. Leflunomide Rheumatoid Arthritis Investigators Group. Arch Intern Med. 1999 Nov;159(21):2542-50.
Smolen JS, et al. Efficacy and safety of leflunomide compared with placebo and sulphasalazine in active rheumatoid arthritis: a double-blind, randomised, multicentre trial. Lancet. 1999 Jan;353(9149):259-66.
Emery P, et al. A comparison of the efficacy and safety of leflunomide and methotrexate for the treatment of rheumatoid arthritis. Rheumatology (Oxford). 2000 Jun;39(6):655-65.
Smolen JS, et al. A randomized, double-blind study of leflunomide vs sulfasalazine in rheumatoid arthritis 1-year update. Ann Rheum Dis. 1999; 58(Abstr Suppl): 103. Abs: 397.
Kalden JR, et al. Multinational Leflunomide Study Group Leflunomide vs sulfasalazine in rheumatoid arthritis 24-month update of a randomized, double-blind study. Arthritis Rheum. 1999; 42(9 Suppl): S271. Abs: 1202.
Cohen S, et al. Two-year treatment of active rheumatoid arthritis (RA) with leflunomide (LEF) compared with placebo (PL) or methotrexate (MTX). Arthritis Rheum. 1999; 42(9 Suppl): S271. Abs: 1201.
Características Farmacológicas
Propriedades Farmacodinâmicas
Farmacologia humana
A leflunomida é um agente antirreumático com propriedades antiproliferativas. A leflunomida demonstrou melhorar os sinais e sintomas e reduzir o progresso da destruição das articulações na artrite reumatoide ativa. Nos estudos realizados, a maioria dos pacientes estava utilizando concomitantemente AINEs ou baixas doses de corticosteroides.
Farmacologia animal
Em modelos animais, a leflunomida demonstrou ser efetiva em artrites, outras doenças autoimunes e transplantes. A leflunomida possui características imunomoduladoras/imunossupressoras, age como agente antiproliferativo e apresenta propriedades anti-inflamatórias.
“In vivo”, a leflunomida é rapidamente e quase completamente metabolizada em seu metabólito ativo (A771726), que é ativo “in vitro” e se presume ser o responsável por toda a ação farmacológica do Leflunomida.
Em modelos animais de doenças autoimunes, a leflunomida apresentou os melhores efeitos protetores quando administrada logo na fase inicial da doença. Em modelos animais de rejeição a órgãos transplantados e doença crônica enxerto versus hospedeiro, a leflunomida prolongou o tempo de rejeição ou até mesmo reverteu reações de rejeição já instaladas. Além disso, a leflunomida demonstrou atividades anti-inflamatórias, ainda que com atividades analgésica e antipirética fracas ou ausentes. Em um modelo de septicemia experimental, a leflunomida não alterou a resistência de camundongos à infecção por bactérias patogênicas.
Mecanismo de Ação
O A771726, metabólito ativo da leflunomida, reduz a progressão das células-alvo atuando em diferentes fases do ciclo celular.
“In vitro”, após a estimulação da mitose, o metabólito ativo A771726 inibe a proliferação de células T e a síntese de DNA. O metabólito ativo inibe também a proliferação estimulada por mitose de células mononucleadas de sangue periférico humano e a proliferação de linhagens de células humanas e murinas de forma dose-dependente.
Esta atividade antiproliferativa é revertida pela adição de uridina na cultura celular, indicando que o A771726 age na biosíntese de pirimidina. Estudos de ligação utilizando substâncias radiomarcadas demonstraram que o metabólito ativo se liga e inibe a enzima humana di-hidroorotato desidrogenase (DHODH).
Em conjunto, estes dados sugerem que “in vivo”, as concentrações plasmáticas alcançáveis em pacientes recebendo a leflunomida podem inibir a síntese "de novo" de pirimidina em linfócitos e outras células com alta velocidade de divisão.
Além disso, foi relatado que o A771726 é capaz de inibir a enzima tirosina quinase, “in vitro” e “in vivo”. A atividade “in vitro” não parece ser mediada diretamente através de inibição enzimática, ocorrendo somente em concentrações bem mais altas do que as necessárias para a inibição da di-hidroorotato desidrogenase.
Propriedades Farmacocinéticas
A leflunomida é rapidamente convertida no seu metabólito ativo (A771726), através de metabolismo de primeira passagem na parede intestinal e fígado. Não foi detectada leflunomida inalterada no plasma, urina ou fezes em um estudo realizado com leflunomida radiomarcada com C14, em três voluntários saudáveis. Em outros estudos, as concentrações de leflunomida inalterada detectadas no plasma foram raramente detectadas, na ordem de ng/mL. O único metabólito plasmático radiomarcado detectado foi o A771726. Este metabólito é responsável por praticamente toda a atividade “in vivo” de Leflunomida .
Absorção
Os dados de excreção gerados através de estudos com C14 indicaram que pelo menos cerca de 82 a 95% da dose é absorvida. O tempo para atingir o pico de concentração plasmática do A771726 é muito variável. Os picos plasmáticos podem ocorrer entre 1 e 24 horas após administração única.
A leflunomida pode ser administrada com alimentos, uma vez que a extensão da absorção é comparável tanto nos estados de jejum ou pós-alimentação.
Devido à longa meia-vida do metabólito ativo (aproximadamente 2 semanas), uma dose de ataque de 100 mg, durante 3 dias, foi utilizada nos estudos clínicos para facilitar a rápida obtenção do estado de equilíbrio do A771726. Estima-se que, sem o recurso da dose de ataque, seriam necessários aproximadamente 2 meses de administração de Leflunomida para atingir o estado de equilíbrio. Em estudos que utilizaram doses múltiplas de leflunomida em pacientes com artrite reumatoide, os parâmetros farmacocinéticos do A771726 permaneceram lineares dentro da faixa de variação de dose de 5 a 25 mg. Nestes estudos, o efeito clínico foi estreitamente relacionado à concentração plasmática do A771726 e às doses diárias de leflunomida. Na dose de 20 mg/dia, a concentração plasmática média do A771726 no estado de equilíbrio é de aproximadamente 35 µg/mL. Os níveis plasmáticos no estado de equilíbrio acumulam aproximadamente 33 a 35 vezes mais metabólito ativo quando comparado à administração de dose única.
Distribuição
Em humanos, o A771726 é extensivamente ligado às proteínas plasmáticas, principalmente à albumina. A fração não ligada corresponde a aproximadamente 0,62%.
A ligação do A771726 varia linearmente conforme a concentração terapêutica, apresentando-se levemente reduzida e mais instável no plasma de pacientes com artrite reumatoide ou insuficiência renal crônica.
A ampla ligação do A771726 às proteínas plasmáticas pode levar ao deslocamento de outros medicamentos altamente ligados a estas proteínas. Entretanto, estudos "in vitro" de interação de ligação às proteínas plasmáticas com varfarina em concentrações clinicamente relevantes, não demonstraram nenhuma interação entre a varfarina e o A771726. Estudos similares demonstraram que o ibuprofeno e o diclofenaco não foram capazes de deslocar o A771726 das proteínas plasmáticas, enquanto que a fração não ligada do metabólito ativo aumentou cerca de 2 a 3 vezes na presença de tolbutamida. O A771726 foi capaz de deslocar tanto o ibuprofeno quanto o diclofenaco e a tolbutamida, porém a fração não ligada destes fármacos aumentou apenas de 10 a 50%. Não existem indicações da relevância clínica destes efeitos. O A771726 tem um volume aparente de distribuição baixo (aproximadamente 11L), o que é consistente com sua extensiva ligação às proteínas plasmáticas. Não existe absorção diferenciada pelos eritrócitos.
Metabolismo
A leflunomida é metabolizada ao metabólito ativo primário (A771726) e vários outros metabólitos secundários, incluindo TFMA (4-trifluormetilanilina). A biotransformação metabólica da leflunomida em A771726 e o metabolismo subsequente do A771726 não são controlados por uma única enzima e demonstraram ocorrer em frações celulares microssomais e citossólicas. Estudos de interações utilizando cimetidina (inibidor inespecífico do citocromo P450) e rifampicina (indutor inespecífico do citocromo P450) demonstraram que “in vivo”, estes sistemas enzimáticos estão envolvidos na metabolização da leflunomida somente numa pequena extensão.
Eliminação
A eliminação do metabólito ativo é lenta e caracterizada por um “clearance” aparente de cerca de 31 mL/h. A meia-vida de eliminação nos pacientes é de aproximadamente 2 semanas. Após a administração de uma dose radiomarcada de leflunomida, radioatividade foi excretada igualmente nas fezes, provavelmente devido à eliminação biliar, e na urina. O A771726 continuou sendo detectado na urina e nas fezes até 36 dias após administração única. Os principais metabólitos urinários foram glucoronídeos derivados da leflunomida (principalmente nas amostras coletadas no período de 0 a 24 horas) e um derivado do ácido oxanílico do metabólito ativo. O principal componente fecal foi o A771726.
Foi demonstrado no homem que a administração de uma suspensão oral de carvão ativado ou colestiramina leva a um aumento rápido e significativo da taxa de eliminação do A771726 e consequentemente redução das suas concentrações plasmáticas.
Este fato parece ser explicado pelo mecanismo de diálise gastrointestinal e/ou pela interrupção da reciclagem êntero-hepática.
Parâmetros farmacocinéticos na insuficiência renal
A leflunomida foi administrada em dose única oral de 100 mg a três pacientes em hemodiálise e três pacientes em diálise peritoneal contínua.
A farmacocinética do A771726 em pacientes em CAPD (diálise peritoneal contínua) pareceu ser similar à encontrada em voluntários saudáveis. Uma eliminação mais rápida do A771726 foi observada em pacientes sob hemodiálise, a qual não foi em decorrência da extração do fármaco no dialisado, mas sim devido ao deslocamento da ligação à proteína. Análise cinética da população total desses 6 pacientes demonstrou que, embora o “clearance” do A771726 esteja aumentado em aproximadamente 2 vezes, a meia-vida terminal de eliminação é similar àquela encontrada em indivíduos saudáveis, visto que o volume de distribuição também está aumentado.
Parâmetros farmacocinéticos na insuficiência hepática
Não existem dados disponíveis sobre o tratamento de pacientes com insuficiência hepática. O metabólito ativo A771726 é extensivamente ligado às proteínas plasmáticas e eliminado através de metabolismo hepático e secreção biliar. Estes processos podem ser afetados por alteração hepática.
Influência da idade
A farmacocinética em crianças e adolescentes não foi estudada. Até o momento, os dados farmacocinéticos em idosos (>65 anos) são limitados, mas consistentes com a farmacocinética em pacientes adultos jovens.
Fumantes
A análise farmacocinética de uma população, durante os estudos de Fase III, indicou que os fumantes tiveram 38% de aumento nos valores do “clearance” em relação aos não-fumantes; entretanto, nenhuma diferença na eficácia clínica foi observada entre os fumantes e não-fumantes.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)