Qual a ação da substância do Lartruvo?
Resultados de Eficácia
A eficácia de Olaratumabe foi demonstrada no Estudo Clínico JGDG, um estudo aberto, randomizado, controlado por ativo. Os pacientes elegíveis deveriam apresentar sarcoma de partes moles não suscetível ao tratamento curativo com radioterapia ou cirurgia, um tipo histológico de sarcoma para o qual um regime contendo antraciclina fosse apropriado, mas não havia sido administrado, PS ECOG de 0-2 e amostra tumoral disponível para a avaliação da expressão de PDGFR-α por um ensaio de uso investigativo.
Os pacientes foram randomizados (1:1) para receber Olaratumabe em combinação com doxorrubicina ou doxorrubicina como agente único. A expressão de PDGFR-α (positiva versus negativa), o número de linhas de tratamento anteriores (0 versus 1 ou mais), o tipo histológico de tumor (leiomiossarcoma versus sarcoma sinovial versus todos os outros) e o PS ECOG (0 ou 1 versus 2) foram utilizados para alocar os pacientes na randomização. Olaratumabe foi administrado a 15 mg/Kg como infusão intravenosa nos Dias 1 e 8 de cada ciclo de 21 dias, até a progressão da doença ou toxicidade inaceitável.
Todos os pacientes receberam doxorrubicina 75 mg/m2 como infusão intravenosa no Dia 1 de cada ciclo de 21 dias por, no máximo, oito ciclos, e puderam receber dexrazoxano antes de doxorrubicina nos ciclos 5 a 8. Aos pacientes randomizados para receber doxorrubicina como agente único foi oferecido Olaratumabe no momento da progressão da doença. As medidas de resultado de eficácia foram a sobrevida global (OS), a sobrevida livre de progressão (PFS) e a taxa de resposta objetiva (ORR), avaliadas pelo investigador e pela revisão independente de acordo com RECIST versão 1.1.
No total, 133 pacientes foram randomizados, 66 pacientes para o grupo de Olaratumabe em combinação com doxorrubicina e 67 pacientes para o grupo de doxorrubicina. As características demográficas e da doença na visita basal foram: idade mediana de 58 anos (faixa de 22 a 86), 44% homens; 86% brancos, 8% negros, 3% asiáticos, 2% outros; 56% com PS ECOG 0 e 39% com PS ECOG 1; 65% sem quimioterapia prévia (exceto por terapia adjuvante e neoadjuvante); 38% com leiomiossarcoma, 1,5% com sarcoma sinovial e 61% outras histologias [17% lipossarcoma (8% desdiferenciado, 4% mixóide, 3% bem diferenciado, 1,5% pleomórfico, 1% lipossarcoma não especificado de outro modo (NOS)), 11% sarcoma pleomórfico não diferenciado, 5% angiossarcoma, 5% sarcoma não diferenciado NOS, 3% condrossarcoma mixóide extraesquelético, 2% tumor maligno da bainha do nervo periférico, 2% mixofibrossarcoma, 2% tumor fibroso solitário maligno, 2% sarcoma do estroma endometrial, 1,5% condrossarcoma, 1,5% sarcoma epitelióide, 1,5% fibrossarcoma, 1,5% sarcoma fibromixóide de baixo grau e 5% outras histologias, com um paciente cada].
Todos os pacientes apresentavam doença metastática e foram incluídos em centros norte-americanos. Entre os pacientes randomizados para doxorrubicina, 30 desses pacientes (45%) receberam Olaratumabe como agente único no momento da progressão da doença.
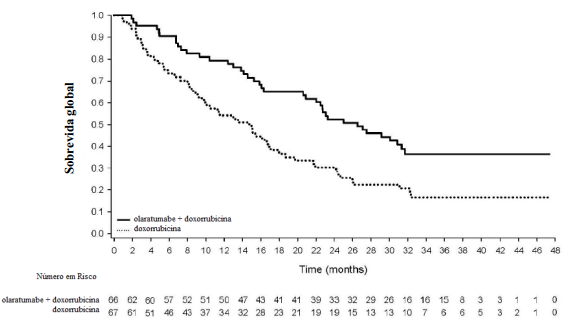
O Estudo Clínico JGDG demonstrou melhora significativa na sobrevida global.
Os resultados de eficácia estão resumidos na Tabela 1 e na Figura 1.
Tabela 1 - Resultados de Eficácia no Estudo Clínico JGDG:
| Olaratumabe + doxorrubicina n=66 | Doxorrubicina n=67 | |
Sobrevida Global | ||
Número de mortes (%) | 39 (59%) | 52 (78%) |
Mediana, meses (IC de 95%) | 26,5 (20,9; 31,7) | 14,7 (9,2; 17,1) |
Proporção de Risco (IC de 95%) a | 0,52 (0,34; 0,79) | |
Valor p | p < 0,05 | |
Sobrevida livre de Progressão b | ||
Número de eventos (%) | 37 (56%) | 34 (51%) |
Mediana, meses (IC de 95%) | 8,2 (5,5; 9,8) | 4,4 (3,1; 7,4) |
Proporção de Risco (IC de 95%) a | 0,74 (0,46; 1,19) | |
Taxa de Resposta Objetiva (CR + PR) b | ||
(IC de 95%) | 18,2% (9,8; 29,6) | 7,5% (2,5; 16,6) |
CR, n (%) | 3 (4,5%) | 1 (1,5%) |
PR, n (%) | 9 (13,6%) | 4 (6%) |
IC: intervalo de confiança.
CR: resposta complet.
PR: resposta parcial.
a Modelo de Cox não estratificado.
b Com base na revisão independente.
Figura 1 - Curvas de Kaplan-Meier da Sobrevida Global:
Características Farmacológicas
Descrição
Olaratumabe possui um peso molecular aproximado de 154 kDa. Olaratumabe é produzido em células NS0 de mamíferos geneticamente projetadas.
Propriedades farmacodinâmicas
Mecanismo de ação
O receptor de PDGF-α é expresso em células tumorais e do estroma, e a sua via de sinalização é importante na proliferação de células de câncer, metástase e o microambiente do tumor. Olaratumabe é um antagonista de PDGFR-α. Olaratumabe é um anticorpo monoclonal de imunoglobulina humana G recombinante subclasse 1 (IgG1) que se liga especificamente a PDGFR-α, bloqueando a ligação PDGF AA, -BB e -CC e a ativação do receptor. Como resultado, Olaratumabe in vitro inibe a sinalização da via de PDGFR-α em células tumorais e do estroma.
Além disso, Olaratumabe in vivo mostrou interromper a via PDGFR-α nas células de tumor e inibir o crescimento do tumor.
As relações de exposição/resposta de Olaratumabe e o ciclo de tempo da resposta farmacodinâmica são desconhecidos.
Imunogenicidade
Uma baixa incidência de ambos os anticorpos anti-droga, emergentes do tratamento, e anticorpos neutralizantes, foram detectados em amostras de ensaios clínicos.
Propriedades farmacocinéticas
Absorção
Olaratumabe é somente para administração intravenosa.
Distribuição
O volume de distribuição (% CV) de Olaratumabe baseado no modelo médio da farmacocinética da população (PopPK), no estado estacionário (Vss) foi de 7,7 L (16%).
Eliminação
O clearance de Olaratumabe, baseado no modelo médio PopPK (% CV), foi de 0,56 L/dia (33%). Isto corresponde a uma meia-vida terminal média de aproximadamente 11 dias.
Farmacocinética em populações especiais
Idade, sexo e raça não tiveram efeito clinicamente significativo sobre a farmacocinética de Olaratumabe com base na análise PopPK. O clearance e o volume de distribuição tiveram uma correlação positiva com o peso corporal.
Insuficiência renal
Não foram realizados estudos formais para avaliar o efeito da insuficiência renal sobre a farmacocinética de Olaratumabe. Com base numa análise farmacocinética populacional, não foram observadas diferenças clinicamente significativas no clearance de Olaratumabe em pacientes com insuficiência renal leve [clearance de creatinina calculada (CLcr) 60-89 mL/min, n=43], ou moderada (CLcr 30-59 mL/min, n=15), em comparação com pacientes com função renal normal (CLcr ≥ 90 mL/min, n=85). Não existem dados disponíveis em pacientes com insuficiência renal grave (CLcr 15-29 mL/min).
Insuficiência hepática
Não foram realizados estudos formais para avaliar o efeito da insuficiência hepática sobre a farmacocinética de Olaratumabe. Com base numa análise farmacocinética populacional, não foram observadas diferenças clinicamente significativas no clearance de Olaratumabe em pacientes com insuficiência hepática leve [bilirrubina total dentro do limite superior do normal (ULN) e AST > ULN ou bilirrubina total > 1,0-1,5 vezes ULN e qualquer nível AST, n=16] ou moderada (bilirrubina total > 1,5-3,0 vezes ULN, n=1), em comparação com pacientes com função hepática normal (bilirrubina total e AST ≤ ULN, n=126).
Não existem dados disponíveis em pacientes com insuficiência hepática grave (bilirrubina total > 3,0 vezes ULN e qualquer nível de AST).

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)