Qual a ação da substância do Emgality?
Resultados de Eficácia
A eficácia de galcanezumabe foi avaliada como um tratamento preventivo para enxaqueca episódica ou crônica em três estudos randomizados, multicêntricos, duplo-cegos e controlados por placebo: dois estudos de 6 meses em pacientes com enxaqueca episódica (estudos 1 e 2) e um estudo de 3 meses em pacientes com enxaqueca crônica (estudo 3).
Enxaqueca episódica
O estudo 1 (NCT02614183) e o estudo 2 (NCT02614196) incluíram adultos com histórico de enxaqueca episódica (4 a 14 dias de enxaqueca por mês). Todos os pacientes foram randomizados na proporção 1:1:2 para receber injeções subcutâneas mensais de galcanezumabe 120 mg, galcanezumabe 240 mg, ou placebo. Todos os pacientes no grupo de galcanezumabe 120 mg receberam uma dose de ataque inicial de 240 mg. Os pacientes foram autorizados a usar tratamentos para cefaleia aguda, incluindo medicamentos específicos para enxaqueca (isto é, triptanos, derivados da ergotamina), anti-inflamatórios não-esteroidais (AINEs) e paracetamol durante o estudo.
Os estudos excluíram pacientes em qualquer outro tratamento preventivo de enxaqueca, pacientes com cefaleia por uso excessivo de medicação, pacientes com anomalias no eletrocardiograma (ECG) compatíveis com um evento cardiovascular agudo e pacientes com histórico de acidente vascular cerebral, infarto do miocárdio, angina instável, intervenção coronariana percutânea, revascularização do miocárdio, trombose venosa profunda, ou embolia pulmonar dentro de 6 meses da triagem.
O desfecho primário de eficácia dos estudos 1 e 2 foi a alteração média em relação ao período basal do número de dias de enxaqueca por mês durante o período de seis meses de tratamento. Os desfechos secundários principais incluíram a taxa de resposta (porcentagem média de pacientes com redução em relação ao período basal de pelo menos 50%, 75% e 100% do número de dias de enxaqueca por mês, durante o período de seis meses de tratamento), a alteração média em relação ao período basal no número de dias de enxaqueca por mês nos quais qualquer medicação para cefaleia aguda foi utilizada durante o período de seis meses de tratamento, e o impacto da enxaqueca nas atividades diárias, conforme avaliado pela alteração média em relação ao período basal, no domínio de Restrição Funcional do Questionário de Qualidade de Vida Específico para Enxaqueca versão 2.1 (MSQ v2.1) durante os últimos três meses de tratamento (meses 4 a 6). As pontuações são escalonadas de 0 a 100, com pontuações mais altas indicando menor impacto da enxaqueca nas atividades diárias.
No estudo 1, um total de 858 pacientes (718 mulheres, 140 homens) com idade variando de 18 a 65 anos, foram randomizados. Um total de 703 pacientes completaram a fase duplo-cega de 6 meses. No estudo 2, um total de 915 pacientes (781 mulheres, 134 homens) com idade variando de 18 a 65 anos, foram randomizados. Um total de 703 pacientes completaram a fase duplo-cega de 6 meses. No estudo 2, um total de 915 pacientes (781 mulheres, 134 homens) com idade variando de 18 a 65 anos, foram randomizados. Um total de 785 pacientes completaram a fase duplo-cega de 6 meses. No estudo 1 e no estudo 2, a frequência média de enxaqueca no período basal foi de aproximadamente 9 dias de enxaqueca por mês, e foi semelhante entre os grupos de tratamento.
Galcanezumabe 120 mg demonstrou melhorias estatisticamente significantes nos desfechos de eficácia em comparação com placebo no período de 6 meses, conforme resumido na Tabela 1. O tratamento com galcanezumabe com a dose de 240 mg por mês não demonstrou benefício adicional em relação à dose de galcanezumabe 120 mg uma vez por mês.
Tabela 1: Desfechos de eficácia nos estudos 1 e 2
| Estudo 1 | Estudo 2 | |||
| Galcanezumabe 120 mg N= 210 | Placebo N= 425 | Galcanezumabe 120 mg N= 226 | Placebo N= 450 | |
| Dias de enxaqueca por mês (durante os meses 1 a 6) | ||||
| Dias de enxaqueca no período basal | 9,2 | 9,1 | 9,1 | 9,2 |
| Alteração média em relação ao período basal | -4,7 | -2,8 | -4,3 | -2,3 |
| Diferença do placebo* | -1,9 | - | -2,0 | - |
| ≥ 50% de redução dos dias de enxaqueca por mês (durante os meses 1 a 6) | ||||
| % de pacientes responsivos* | 62% | 39% | 59% | 36% |
| ≥ 75% de redução dos dias de enxaqueca por mês (durante os meses 1 a 6) | ||||
| % de pacientes responsivos* | 39% | 19% | 34% | 18% |
| 100% de redução dos dias de enxaqueca por mês (durante os meses 1 a 6) | ||||
| % de pacientes responsivos* | 16% | 6% | 12% | 6% |
| Dias mensais de enxaqueca que a medicação aguda foi utilizada (durante os meses 1 a 6) | ||||
| Alteração média em relação ao período basal (dias)* | -4,0 | -2,2 | -3,7 | -1,9 |
| Pontuação do Domínio de Restrição Funcional do MSQ (durante os meses 1 a 6) | ||||
| Período basal | 51,4 | 52,9 | 52,5 | 51,4 |
| Alteração média em relação ao período basala | 32,4 | 24,7 | 28,5 | 19,7 |
| Diferença do placebo* | 7,7 | - | 8,8 | - |
a N= 189 para galcanezumabe 120 mg e N= 377 para placebo no estudo 1; N= 213 para galcanezumabe 120 mg e N= 396 para placebo no estudo 2.
* p < 0,001
Figura 1: Alteração no número de dias de enxaqueca por mês em relação ao período basal no estudo 1a
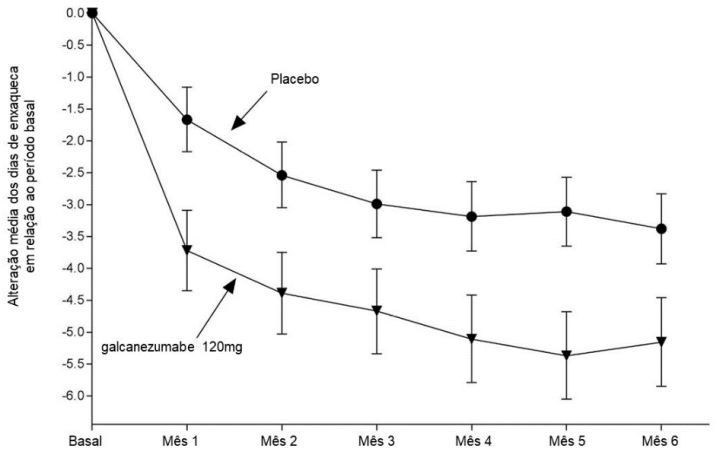
a São apresentadas as médias dos mínimos quadrados e intervalos de confiança de 95%.
Figura 2: Alteração no número de dias de enxaqueca por mês em relação ao período basal no estudo 2a
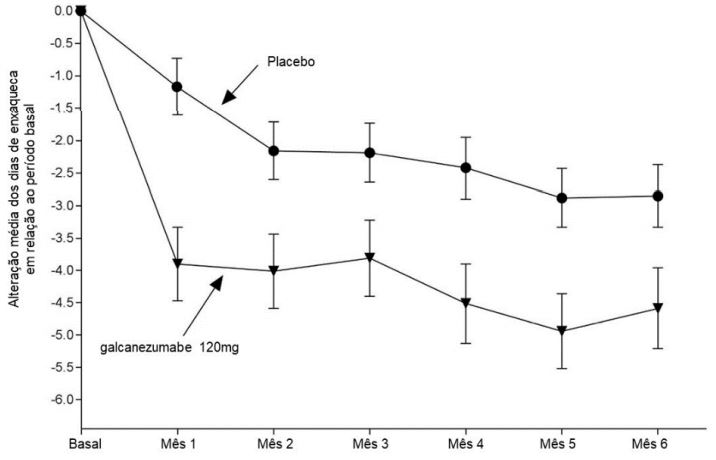
a São apresentadas as médias dos mínimos quadrados e intervalos de confiança de 95%.
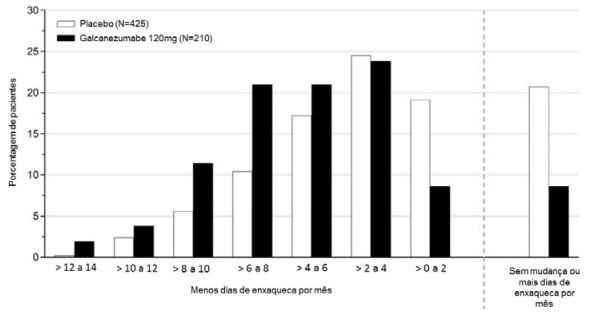
A Figura 3 mostra a distribuição da alteração em relação ao período basal no número médio de dias de enxaqueca por mês em intervalos de 2 dias, por grupo de tratamento, no estudo 1. Um benefício do tratamento com galcanezumabe em relação ao placebo é observado ao longo de uma série de alterações nos dias de enxaqueca por mês em relação ao período basal.
Figura 3: Distribuição da alteração da média de dias de enxaqueca por mês em relação ao período basal durante os meses 1 a 6 por grupo de tratamento no estudo 1
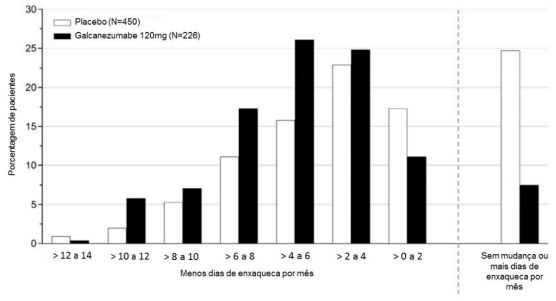
A Figura 4 mostra a distribuição da alteração em relação ao período basal no número médio de dias de enxaqueca por mês em intervalos de 2 dias, por grupo de tratamento, no estudo 2. Um benefício do tratamento com galcanezumabe em relação ao placebo é observado ao longo de uma série de alterações nos dias de enxaqueca por mês em relação ao período basal.
Figura 4: Distribuição da alteração da média de dias de enxaqueca por mês em relação ao período basal durante os meses 1 a 6 por grupo de tratamento no estudo 2
Enxaqueca crônica
O estudo 3 (NCT02614261) incluiu adultos com histórico de enxaqueca crônica (≥ 15 dias de cefaleia por mês com ≥ 8 dias de enxaqueca por mês). Todos os pacientes foram randomizados na proporção 1:1:2 para receber injeções subcutâneas mensais de galcanezumabe 120 mg, galcanezumabe 240 mg, ou placebo, durante um período de tratamento de 3 meses. Todos os pacientes no grupo de galcanezumabe 120 mg receberam uma dose de ataque inicial de 240 mg.
Os pacientes foram autorizados a usar tratamentos para cefaleia aguda, incluindo medicamentos específicos para enxaqueca (isto é, triptanos, derivados da ergotamina), anti-inflamatórios não-esteroidais (AINEs) e paracetamol. Um subconjunto de pacientes (15%) foi autorizado a usar uma medicação preventiva de enxaqueca concomitantemente. Pacientes com cefaleia por uso excessivo de medicação foram autorizados a se inscrever.
O estudo excluiu pacientes com anomalias no eletrocardiograma (ECG) compatíveis com um evento cardiovascular agudo e pacientes com histórico de acidente vascular cerebral, infarto do miocárdio, angina instável, intervenção coronariana percutânea, revascularização do miocárdio, trombose venosa profunda, ou embolia pulmonar dentro de 6 meses da triagem.
O desfecho primário foi a alteração média em relação ao período basal no número de dias de enxaqueca por mês durante o período de 3 meses de tratamento. Os desfechos secundários foram as taxas de resposta (porcentagem média de pacientes com redução em relação ao período basal de pelo menos 50%, 75% e 100% de dias de enxaqueca no mês, durante o período de 3 meses de tratamento), a alteração média em relação ao período basal no número de dias de enxaqueca por mês nos quais qualquer medicação para cefaleia aguda foi utilizada durante o período de 3 meses de tratamento, e o impacto da enxaqueca nas atividades diárias, conforme avaliado pela alteração média em relação ao período basal, no domínio de Restrição Funcional do Questionário de Qualidade de Vida Específico para Enxaqueca versão 2.1 (MSQ v2.1) no mês 3. As pontuações são escalonadas de 0 a 100, com pontuações mais altas indicando menor impacto da enxaqueca nas atividades diárias.
No estudo 3, um total de 1113 pacientes (946 mulheres, 167 homens) com idade variando de 18 a 65 anos, foram randomizados. Um total de 1037 pacientes completou a fase duplo-cega de 3 meses. O número médio de dias de enxaqueca por mês no período basal era de aproximadamente 19.
Galcanezumabe 120 mg demonstrou melhora estatisticamente significante para a alteração média em relação ao período basal no número de dias de enxaqueca por mês ao longo do período de tratamento de 3 meses, e na porcentagem média de pacientes atingindo pelo menos 50% de redução em relação ao período basal do número de dias de enxaqueca por mês ao longo do período de 3 meses de tratamento, conforme resumido na Tabela 2.
O tratamento com galcanezumabe com a dose mensal de 240 mg não demonstrou qualquer benefício adicional em relação à dose de galcanezumabe 120 mg uma vez por mês.
Tabela 2: Desfechos de eficácia no estudo 3
| Galcanezumabe 120 mg N= 273 | Placebo | |
Dias de enxaqueca por mês (durantes os meses 1 a 3) | ||
Dias de enxaqueca no período basal | 19,4 | 19,6 |
Alteração média em relação ao período basal | -4,8 | -2,7 |
Diferença do placeboa | -2,1 | - |
≥ 50% de redução dos dias de enxaqueca por mês (durantes os meses 1 a 3) | ||
% de pacientes responsivosa | 28% | 15% |
a p < 0,001.
O estudo 3 utilizou um procedimento de teste sequencial para controlar a taxa de erro do Tipo-I para os múltiplos desfechos secundários. Uma vez que um desfecho secundário não atingiu o nível requerido de significância estatística, o teste formal de hipóteses foi terminado para desfechos subsequentes, e os valores-p foram considerados apenas nominais. No estudo 3, galcanezumabe 120 mg não foi significativamente melhor do que o placebo na proporção de pacientes com redução ≥ 75% ou 100% dos dias de enxaqueca. Pacientes tratados com galcanezumabe 120 mg apresentaram uma redução nominalmente maior no número de dias de enxaqueca por mês em que a medicação aguda foi tomada (-4,7 para galcanezumabe 120 mg versus. -2,2 para placebo; valor-p nominal < 0,001), e a alteração média em relação ao período basal no domínio de Restrição Funcional do MSQ no mês 3 foi nominalmente maior em pacientes tratados com galcanezumabe 120 mg do que em pacientes com placebo (21,8 para galcanezumabe 120 mg versus 16,8 para placebo; valor-p nominal < 0,001).
Figura 5: Alteração no número de dias de enxaqueca por mês em relação ao período basal no estudo 3a
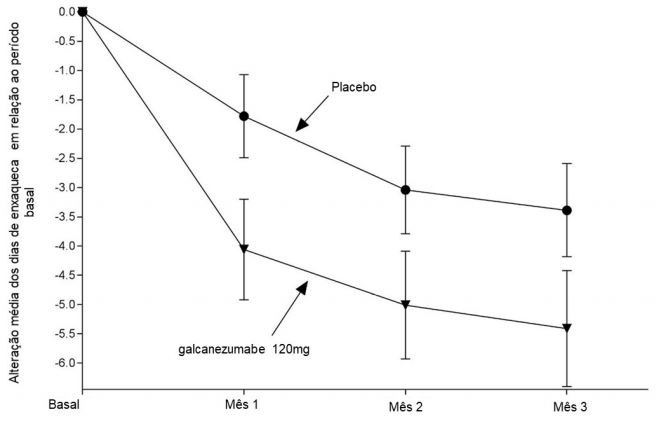
a São apresentadas as médias dos mínimos quadrados e intervalos de confiança de 95%.
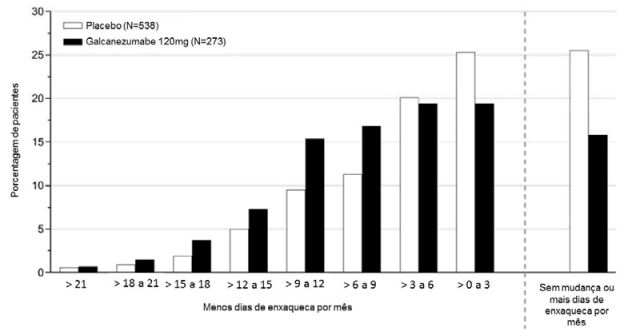
A Figura 6 mostra a distribuição da alteração em relação ao período basal no número médio de dias de enxaqueca por mês durante o período de 3 meses de estudo, em intervalos de 3 dias, por grupo de tratamento. Um benefício do tratamento com galcanezumabe em relação ao placebo é observado ao longo de uma série de alterações nos dias de enxaqueca por mês em relação ao período basal.
Figura 6: Distribuição da alteração da média de dias de enxaqueca por mês em relação ao período basal durante os meses 1 a 3 por grupo de tratamento no estudo 3
Estudo de Fase 3 em população com falha prévia em 2 a 4 categorias de medicamentos profiláticos para enxaqueca
O estudo CONQUER teve um período de tratamento de 3 meses, randomizado, duplo-cego, controlado por placebo, seguido por uma extensão de 3 meses de estudo aberto. O estudo recrutou pacientes que tiveram falhas prévias em 2 a 4 categorias de medicamentos profiláticos para enxaqueca nos últimos 10 anos, com idade entre 18 e 75 anos, que atenderam o critério do International Classification of Headache Disorders (ICHD) para o diagnóstico de enxaqueca, com ou sem aura, com pelo menos 4 dias de enxaqueca por mês ou enxaqueca crônica. Galcanezumabe 120 mg/mês com uma dose de ataque de 240 mg demonstrou uma redução clinicamente importante e estatisticamente significativa no número médio de dias de enxaqueca por mês durante a fase dos 3 meses de tratamento duplo-cego em comparação com placebo. Os dados do estudo CONQUER suportam as principais descobertas dos estudos anteriores de eficácia na enxaqueca, ou seja, o tratamento com galcanezumabe levou a uma redução média nos dias de enxaqueca por mês (4,1 dias em comparação com 1,0 dia no grupo placebo; p < 0,0001). Também foi observada uma redução média nos dias de enxaqueca por mês nas subpopulações de enxaqueca episódica (2,9 dias para galcanezumabe em comparação com 0,3 dias para placebo; p < 0,0001) e enxaqueca crônica (5,9 dias para galcanezumabe em comparação com 2,2 dias para placebo; p < 0,0001).
Características Farmacológicas
Descrição
Galcanezumabe é um anticorpo monoclonal humanizado de IgG4, que se liga ao peptídeo relacionado ao gene da calcitonina (CGRP) e impede sua atividade biológica sem bloquear o receptor do CGRP. Galcanezumabe é produzido em células de ovário de Hamster Chinês (CHO) por tecnologia de DNA recombinante. Galcanezumabe é composto por duas cadeias kappa leves idênticas de imunoglobulina e duas cadeias gama pesadas idênticas de imunoglobulina, e tem um peso molecular de 144.084 Da, não glicosilado, com ligação dissulfeto.
Propriedades farmacodinâmicas
Mecanismo de ação
Galcanezumabe é um anticorpo monoclonal humanizado de IgG4, que se liga ao peptídeo relacionado ao gene da calcitonina (CGRP) e impede sua atividade biológica, sem bloquear o receptor do CGRP.
Concentrações séricas elevadas de CGRP foram associadas à enxaqueca. Além disso, infusões de CGRP podem induzir ataques semelhantes à enxaqueca em alguns indivíduos com histórico de enxaqueca. Galcanezumabe tem como alvo o CGRP e se liga com alta afinidade (KD= 31 pM) e elevada especificidade (> 10.000 vezes versus os peptídeos relacionados adrenomedulina, amilina, calcitonina e intermedina).
O CGRP é um mediador importante do fluxo sanguíneo cutâneo induzido por capsaicina. Doses únicas de galcanezumabe (75, 200 ou 600 mg) resultaram na atenuação do fluxo sanguíneo cutâneo induzido por capsaicina no dia 3. A administração de galcanezumabe 150 mg a cada 2 semanas durante 6 semanas (total de 4 doses) resultou na inibição do fluxo sanguíneo cutâneo induzido por capsaicina por ao menos 134 dias depois que a última dose foi administrada.
Propriedades farmacocinéticas
Absorção
Com base em uma análise da farmacocinética (PK) da população, após uma dose de ataque de 240 mg, a concentração sérica máxima (Cmáx) de galcanezumabe foi de aproximadamente 30 μg/mL [coeficiente de variação (CV) de 27%]. Doses mensais de 120 mg ou 240 mg alcançaram o steady-state Cmáx (Cmáx,ss) de aproximadamente 28 μg/mL (CV de 35%) ou 54 μg/mL (CV de 31%), respectivamente. O local da injeção não influenciou a absorção de galcanezumabe de modo significativo.
Distribuição
Com base em uma análise de PK da população, o volume de distribuição aparente (V/F) de galcanezumabe foi de 7,3 L.
Metabolismo
Por ser um anticorpo monoclonal de IgG4 humanizado, espera-se que galcanezumabe seja degradado em pequenos peptídeos e aminoácidos por meio de vias catabólicas, do mesmo modo que a IgG endógena.
Eliminação
Com base em uma análise de PK da população, o clearance aparente (CL/F) de galcanezumabe foi de aproximadamente 0,008 L/h e a meia-vida de galcanezumabe foi de 27 dias.
Linearidade da dose
A exposição a galcanezumabe aumenta proporcionalmente com a dose. Com base em uma análise de PK da população que incluiu doses que variaram de 5 – 300 mg, a taxa de absorção, o CL/F e o V/F foram independentes da dose.
Farmacocinética em populações especiais
Idade, sexo, peso, raça e etnia
Não é necessário nenhum ajuste da dose com base na idade, sexo, peso, raça ou etnia, já que não houve efeito clinicamente significativo desses fatores no CL/F ou no V/F de galcanezumabe.
Comprometimento renal ou hepático
Não foram realizados estudos de farmacologia clínica específicos para avaliar os efeitos do comprometimento renal e do comprometimento hepático na PK de galcanezumabe. A eliminação renal de anticorpos monoclonais de IgG é baixa. Do mesmo modo, os anticorpos monoclonais de IgG são eliminados principalmente via catabolismo intracelular, e não se espera que o comprometimento hepático influencie no clearance de galcanezumabe. Com base em uma análise de PK da população, a concentração de bilirrubina ou o clearance de creatinina não influenciaram significativamente o CL/F de galcanezumabe.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)